血清miR-122 和miR-18a 作为HBV 相关肝病诊断标志物的可行性研究
2020-02-23王远懿
王远懿
(湖南师范大学附属长沙医院,长沙市第四医院,长沙 410006)
肝病随着现今人们生活质量的提升而上升,尤其是针对一些慢性肝病患者,我国是慢性肝病大国,其病毒携带者已达1.2 亿以上,而且呈不断上升的趋势,直接影响着人们的婚姻家庭、升学就业等方面的问题,给社会和家庭带来了巨大的灾难,已成为影响人们生活质量的重要疾病[1-2]。长期的慢性乙型肝炎病毒(HBV)感染是肝纤维化、肝硬化及肝癌的高危因素,严重威胁到患者的身体健康,且容易引发其他并发症,临床针对慢性肝病的诊治高度重视,并加强研究与分析[3-4]。MicroRNA(miRNAs 微小PaqA)是一种单链非编码RNA分子,广泛存在于人类、动物、植物的细胞中,其长度约19~25nt,通过与靶基因序列特异性相互作用在转录水平调节基因表达,肿瘤的发生、进展有关,作为一类新型基因调节剂与肝癌的关系相当密切[5-6]。近年来研究发现miRNA 在肝癌组织中存在表达差异性,因此认为检测特定miRNA 表达谱的改变将有助于多种疾病的早期诊断,本研究探讨血清miR-122 和miR-18a 作为HBV 相关肝病诊断标志物的可行性。
1 资料与方法
1.1 一般资料 本研究所纳入的研究对象均经过患者知情同意,对长沙市第四医院2017 年8 月~2019 年8月收治的300 例HBV 相关肝病患者展开对照研究,根据患者疾病类型分为HBV 相关肝硬化组、HBV 相关肝癌组及乙型肝炎组各100 例,另选取100 例健康体检者作为对照组,经过本院伦理委员会批准,研究对象均为我院2018 年2 月~2019 年2 月所收治,研究对象基线资料存在可比性,无明显差异(P>0.05),见表1。
表1 一般资料比较(n=100)
纳入标准:(1)无其他重要脏器功能受损。(2)资料健全者。(3)所有患者均通过2016 年中华医学会制定的《肝病患者的诊断与治疗标准》确诊[7]。
排除标准:(1)6 个月内接受抗病毒及免疫调节治疗的患者。(2)心、脑、肾及其它慢性病。(3)中途退出/转院者。
1.2 方法
1.2.1 血液采集 采集研究对象5mL 晨起空腹外周静脉血,置于室温2 h 后予离心,标本离心(3000 r/min,10min),取上清液分装置于-80℃低温冰箱冻存集中检测。
1.2.2 RNA 提取和反转录 利用德国Qiagen 公司的MicroMini Kit 试剂盒提取血清样本中总RNA,实验过程严格参照产品说明书。并使用Nanodrop-1000(Thermo Scientific)紫外分光光度计测量其浓度。将200 ng 总RNA 样本与5×miScript RT Buffer 4µL、miScriptReverse Transcriptase Mix 1µL、RT 引物1µL、dNTP 混合物0.5µL,RNA 酶抑制剂0.25µL 共同混合,最后用DEPC水补足20µL 制成混合液。将混合液置于以下培育条件进行逆转录:37℃×60min,95℃×5min,后冷却至4℃。并将最终cDNA 产物保存至-80℃备用。
1.2.3 RT-PCR 通过SYBR Green 法,利用miScript SYBR Green PCR(Qiagen)试剂盒进行real-time PCR 定量检测microRNA,按如下体系操作:取1μL cDNA 样品,混合12.5μL 2×QuantiTect SYBRGreen PCR Master Mix 溶液,1μL 10×miScript 通用引物溶液,1μL of 10×miScript 配对引物溶液,最后用9.5μL DEPC 水补足25μL 混合液。将7500Real-Time PCR 仪(Biosystems)设置扩增条件:95℃×10min,然后将95℃×15s、56℃×30s,72℃×35s 过程进行40 个循环,最终将产物放置于-20℃保存。所有实验重复3 遍。
1.3 观察指标 比较不同研究对象的血清miR-122 和miR-18a 差异。
1.4 统计学处理 本文研究中选择SPSS 18.0 系统计算数据,计数资料与计量资料分别采用F 检验及χ2检验,计数资料用百分比表示,计量资料以均数±标准差表示,数据差异以P 值是否小于0.05 进行判定。
2 结果
2.1 不同研究对象血清miR-122、miR-18a 表达差异
与对照组miR-122 相比,HBV 相关肝硬化组、HBV相关肝癌组、乙型肝炎组中表达下调,存在显著差异(P<0.05),与对照组miR-18a 相比,HBV 相关肝硬化组、HBV 相关肝癌组、乙型肝炎组中表达上调,存在显著差异(P<0.05),参考表2。
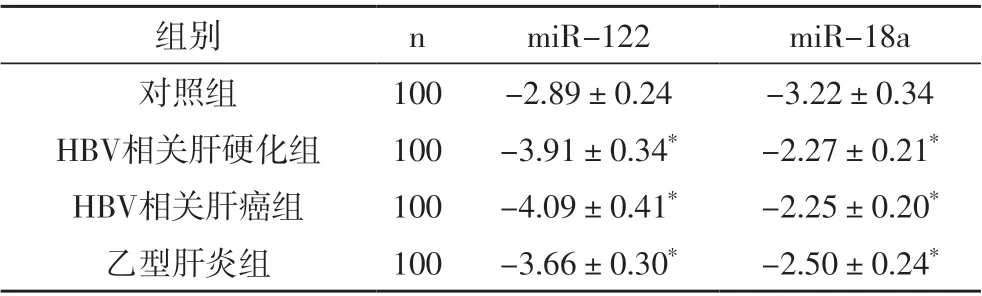
表2 不同研究对象血清miR-122、miR-18a表达差异
2.2 血清miR-122、miR-18a 诊断的敏感性与特异性
应用ROC 曲线及曲线下面积(AUG)评估miR-122、miR-18a 的诊断价值,miR-122 敏感性、特异性分别为73.00%、70.00%,miR-18a 为83.00%、60.00%,见表3。
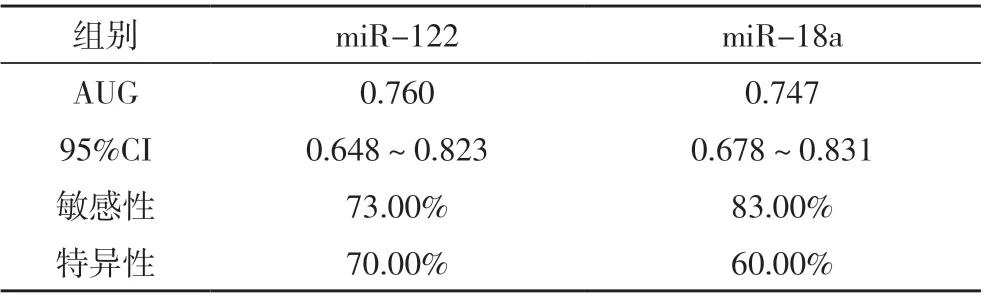
表3 血清miR-122、miR-18a诊断的敏感性与特异性
3 讨论
我国是乙肝感染的高发区,肝硬化患者的数量逐年增多。为提高肝硬化患者的生存期,改善其生活质量,降低其癌变率及死亡率,肝硬化的早诊早治显得尤为重要[8]。
肿瘤标志物一类由肿瘤细胞异常代谢或是宿主对肿瘤的刺激反应而产生,分泌或脱落到体液或组织液中,能够较为准确地反映肿瘤细胞的转化阶段和进展特性,与肿瘤发展具有较大关系。肿瘤标志物的产生受到体内多种因素的影响,与肿瘤的类型、良恶性、发生发展有关,在部分正常组织和良性病变的情况下也可能有极少量表达,但在肿瘤组织中含量极大增高。它们的存在或量变可以提示肿瘤的性质,借以了解肿瘤的组织发生、细胞分化、细胞功能,以帮助肿瘤的诊断、分类、预后判断以及治疗指导。因为肿瘤标志物存在于肿瘤患者的组织、体液和排泄物中,因此能够通过免疫学、生物学及化学的方法检测到。miRNA(microRNA)是一类长度约18~25nt 的内源性非编码小RNA,由一段具有发夹样环状结构、长度约70~80nt 的单链RNA 前体(pre-miRNA)剪切后生成[9-10]。在人体内,它通过与靶基因mRNA 分子3’UTR 区结合,抑制靶基因的翻译,负调控靶基因的蛋白水平。研究表明它在胚胎发育、细胞分化、血管形成、肿瘤发生等许多重要病理生理过程中发挥调控作用[11-12]。在肿瘤方面,研究发现miRNA 与肿瘤的发生、转移微环境形成、浸润甚至治疗耐受等有密切关系[13]。近年来,众多研究表明miRNA 与肿瘤发生关系密切,由于相关的靶基因对肿瘤的作用不同,不同miRNA 在肿瘤中表达情况也存在差异,因而可以根据这种表达差异来判断miRNA对肿瘤的调控作用[14-15]。本研究选取了miR-122 和miR-18a 对HBV 相关肝脏疾病进行研究,研究结果表明,与对照组miR-122 相比,HBV 相关肝硬化组、HBV相关肝癌组、乙型肝炎组中表达下调,存在显著差异,与对照组miR-18a 相比,HBV 相关肝硬化组、HBV 相关肝癌组、乙型肝炎组中表达上调,存在显著差异,应用ROC 曲线及曲线下面积(AUG)评估miR-122、miR-18a 的诊断价值,miR-122 敏感性、特异性分别为73.00%、70.00%,miR-18a 为83.00%、60.00%。研究发现,miRNA 的异常表达分抑癌性miRNA 与原癌性miRNA 两类:前者在正常组织中高表达,在癌性组织中低表达,后者则反之。本研究结果表明,miR-18a 作为癌性miRNA,miR-122 作为抑癌性miRNA 参与了肝病的进展,在先前的miRNA 在乙型肝炎的研究中,通过Western blot 及免疫荧光等方法证实上述结论,表明miR-122 参与乙型病毒性肝炎的发生、发展过程,可能原因在于患者出现HBV 相关肝病后,其正常肝细胞数量减少或功能下降,肝脏组织结构发生破坏,引起微循环障碍,从而导致肝脏对抗原的处理能力下降,进而导致miR-122 表达下调,miR-18a 表达上调,或者低水平的miR-122、高水平的miR-18a 使其抗肝纤维作用减弱,从而导致肝病的进一步进展。
综上所述,miR-18a 在HBV 相关肝病血清中表达上调,miR-122 表达下调,两者对HBV 相关肝病的诊断具有潜在价值,此方法可广泛应用于临床。
