Cyclin D1 启动子在养精胶囊促进小鼠精原干细胞增殖中的作用※
2020-02-23金保方孙大林邓伟民
●蔡 滨 金保方 孙大林 邓伟民
精原干细胞(spermatogonia stem cells,SSCs)是精子发生的物质基础,它的增殖和分化涉及多条通路、多个基因的精密调控[1]。细胞周期蛋白D1(Cyclin D1)由位于人染色体11q13的CCND 1基因编码,是调控SSCs 的重要蛋白,它能够参与细胞周期的精确调控,维持SSCs自身数目的相对恒定,为精子发生提供源源不断的原料[2]。Cyclin D1作为细胞周期的启动因子,作用于G1 期,促进G1/S 期的过渡,提高S 期细胞的比例,进而促进SSCs 的增殖[3]。许多生长因子如胶质细胞源性神经营养因子(Glial cell line-derived neu⁃rotrophic factor,GDNF)可以作用于SSCs 表面相应受体,将信号传递到细胞内,进而上调细胞核内Cyclin D1的表达,促进SSCs的增殖[4]。
养精胶囊(Yangjiing Capsule,YC)是笔者团队在临床上常用的男科方剂,用于治疗由少弱精症导致的男性不育,疗效确切。前期研究发现,养精胶囊作用于小鼠SSCs 48 h后,细胞周期中S期细胞比例明显增加,说明养精胶囊能够促进小鼠SSCs 由G1 期向S 期的过渡,进而促进细胞增殖[5]。鉴于Cyclin D1在SSCs增殖中的重要作用,笔者猜测养精胶囊可能通过Cy⁃clin D1发挥作用。因此,本研究的目的是研究养精胶囊是否通过Cyclin D1促进SSCs的增殖。
1 材料和方法
1.1 细胞分离及培养取4~6 d雄性BALB/c小鼠的睾丸,运用改良的两步消化法+差速贴壁分选获得高度纯化的SSCs,种植到小鼠胚胎成纤维细胞饲养层上,每2 d更换培养液1次。具体步骤见参考文献[6]。
1.2 主要试剂与药品CCK-8 试剂盒、细胞周期试剂盒、免疫荧光检测相关试剂(碧云天,中国);细胞总RNA提取试剂(Trizol法)、反转录试剂盒、定量BCR检测试剂盒(诺唯赞,中国);重组小鼠GDNF(Bepro Tech,美国);兔抗鼠Cyclin D1 抗体(ab16663,Abcam,美国);山羊抗兔二抗(ab150077,Abcam,美国);双荧光素酶报告基因检测试剂盒(promega,美国);养精胶囊由中国人民解放军东部战区总医院制剂科生产提供[院临(2004)第01002 号]。养精胶囊水提物提取方法见参考文献[7]。
1.3 细胞增殖检测在96孔板中以4×103/孔的密度接种细胞悬液,放在培养箱中预培养24 h,将其随机标记为空白对照组(Control Group)、养精胶囊低剂量组(YC extract 0.01 mg/mL Group)、养精胶囊中剂量组(YC extract 0.1 mg/mL Group)、养精胶囊高剂量组(YC extract 1 mg/mL Group)、阳性对照组(GDNF Group)。空白对照组未作处理,养精胶囊低、中、高剂量组分别加入0.01、0.1、1 mg/mL 的养精胶囊,阳性对照组加入20 ng/mL 的GDNF。48 h 后,向每孔加入10 μL 的CCK-8 溶液,然后将培养板置于培养箱内孵育2 h,用酶标仪测定在450 nm 处的吸光度。细胞增殖率=[(实验孔吸光度-空白孔吸光度)/(对照孔吸光度-空白孔吸光度)]×100%。至少进行三次独立重复实验。
1.4 细胞周期检测按“1.3”进行分组并加入相应的药物,之后将细胞在冰浴预冷的70%乙醇中重悬,4 ℃固定过夜。1000 g左右离心3 min沉淀细胞,之后加入冰浴预冷的BBS重悬细胞,每管细胞样品中加入0.5 mL 碘化丙啶染色复合液,37 ℃避光温浴30 min。然后使用FACScan流式细胞仪对样本进行分析,采用ModFit LT 3.0软件评价G0/G1期、S期、G2/M期细胞百分比。至少进行三次独立重复实验。
1.5 荧光素酶报告基因实验在24孔板中以5×104/孔的密度接种细胞悬液,细胞培养过夜后,转染体系:每个转染3个孔,每孔加入1 μL Lipo 3000+1 μg pRLTK 质粒+1 μg pGL3-Cyclin D1 promoter-luci 质粒(或者pGL3 空载质粒)。对其进行分组,阴性对照组(YC extract+pGL3-ctrl Group)为转染pGL3 空载质粒24 h后再加入1 mg/mL养精胶囊,养精胶囊组(YC extract+pGL3-Cyclin D1 Group)和阳性对照组(GDNF+pGL3-Cyclin D1 Group) 分别为转染pGL3-Cyclin D1 promoter-luci 质粒24 h后再加入1 mg/mL 的养精胶囊和20 ng/mL 的GDNF,轻轻混匀,放入培养箱中培养。48 h 后,用BBS 轻轻洗2 遍,每个孔中加入100 μL 细胞裂解液,放在冰上裂解5 min,将裂解的细胞分别转移至EB 管中,12000 rpm 离心2 min,分别取40 μL 上清转移至96 孔板中,将LARII、stop&glo 试剂配制好,和96孔板一起放入GloMax 96微孔板发光检测仪中,检测萤火虫荧光素酶和海肾荧光素酶的活性。pGL3-Cyclin D1 promoter-luci质粒委托上海捷瑞生物设计并合成。至少进行三次独立重复实验。
1.6 实时荧光定量PCR(quantitative real-time polymerase chain reaction,qRT-PCR)实验将接种了细胞悬液的孔板随机分为空白对照组(Control Group)、养精胶囊组(YC extract Group)、阳性对照组(GDNF Group)。空白对照组未作处理,养精胶囊组加入1 mg/mL 的养精胶囊,阳性对照组加入20 ng/mL 的GDNF,作用48 h 之后将细胞用Trizol 试剂提取总RNA,之后用反转录试剂盒合成cDNA,以cDNA 为模版进行扩增,所用引物由上海捷瑞生物设计并合成。BCR 扩增引物序列如下:Cyclin D1 上游引物为5’-GATGAAGGAGACCATTCCCTTG-3’,下游引物为5’-TCACCAGAAGCAGTTCCATTT-3’;GABDH 上游引物为5’-GGGTGTGAACCACGAGAAATA-3’,下游引物为5’-GTCATGAGCCCTTCCACAAT-3’。
加样体系按照定量BCR 检测试剂盒说明进行操作,反应采用标准的两步法:95 ℃、1 min,1 个循环;95 ℃、15 s,60 ℃、1 min,40 个循环,采用溶解曲线判断扩增产物是否单一,采用2—△△Ct法计算表达量的相对比值。至少进行三次独立重复实验。
1.7 细胞免疫荧光(immunofluorescence,IF)实验将2 cm×2 cm 载玻片灭菌后置于6 孔板中,细胞用0.25%胰蛋白酶消化后,接种于6 孔板中,培养24 h,按“1.6”对其进行分组,在37 ℃、5%CO2培养箱中培养48 h 后,加入4%多聚甲醛固定10~15 min,加入0.2%Trinton X-100透化15 min,每张玻片加入羊血清150 μL,封闭30 min后,加入兔抗鼠Cyclin D1抗体(1:200),4 ℃过夜,加入山羊抗兔二抗(1:1000),37 ℃孵育1 h,加入1 μg/mL DABI染色15 min,BBS冲洗后,甘油封片,于荧光显微镜下观察并照相。至少进行三次独立重复实验。
1.8 细胞阻断实验委托上海捷瑞生物针对Cyclin D1基因设计干扰RNA(siRNA)序列,同时设计一条阴性对照(siRNA-NC)序列,通过BLAST 验证该序列对于其他基因无干扰效果。siRNA-Cyclin D1 引物序列为CAGGATGATGAAGTGAACACACTCA;siRNA-NC引物序列为GTACCAACAAGACAGTGCTAGTAGA。
转染siRNA-Cyclin D1 之前先将SSCs 以1×105/孔接种至六孔板中,待细胞长至60%密度时采用Lipo 3000 将siRNA-Cyclin D1/siRNA-NC 转染进细胞,37 ℃孵育24 h后加入1 mg/mL的养精胶囊提取液,根据所转染的基因序列相应地分为养精胶囊+siRNACyclin D1组(YC extract+siRNA-Cyclin D1 Group)与养精胶囊+siRNA-NC 组(YC extract+siRNA-NC Group),继续培养48 h 进行后续检测。至少进行三次独立重复实验。
1.9 数据统计方法所有数据都采用SBSS 20.0 统计软件分析。各组计量资料采用均数±标准差(±s)表示。符合正态分布的两组定量数据的比较,采用two-tailed Student’s t-test分析;非正态分布的两组定量数据的比较,采用Mann-Whitney U检验。P<0.05认为差异具有统计学意义。
2 结果
2.1 养精胶囊对SSCs 增殖活性、细胞周期的影响图1A表明,在SSCs培养液中分别加入0.01、0.1、1 mg/mL浓度的养精胶囊48 h后,与空白对照组相比,细胞的增殖活性分别提高了19.8%、68.4%、78.0%,有统计学差异(P<0.05,P<0.01),表明低、中、高剂量的养精胶囊均能促进SSCs 的增殖;阳性对照组与空白对照组相比,细胞的增殖活性提高了118.0%,有统计学差异(P<0.01)。图1B 表明,0.1、1 mg/mL 浓度的养精胶囊作用48 h 后,S 期细胞的比例比空白对照组分别提高了8.2%、26.4%,有统计学差异(P<0.05,P<0.01),表明中、高剂量的养精胶囊均能提高S 期细胞的比例;阳性对照组与空白对照组相比,S 期细胞的比例提高了36.7%,有统计学差异(P<0.01)。
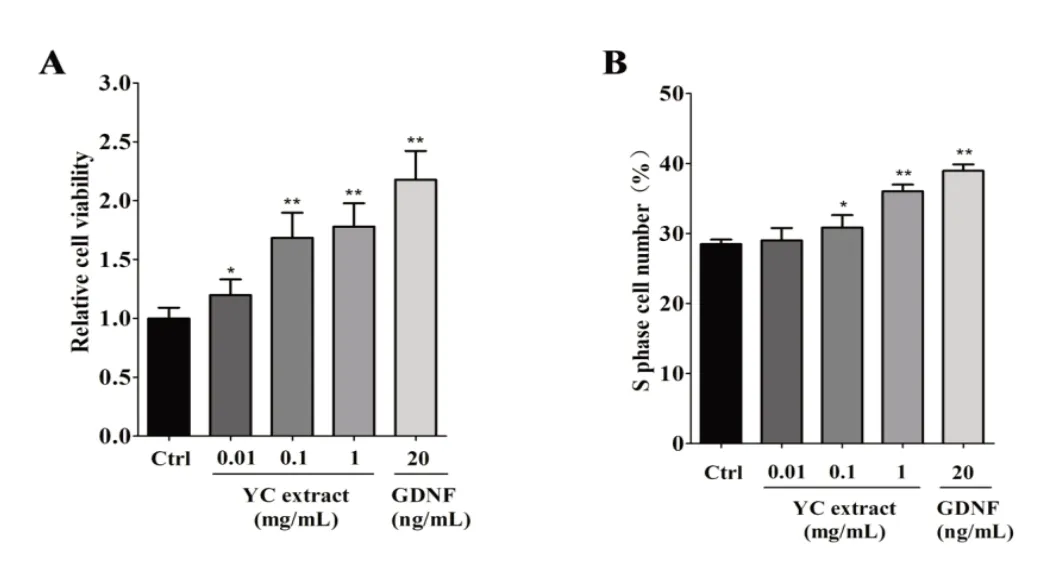
图1 养精胶囊对SSCs增殖活性、细胞周期的影响
2.2 养精胶囊对Cyclin D1 启动子、mRNA 和蛋白水平的影响图2A表明,高剂量(1 mg/mL)的养精胶囊和GDNF作用48 h后,Cyclin D1启动子的活性比阴性对照组分别增强103.7%、121.3%,有统计学差异(P<0.01),说明高剂量的养精胶囊和GDNF 均能增强Cyclin D1 启动子的活性。图2B 表明,高剂量的养精胶囊和GDNF 作用48 h后,Cyclin D1 mRNA 的表达比空白对照组分别提高85.5%、106.4%,有统计学差异(P<0.01),说明高剂量的养精胶囊和GDNF 均能提高Cyclin D1 mRNA 的表达。图2C 表明,高剂量的养精胶囊和GDNF 作用48 h 后,Cyclin D1 的蛋白表达提高,并且主要集中在细胞核内。

图2 养精胶囊对Cyclin D1 启动子、mRNA和蛋白水平的影响
2.3 阻断Cyclin D1后养精胶囊对SSCs的影响图3A 表明,加入siRNA-Cyclin D1 预处理后再加入高剂量的养精胶囊培养48 h,细胞的增殖活性比养精胶囊+siRNA-NC 组降低23.9%,有统计学差异(P<0.01),表明阻断Cyclin D1 能够抑制SSCs 的增殖。图3B 表明,养精胶囊+siRNA-Cyclin D1 组与养精胶囊+siRNA-NC 组相比,S 期细胞比例减少12.9%,有统计学差异(P<0.01),表明阻断Cyclin D1能够降低S期细胞比例。

图3 阻断Cyclin D1后养精胶囊对SSCs的影响
2.4 阻断Cyclin D1 后养精胶囊对Cyclin D1 的影响图4A 表明,加入siRNA-Cyclin D1 预处理后再加高剂量的养精胶囊培养48 h,Cyclin D1启动子的活性与养精胶囊+siRNA-NC 组相比降低18.6%,有统计学差异(P<0.01)。图4B 表明,养精胶囊+siRNA-Cyclin D1 组与养精胶囊+siRNA-NC 组相比,Cyclin D1 mRNA 的表达降低15.6%,有统计学差异(P<0.05)。图4C 表明,养精胶囊+siRNA-Cyclin D1 组与养精胶囊+siRNA-NC组相比,Cyclin D1的蛋白表达降低。
3 讨论
养精胶囊是东南大学附属中大医院金保方教授运用中医学“肾藏精”的理论,以补肾填精、益气活血为法创立的经验方,由淫羊藿、熟地、黄精、紫河车、沙苑子、煅牡蛎、黄芪、当归、荔枝核、王不留行、炙水蛭共11 味中药组成。方中淫羊藿味辛、甘,性温,走肝肾二经,为补命门、益精气之要药;熟地味甘,性微温,亦归肝肾二经,有补血养阴、填精益髓之功,九蒸九晒熟地为补血之首剂,与淫羊藿相伍,阴阳互根互用,增强疗效;紫河车乃血肉有情之品,扶正固本,养血益精;黄芪-黄精为补气养阴固精的常用药对,气阴双补,使得阳有所依;沙苑子、煅牡蛎其性下行,补肾固精,煅牡蛎还含有精子生长所必须的锌、硒等微量元素;荔枝核、当归、炙水蛭、王不留行共奏行气活血之功,使得药物补而不滞,滋而不腻。方中除了传统补肾填精之药,还添加了行气活血之药,既能补肾入精室,又能行气活血以养精生精。这种补肾填精与行气活血药物的配合,可改善睾丸和附属性腺的内环境,促进精子发生,提高临床疗效[8-11]。
Cyclin D是1991年由Motokura等[12]在研究甲状旁腺癌时首先分离,主要包括Cyclin D1、D2、D3 三个亚型,三者在氨基酸序列上有高度同源性。Ciraolo 等[4]研究发现,GDNF 通过激活BI3K中的p110α亚基引起下游Akt 的磷酸化,进而上调Cyclin D1 的表达,促进SSCs 的自我更新与增殖。本研究发现养精胶囊可以促进SSCs的增殖、提高S期细胞的比例(图1),并且增强Cyclin D1 启动子的活性,促进Cyclin D1 mRNA 和蛋白的表达(图2)。为了研究养精胶囊是否通过Cy⁃clin D1 产生作用,本研究运用siRNA-Cyclin D1 阻断Cyclin D1的表达,发现阻断Cyclin D1之后,SSCs的增殖活性降低、S 期细胞比例减少(图3),同时伴随着Cyclin D1启动子的活性降低,mRNA和蛋白的表达减少(图4)。

图4 阻断Cyclin D1后养精胶囊对Cyclin D1的影响
综上,养精胶囊可以通过增强Cyclin D1启动子的活性提高Cyclin D1 的转录和翻译水平,进而促进SS⁃Cs 增殖。这对于阐明补肾填精法改善男性生殖功能的作用靶点,揭示“肾藏精”的科学内涵,进而指导临床运用中药治疗少弱精症,具有重要的理论意义和临床价值。当然,基因的转录涉及启动子、转录因子、RNA 聚合酶等的协同作用,养精胶囊如何增强Cyclin D1启动子的活性的分子机制有待进一步探索。
