群体感应淬灭酶YtnP对草鱼肠道菌群结构的影响
2020-02-22赵祯肖翎戚建华刘韵怡王年郁小娟宋增福
赵祯 肖翎 戚建华 刘韵怡 王年 郁小娟 宋增福
摘要:【目的】揭示群體感应淬灭作用与宿主肠道菌群结构间的作用关系,为具有群体感应淬灭作用益生菌及其淬灭酶在水产养殖上的推广应用提供理论依据。【方法】选取30尾规格为25±1 g/尾的草鱼随机分为对照组和试验组,试验组每尾草鱼腹腔注射100 μL溶解稀释后的YtnP(25 μg/mL),对照组每尾草鱼腹腔注射等量的300 mmol/L分子筛缓冲液,分别在注射后24和48 h采集草鱼前肠、中肠和后肠的肠道组织及内容物,提取各肠段总DNA及PCR扩增16S rRNA序列V3~V4可变区,然后基于Illumina MiSeq高通量测序技术分析外源添加YtnP对草鱼肠道菌群多样性与丰度的影响。【结果】12份草鱼肠道样品测序共获得原始序列(Raw reads)660205条,有效序列(Valid reads)416614条;对照组和试验组样品的OTU数目分别为142±102和143±67个。在门分类水平上,对照组和试验组草鱼肠道优势菌群均为放线菌门(Actinobacteria)、梭杆菌门(Fusobacteria)、变形菌门(Proteobacteria)和厚壁菌门(Firmicutes);相对于对照组,试验组草鱼肠道中浮霉菌门(Planctomycetes)相对丰度显著增加(P<0.05,下同),放线菌门、梭杆菌门和变形菌门的相对丰度也呈升高趋势,但差异不显著(P>0.05,下同),厚壁菌门、TM7和拟杆菌门(Bacteroidetes)的相对丰度则呈下降趋势。在属分类水平上,对照组和试验组草鱼肠道均以鲸杆菌属(Cetobacterium)和诺卡氏菌属(Nocardia)为优势菌群;相对于对照组,试验组草鱼肠道中鲸杆菌属相对丰度呈升高趋势、诺卡氏菌属相对丰度呈下降趋势,但变化差异均不显著,未特指微杆菌属(Unspecified_Microbacteriaceae)相对丰度则显著增加。草鱼肠道菌群结构Alpha多样性分析发现,试验组样品的Chao1和ACE指数低于对照组样品,Shannon和Simpson指数略高于对照组样品,但差异均不显著;Beta多样性分析结果显示,对照组与试验组间的菌群特点存在差异,且组间区分效果明显。【结论】外源添加YtnP不会导致草鱼肠道优势菌群种类发生明显变化,但能在一定程度影响肠道菌群的相对丰度。
关键词: 草鱼;群体感应淬灭酶;YtnP;肠道菌群;微生态平衡
中图分类号: S965.112 文献标志码: A 文章编号:2095-1191(2020)11-2817-10
Effects of the quorum quenching enzyme YtnP on the intestinal microbiota structure of grass carp(Ctenopharyngodon idellus)
ZHAO Zhen1,2, XIAO Ling1,2, QI Jian-hua1,2, LIU Yun-yi1,2, WANG Nian1,2,
YU Xiao-juan1,2, SONG Zeng-fu1,2,3*
(1National Demonstration Center for Experimental Fisheries Science Education(Shanghai Ocean University), Shanghai,201306, China; 2Shanghai Collaborative Innovation for Aquatic Animal Genetics and Breeding(Shanghai Ocean University), Shanghai 201306, China; 3Key Laboratory of Exploration and Utilization of Aquatic Genetic Resources,Ministry of Education(Shanghai Ocean University), Shanghai 201306,China)
Abstract:【Objective】To reveal the relationship between quorum quenching and structure of host intestinal microbiota, and to provide a theoretical basis for the promotion and application of quorum quenching probiotics and their quen-ching enzymes in aquaculture. 【Method】Thirty grass carps weighing 25±1 g were randomly set up as control group and experimental group. The experimental group was injected with 100 μL YtnP(25 μg/mL) after dissolution and dilution per fish, while the control group was injected with the same amount of 300 mmol/L molecular sieve buffer per fish. The intestinal tissues and contents of fore intestine, mid intestine and hind intestine of grass carp were collected 24 and 48 h after intraperitoneal injection, respectively. Total DNA of each intestinal segment was extracted and the variable region V3-V4 of 16S rRNA sequence was amplified by PCR. The effects of exogenously added YtnP on the diversity and abundance of grass carp intestinal microbiota were analyzed based on Illumina MiSeq high-throughput sequencing. 【Result】A total of 660205 raw reads and 416614 valid reads were obtained from 12 intestinal samples by sequencing. The OTUs of the control and treatment samples were 142±102 and 143±67, respectively. The intestinal microbiota were dominated by Actinobacteria, Fusobacteria,Proteobacteria and Firmicutes at the level of phylum in two groups. Compared with the control group,the relative abundance of Planctomycetesin treatment group significantly increased(P<0.05, the same below), Actinobacteria, Fusobacteria,Proteobacteria and Firmicutes also increased, but the difference was not significant(P>0.05, the same below). The abundance of Firmicutes,TM7 and Bacteroidetes showed a decreasing trend. At the level of genus, Cetobacterium and Nocardia were the dominant microbiota in both groups. Compared with the control group, the relative abundance of Cetobacterium and Nocardia in the experimental group showed an increasing trend and a decreasing trend with no significant difference respectively, while abundance of Unspecified_Microbacteriaceae was significantly increased. The Alpha diversity index showed that, Chao1 index and ACE index in treatment group were lower than control group, Shannon index and Simpson index were higher than control group, but the difference was not significant. Beta diversity analysis showed that there were differences in the characteristics of the microbiota between the two groups, and the difference between the groups was obvious. 【Conclusion】The addition of a single exogenous quorum quenching enzyme YtnP has no obvious effect on the composition of the dominant intestinal microbiota in grass carp,but has effect on the relative abundance of intestinal microbiota.
Key words: Ctenopharyngodon idellus; quorum quenching enzyme; YtnP; intestinal microbiota; microecology equilibrium
Foundation item: Shanghai Collaborative Innovation Center Foundation(ZF1206); “321” Project for Entrepreneu-rial Talents in Nanjing(D-8005-14-0005)
0 引言
【研究意义】草鱼(Ctenopharyngodon idellus)是我国重要的淡水养殖鱼类,也是国内养殖量最大的鱼类,主要分布在长江、珠江和黑龙江三大水系(沈玉帮等,2011)。草鱼幼苗极易感染病原微生物而发病死亡,抗生素、消毒剂及其他化学药品常被用于治疗草鱼的细菌性感染(Cabello,2006;Sapkota et al.,2008;Ca?ada-Ca?ada et al.,2009;Nunes et al.,2018),但化学药物滥用导致的环境污染和药物残留最终会影响人类健康,且水产养殖领域抗生素的滥用及过量使用还会引起细菌耐药性问题(Rosa et al.,2018)。因此,亟待探索新的细菌性病害防治手段以促进草鱼养殖业持续健康发展。【前人研究进展】病原菌的致病作用与其群体感应(Quorum sensing,QS)调控系统密切相关(Dong et al.,2002;彭孟凡等,2018;童文涛等,2019)。其中,细菌是通过释放自诱导信号分子(Autoinducers,AIs)以调控致病相关基因的表达,从而影响其毒力、黏附和生物膜的形成等(Jiang and Su,2009)。不同种类的AIs介导不同QS系统,阻止AIs积累及其与受体的识别和结合,可有效抑制QS调控致病基因的表达。细菌存在多种QS系统,其所发挥细胞与细胞间通信作用的信号分子主要分为3种:革兰氏阴性细菌的N-酰基丝氨酸内酯(AHLs)、自体诱导分子2(AI-2)和革兰氏阳性细菌间自诱导肽(AIPs)(张炼辉,2019)。AHLs是介导革兰氏阴性菌QS系统中的信号分子,是目前研究较成熟的一类信号分子(Li et al.,2019)。酰基丝氨酸内酯酶能降解AHLs信号分子,阻断细菌QS信号通路,导致细菌致病性及毒力降低或丧失(Dong et al.,2007)。因此,可通过群体感应淬灭酶抑制或干扰细菌QS系统信号传导(Dong and Zhang,2005),进而阻断细菌间的信息交流,抑制毒力基因表达,降低细菌致病性(郭冰怡和董燕红,2018),减缓致病菌耐药突变体的出现,为解决临床上过度使用抗生素导致的耐药性问题提供新路径。微生物间通过群体感应淬灭作用建立细胞与细胞间的通信连接,并在微生物间的生态竞争及动态平衡中发挥重要作用(张炼辉,2019)。淬灭酶YtnP作为酰基丝氨酸内酯酶的成员之一,具有与锌指结合区域相似的保守序列HXHXDH和组氨酸残基,与AiiA同属于金属-β-内酰胺酶超家族(Barbe et al.,2009)。Schneider等(2012)通过克隆表达枯草芽孢杆菌YtnP基因而获得YtnP重组蛋白,并证实其能抑制铜绿假单胞菌生物膜的形成;此外,链霉素能诱导Ytnp基因上调表达,YtnP重组蛋白也能抑制灰色链霉菌中气生菌丝和链霉素的产生。Traxler和Kolter(2015)研究表明,微生物间通过QS能建立复杂的作用关系,且这种作用能进一步对细胞的分化及新陈代谢产生影响,进而在整个微生物群落生态系统中发挥重要的生态功能作用。【本研究切入点】肠道微生物参与机体的食物消化、抵抗病原体和免疫系统发育等过程,在维护宿主的营养代谢、微生态平衡与稳定及机体健康等方面发挥重要作用(Flint et al.,2012;Thaiss et al.,2016;張燕玉等,2019)。本课题组前期从具有群体感应淬灭作用的地衣芽孢杆菌(Bacillus licheniformis)T-1株(宋增福等,2015;童文涛等,2019)中提取获得具有高效群体感应淬灭作用的YtnP,且证明其对嗜水气单胞菌具有显著的抗感染能力(Chen et al.,2020),但在抗细菌感染的同时是否对宿主肠道菌群微生态平衡产生影响仍有待进一步探究。【拟解决的关键问题】从微生态菌群平衡与稳定的角度出发,借助高通量测序技术对草鱼肠道微生物群落进行16S rRNA测序分析,解析在YtnP作用下肠道菌群多样性与丰度的变化规律,进一步揭示群体感应淬灭作用与宿主肠道菌群结构间的作用关系,为具有群体感应淬灭作用益生菌及其淬灭酶在水产养殖上的推广应用提供理论依据。
1 材料与方法
1. 1 试验材料
试验草鱼由上海市浦东新区上海海洋大学滨海科教基地提供,其规格为25±1 g/尾。试验前暂养于国家水生动物病原库循环养殖系统中,按照体重的1%进行投饵,分别于上午8:00和下午16:00定时投喂,养殖水温控制在(25±2)℃,pH 7.5±0.5。YtnP来源于地衣芽孢杆菌T-1株,经原核表达复性纯化得到YtnP融合蛋白,其浓度为150 μg/mL,使用前以300 mmol/L分子筛缓冲液[20 mmol/L Tris-HCl(pH 8.0),50 mmol/L NaCl,超纯水定容至1 L]稀释至25 μg/mL。
1. 2 试验设计
将暂养草鱼分为对照组和试验组,每组15尾,每组设3个平行。试验组草鱼每尾注射100 μL溶解稀释后的YtnP(25 μg/mL),对照组草鱼每尾注射等量的300 mmol/L分子筛缓冲液。注射前所有试剂均以0.22 μm的一次性针头滤器(Millipore)进行过滤,具体操作步骤参考彭孟凡(2018)的方法,先对草鱼进行麻醉,然后进行腹腔注射。
1. 3 肠道样品采集
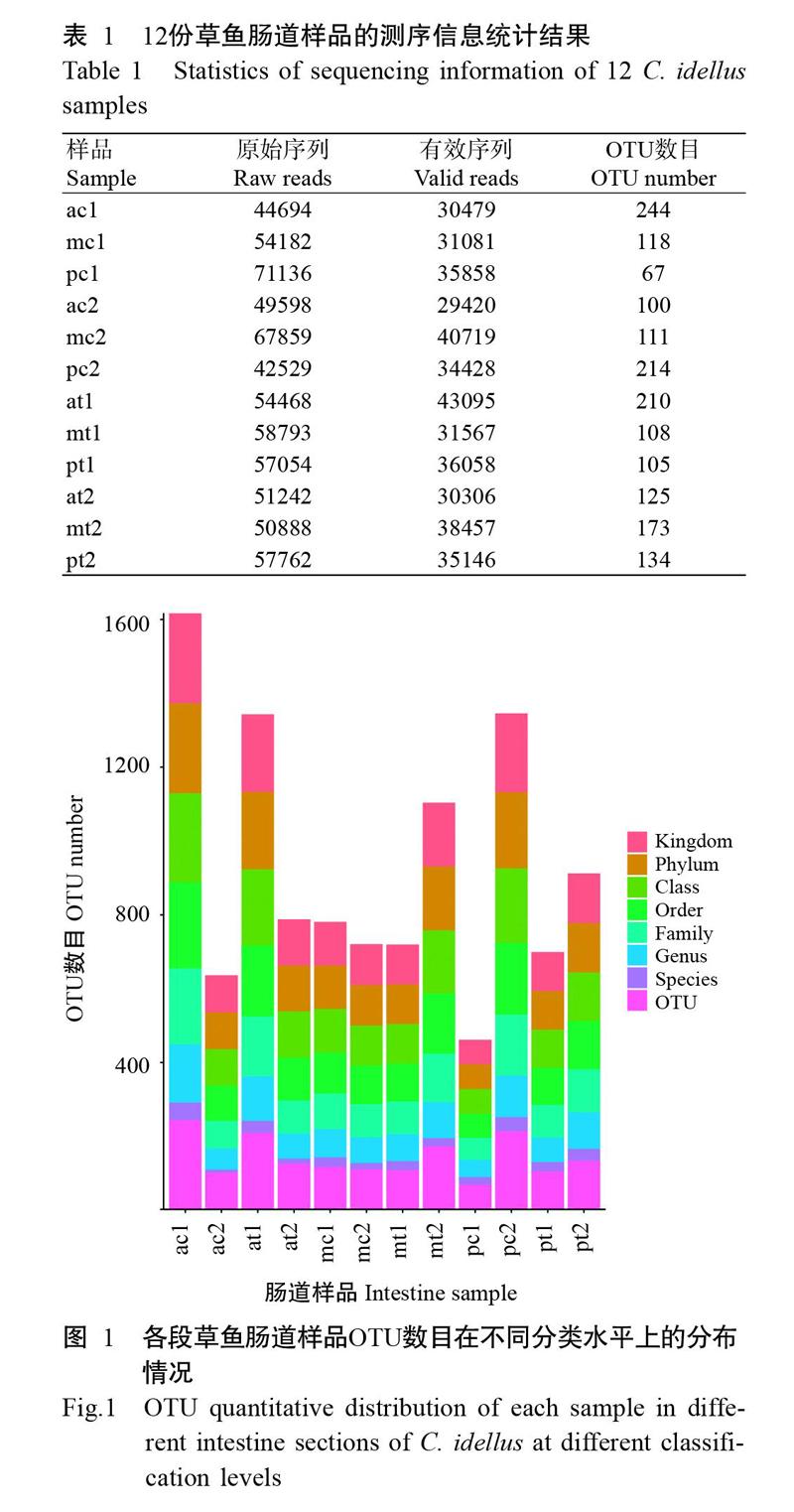
分别在腹腔注射后24和48 h采集草鱼肠道样品。首先使用75%酒精对草鱼体表进行消毒,再以无菌PBS冲洗3次,在无菌条件下采集其前肠、中肠和后肠的肠道组织及内容物,研磨匀浆后迅速放入液氮速冻,并转移至-80 ℃冰箱保存备用。每组解剖6尾草鱼。对照组注射后24和48 h采集的样品分别标记为ac1、mc1、pc1、ac2、mc2和pc2;试验组注射后24和48 h采集的样品分别标记为at1、mt1、pt1、at2、mt2和pt2。
1. 4 肠道菌群分析方法及步骤
草鱼肠道菌群高通量测序分析委托深圳微生太科技有限公司完成,具体操作步骤如下:
1. 4. 1 样品基因组DNA提取及PCR扩增 使用宏基因组DNA提取试剂盒提取总DNA。PCR扩增采用TransGen AP221-02,反应体系20.0 ?L:5×Fast Pfu Buffer 4.0 ?L,2.5 mmol/L dNTPs 2.0 ?L,上、下游引物(5 ?mol/L)各0.8 ?L,Fast Pfu聚合酶0.4 ?L,BSA 0.2 ?L,DNA模板10.0 ng,ddH2O补足至20.0 ?L。扩增程序:95 ℃预变性3 min;95 ℃ 30 s,退火30 s,72 ℃ 45 s,进行30个循环;72 ℃延伸10 min,10 ℃结束反应。以细菌16S rRNA序列V3~V4可变区为靶标,采用带有Barcode序列的338F/806R为引物进行PCR扩增。
1. 4. 2 上机测序与数据统计 PCR产物经定量分析及文库构建后,利用Illumina MiSeq PE300平台进行高通量测序,获取细菌16S rRNA序列V3~V4可变区的碱基序列信息,为保证OTU聚类及后续分析的准确性,所有样品的全部原始序列信息(Input)均进行质量控制(Filtered)、去噪(Denoised)和拼接(Merged),并去除嵌合体(Non-chimeric)形成OTU,处理后的数据进行过滤即得到有效数据。
1. 4. 3 数据分析 对测序片段进行OTU聚类,OTU代表序列与SILVA数据库进行比对分析,获取OTU对应的分类单元(界,门,纲,目,科,属,种)及其相应的丰度信息。计算Chao1、ACE、Shannon和Simpson等Alpha多样性指数,评估样品中细菌菌群结构的丰富度和均匀度;综合应用主成分分析(PCA)、偏最小二乘法判别分析(PLS-DA)和AUC(Area under curve)计算等寻找样品间及组别间肠道菌群结构的差异性和相似性。
2 结果与分析
2. 1 草鱼肠道微生物多样性
12份草鱼肠道样品测序共获得原始序列(Raw reads)660205条,有效序列(Valid reads)416614条;对照组和试验组样品的OTU数目分别为142±102和143±67个。每样品的原始序列、有效序列及OTU数目详见表1。对照组样品中OTU数目最高的是ac1(244个)、最低的是pc1(67个);试验组样品中OTU数目最高的是at1(210个)、最低的是pt1(105个)。各样品在界、门、纲、目、科、属及种分类水平上的OTU数目分布情况如图1所示。
2. 2 草鱼肠道菌群结构及其相对丰度
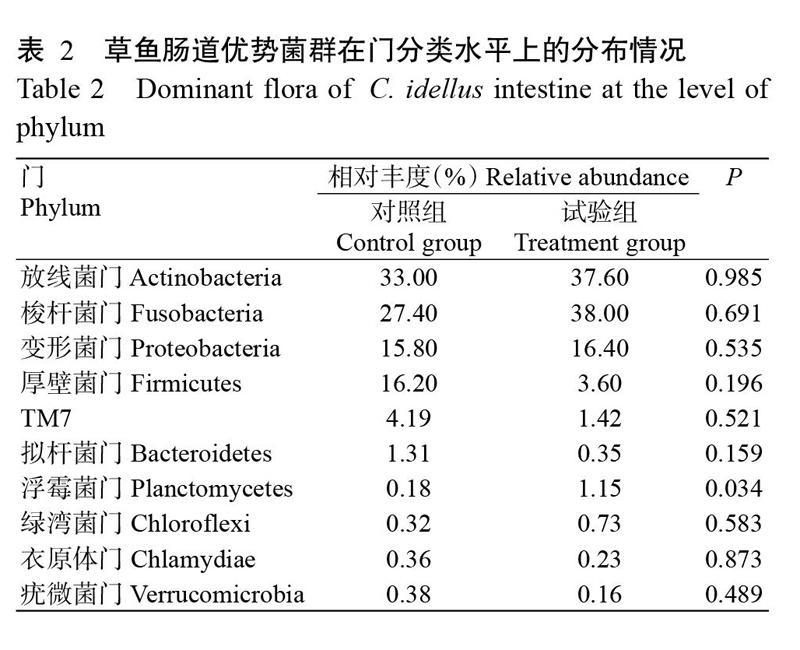
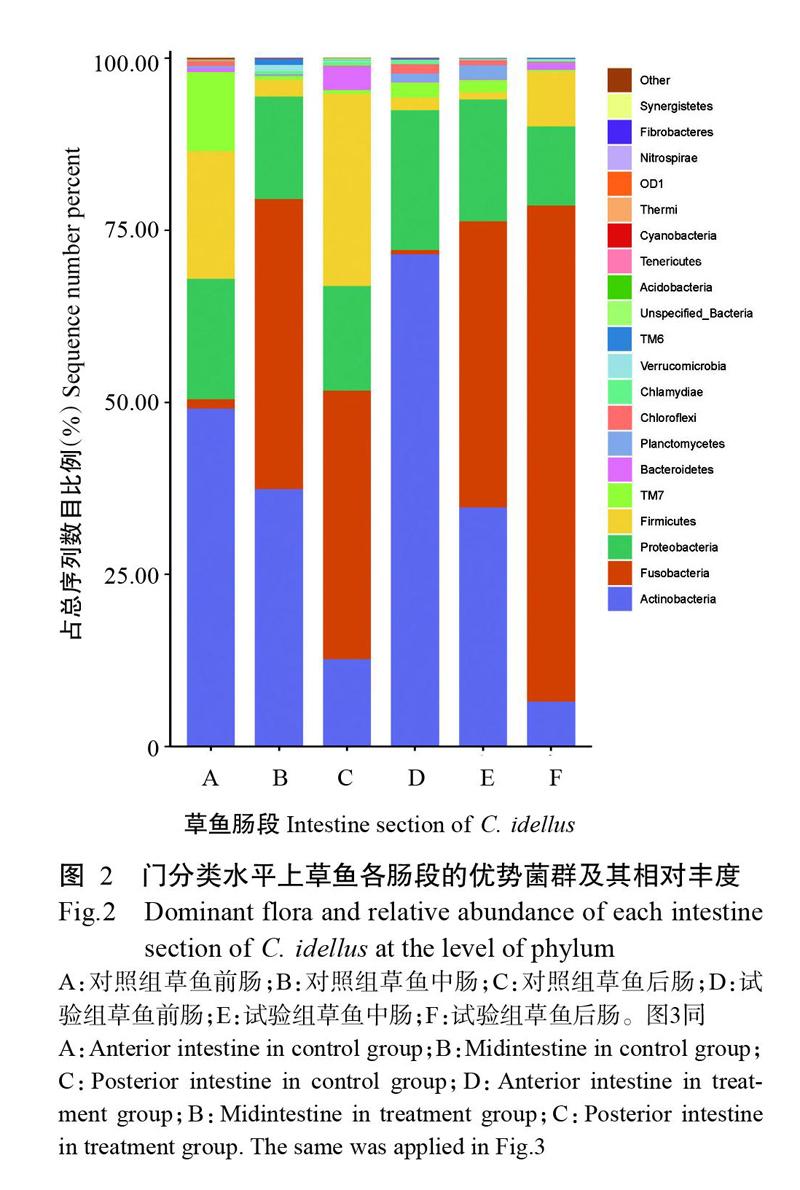
选取在门分类水平上相对丰度排名前10的菌群进行统计分析,结果(表2)显示,对照组样品中的优势细菌门类分别是放线菌门(Actinobacteria)、梭杆菌门(Fusobacteria)、厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、TM7和拟杆菌门(Bacteroidetes),其他门类占总序列数目比例均不足1.00%;试验组样品中的优势细菌门类分别是放线菌门、梭杆菌门、变形菌门、厚壁菌门、TM7和浮霉菌门(Planctomycetes),其他门类占总序列数目的比例均不足1.00%。相对于对照组,试验组草鱼肠道中浮霉菌门相对丰度显著增加(P<0.05,下同),放线菌门、梭杆菌门、变形菌门和绿湾菌门(Chloroflexi)的相對丰度也呈升高趋势,但差异不显著(P>0.05,下同),厚壁菌门、TM7、拟杆菌门、衣原体门(Chlamydiae)和疣微菌门(Verrucomicrobia)的相对丰度则呈下降趋势。不同肠段样品菌群结构的相对丰度在门分类水平上也存在一定差异,主要表现为:草鱼前肠和中肠的放线菌门相对丰度较高,而后肠相对较低;草鱼中肠和后肠的梭杆菌门相对丰度较高,而前肠相对较低;对照组草鱼前肠和后肠的厚壁菌门相对丰度较高,但试验组草鱼各肠段的厚壁菌门相对丰度均较低(图2)。
选取在属分类水平上相对丰度排名前10的菌群进行统计分析,结果(表3)表明,对照组样品中的优势细菌属类分别是鲸杆菌属(Cetobacterium)、诺卡氏菌属(Nocardia)、未特指消化链球菌属 (Unspecified_Peptostreptococcaceae)、劳森菌属(Lawsonia)、红杆菌属(Rhodobacter)、Unspecified_TM7_3和未特指根瘤菌属(Unspecified_Rhizobiales),其他属类占总序列数目比例均不足1.00%。试验组样品中的优势细菌属类分别是鲸杆菌属、诺卡氏菌属、分枝杆菌属(Mycobacterium)、未特指根瘤菌属、未特指微杆菌属(Unspecified_Microbacteriaceae)、红杆菌属和红球菌属(Rhodococcus),其他属类占总序列数目比例均不足1.00%。相对于对照组,试验组草鱼肠道中鲸杆菌属、未特指根瘤菌属、分枝杆菌属、未特指微杆菌属和红球菌属的相对丰度均呈升高趋势,其中未特指微杆菌属相对丰度显著增加;诺卡氏菌属、未特指消化链球菌属、红杆菌属、劳森菌属和Unspecified_TM7_3的相对丰度则呈下降趋势,差异均不显著。不同肠段样品菌群结构的相对丰度在属分类水平上也存在差异,主要表现为:草鱼中肠和后肠的鲸杆菌属相对丰度较高,而前肠相对较低;草鱼前肠和中肠的诺卡氏菌属相对丰度较高,而后肠相对较低;对照组草鱼前肠和后肠的未特指消化链球菌属相对丰度较高,但试验组草鱼各肠段的未特指消化链球菌属相对丰度均较低(图3)。
为进一步探究不同样品间的差异性和相似性,选取属分类水平的物种(取相对丰度排名前20的物种)进行样品聚类分析并绘制相应的热图。由图4可看出,与对照组样品相比,试验组样品中的未特指消化链球菌属相对丰度呈下降趋势,而未特指根瘤菌属、分支杆菌属、未特指微杆菌属和Kaistia属相对丰度呈上升趋势。
2. 3 草鱼肠道菌群结构Alpha多样性分析结果
Alpha多样性通常用于度量群落生态系统中物种的丰富度,是反映物种丰富度和均匀度的综合指标(洪嘉炜等,2019)。其中,Chao1和ACE指数用于评估样品菌群中所含的OTU数目;Shannon指数用于评估样品中物种组成的丰富度和均匀度,数值越大表示物种越丰富、分配越均匀;Simpson指数用于估算样品中微生物的多样性,指数值越大说明其群落多样性越低(冯士彬等,2019)。由图5可看出,试验组样品的Chao1和ACE指数低于对照组样品,Shannon和Simpson指数略高于对照组样品,但差异均不显著。Alpha多样性稀释曲线是以OTU数目为纵坐标、测序数量为横坐标,用于表征样品测序结果是否合理,同时能间接反映样品中的物种丰度。由图6可看出,当测序数量>20000时,Alpha多样性稀释曲线趋于平缓,表明测序结果已足够反映当前样本所含的物种多样性。
2. 4 草鱼肠道菌群结构Beta多样性分析结果
PCA分析主要是探究不同处理条件下各样品可能表现出分散和聚集的分布情况,可反映出样品间的关系及个体或群体间的差异。本研究的PCA分析结果(图7-A)显示,对照组个别样品点相距较远,说明这些样品间的菌群结构差异较明显;试验组各样品点聚集相对紧密,说明各样品间的菌群结构差异较小,且与对照组样品间也存在一定差异。PLS-DA分析是忽略组内的随机差异,而重点突出组间的系统差异,且能选择性忽略分组间无差异的物种。PLS-DA分析发现试验组草鱼肠道菌群与对照组草鱼肠道菌群间存在系统差异(图7-B)。AUC被定义为ROC曲线下与坐标轴围成的面积。AUC越接近于1,说明分组间的区分效果越好,即有多个微生物在分组间的丰度存在差异。由图7-C可看出,Control∶Treatment=1,表明对照组与试验组的草鱼肠道菌群区分效果明显。
3 讨论
肠道微生物种类繁多、数目巨大,通过与宿主共同进化而长期生存,且与宿主间形成相对稳定的互利互惠共生关系(Ley et al.,2008)。在鱼类肠道微生态系统中,变形菌门、梭杆菌门、拟杆菌门和厚壁菌门等构成了肠道优势菌群(Li et al.,2014);在宿主的生长发育过程中,常因饲料、药物和外界环境等因素的介入而影响其肠道菌群组成(Parshukov et al.,2019),致使肠道菌群结构处于动态变化之中。本研究结果表明,外源添加YtnP对草鱼肠道菌群在不同分类水平上均有一定影响。在门分类水平上,外源添加YtnP后,草鱼肠道菌群结构组成未发生显著变化,变形菌门、梭杆菌门和放线菌门仍为优势菌群,但其相对丰度呈升高趋势。李胜利(2016)研究发现,添加YtnP后绵羊瘤胃中的放线菌门相对丰度呈升高趋势,且显著增加互养菌门(Synergistetes)和降低软壁菌门(Tenericutes)的相對丰度,表明YtnP对鱼类及哺乳动物的肠道菌群结构均具有一定调节作用;但与Zhou等(2016)采用具有产群体感应淬灭酶能力的枯草芽孢杆菌QSI-1饲喂金鱼的试验结果存在差异,究其原因可能是群体感应淬灭酶较具有产生群体感应淬灭作用的益生菌,对机体肠道菌群的调节作用更直接且迅速。
本研究在分析门分类水平的基础上,进一步比较属分类水平上草鱼肠道菌群相对丰度的变化情况。结果显示,鲸杆菌属和诺卡氏菌属是草鱼肠道的主要优势菌群,同时存在未特指消化链球菌属、劳森菌属、未特指TM7-3、红球菌属及未特指微杆菌属等优势菌属。鲸杆菌属具有高效的产维生素B12及代谢碳水化合物发酵产生乙酸、乳酸和琥珀酸等能力(Parshukov et al.,2019);微杆菌属可产生多种抗菌成分,抑制多种病原菌生长(刘凌燕等,2018);红球菌属能有效利用源自有机化合物的能源和碳源,降解石油烃、腈化物和霉菌毒素,并产特殊的类胡萝卜素(邱孜博等,2016)。外源添加YtnP后,草鱼肠道微杆菌属、鲸杆菌属和红球菌属的相对丰度均呈增加趋势,表明YtnP能调节宿主肠道菌群,且呈现出有利于维护草鱼肠道营养代谢和增强抗病力的作用。此外,能引起慢性疾病的分枝杆菌属也呈上升趋势,但具体原因有待进一步探究。虽然外源添加YtnP对草鱼肠道优势菌群并未产生显著影响,但是否对机体的抗病力和营养代谢产生影响,还需从更长时间维度及设不同给药浓度等因素进一步研究YtnP对肠道微生态系统平衡的影响。
群体感应淬灭机制是通过降解信号分子、产生信号分子结构类似物及阻断信号分子与受体结合等途径来实现(Roy et al.,2011)。YtnP作为外源添加的单一酰基丝氨酸内酯酶能改变草鱼肠道菌群相对丰度,其实现途径可能是:(1)基于AHLs信号分子为靶向的淬灭途径导致肠道菌群丰度改变。已有研究发现,机体肠道菌群浮霉菌门中的厌氧氨氧化菌(Anammox bacteria)存在AHLs介导的群体感应系统(de Cloppeleir et al.,2011;Zhao et al.,2016);也有研究证实革兰氏阳性菌MPO(GenBank登录号JF915892,厚壁菌门成员)具有产AHLs能力(Biswa and Doble,2013),但AHLs是否由多数厚壁菌门成员产生尚无报道。YtnP对肠道菌群结构的影响可能是通过对AHLs的淬灭作用导致群体感应系统调控的生理机能发生改变,减少或增加细菌生理代谢产物,造成群落中的细菌生态竞争能力差异化,最终导致草鱼肠道菌群的结构和比例发生改变。因此,对于浮霉菌门相对丰度显著上升现象,可能是由于群体感应淬灭作用解除了AHLs的抑制作用,从而导致其相对丰度显著升高。(2)与革兰氏阳性菌和革兰氏阴性菌间存在种间信号分子AI-2途径有关。AI-2是细菌种间的交流信号分子(Li et al.,2019)。Thompson等(2015)发现,肠道菌群经链霉素处理后厚壁菌门的相对丰度显著降低,而添加产生群体感应信号分子AI-2的大肠杆菌后,肠道厚壁菌门相对丰度有所回升。本研究结果表明,外源添加YtnP与添加链霉素具有同样的作用,能降低草鱼肠道厚壁菌门相对丰度。因此,推测种间信号分子AI-2与YtnP对厚壁菌门细菌的调节作用存在相关性,可为揭示肠道菌群间复杂的生态关系提供新思路。
4 结论
外源添加YtnP不会导致草鱼肠道优势菌群种类发生明显变化,但能在一定程度影响肠道菌群的相对丰度。
参考文献:
冯士彬,程连平,舒迎霜,董妍丽,张咪,李玉,王希春,吴金节. 2019. 黄芪多糖对湖羊羔羊生长性能、血清指标、消化功能和直肠菌群的影响[J]. 江苏农业学报,35(1):122-129. [Feng S B,Cheng L P,Shu Y S,Dong Y L,Zhang M,Li Y,Wang X C,Wu J J. 2019. Effect of astragalus polysaccharide on growth performance,serum indices,digestive function and rectum flora of Hu lambs[J]. Jiangsu Journal of Agricultural Sciences,35(1):122-129.]
郭冰怡,董燕红. 2018. 细菌群体感应抑制剂研究进展[J]. 农药学学报,20(4):408-424. [Guo B Y,Dong Y H. 2018. Research progress on inhibitors toward quorum sensing system[J]. Chinese Journal of Pesticide Science,20(4):408-424.]
洪嘉炜,陈明强,邓正华,李有宁,马振华,顾志峰,王雨. 2019. 恩诺沙星对马氏珠母贝肠道微生物群落的影响[J]. 南方农业学报,50(5):1104-1110. [Hong J W,Chen M Q,Deng Z H,Li Y N,Ma Z H,Gu Z F,Wang Y. 2019. Effects of enrofloxacin on intestinal microbial community of Pinctada fucata martensii[J]. Journal of Sou-thern Agriculture,50(5):1104-1110.]
李胜利. 2016. 淬灭酶及沙蒿多糖对绵羊瘤胃微生态和营养代谢及免疫影响研究[D]. 呼和浩特:内蒙古农业大学. [Li S L. 2016. The effects of AHL-lactonase and Artemisia seed polysaccharide on rumen microflora and nutient metabolism and immune effect in sheep[D]. Hohhot:Inner Mongolia Agricultural University.]
刘凌燕,陈志宇,曾还雄,林培彬,金小宝. 2018. 美洲大蠊肠道内生微杆菌的分离鉴定及其抑菌活性研究[J]. 生物技术通报,34(6):172-177. [Liu L Y,Chen Z Y,Zeng H X,Lin P B,Jin X B. 2018. Isolation and identification of endophytic microbacilli in the gut of Periplaneta americana and their antibacterial activity[J]. Biotechnology Bu-lletin,34(6):172-177.]
彭孟凡. 2018. 地衣芽孢桿菌T-1群体感应淬灭基因ytnP的克隆表达及其功能研究[D]. 上海:上海海洋大学. [Peng M F. 2018. Gene cloning,expression and function of quorum quenching gene ytnP from Bacillus licheniformis T-1[D]. Shanghai:Shanghai Ocean University.]
彭孟凡,范斌,张庆华,宋增福. 2018. 具群体感应抑制作用短小芽孢杆菌F3-1菌株的诱变育种[J]. 南方农业学报,49(7):1423-1431. [Peng M F,Fan B,Zhang Q H,Song Z F. 2018. Mutation breeding of Bacillus pumilus strain F3-1 with quorum sensing inhibitory effects[J]. Journal of Sou-thern Agriculture,49(7):1423-1431.]
邱孜博,汪荣,张杨,吴茜,谢笔钧,杨季芳,陈吉刚,孙智达. 2016. 红球菌及其生物降解作用研究进展[J]. 食品科学,37(7):254-258. [Qiu Z B,Wang R,Zhang Y,Wu Q,Xie B J,Yang J F,Chen J G,Sun Z D. 2016. Recent progress in studies of Rhodococcus and its application of in biodegradation[J]. Food Science,37(7):254-258.]
沈玉帮,张俊彬,李家乐. 2011. 草鱼种质资源研究进展[J]. 中国农学通报,27(7):369-373. [Shen Y B,Zhang J B,Li J L. 2011. Advances in studies on genetic resources of grass carp[J]. Chinese Agricultural Science Bulletin,27(7):369-373.]
宋增福,陈彪,郭婧,徐华东,任建峰,张庆华,董迎辉. 2015. 具有群体感应抑制作用的地衣芽孢杆菌T-1的动物安全及生态评价[J]. 水产学报,39(9):1395-1404. [Song Z F,Chen B,Guo J,Xu H D,Ren J F,Zhang Q H,Dong Y H. 2015. Animal safety and ecological evaluation of Bacillus licheniformis T-1 with quorum sensing inhibitory effect[J]. Journal of Fisheries of China,39(9):1395-1404.]
童文濤,陈彪,彭孟凡,赵祯,肖翎,宋增福,张庆华. 2019. 具群体感应淬灭作用地衣芽孢杆菌T-1株培养基及发酵条件的优化[J]. 南方农业学报,50(11):2559-2566. [Tong W T,Chen B,Peng M F,Zhao Z,Xiao L,Song Z F,Zhang Q H. 2019. Optimization of culture media and fermentation conditions of quorum sensing quenching bacteria Bacillus licheniformis T-1[J]. Journal of Southern Agriculture,50(11):2559-2566.]
张炼辉. 2019. 微生物群体感应系统的研究进展[J]. 华南农业大学学报,40(5):50-58. [Zhang L H. 2019. Research progress of microbial quorum sensing systems[J]. Journal of South China Agricultural University,40(5):50-58.]
张燕玉,韩卓然,孙敬锋,吕爱军,胡秀彩,刘军锋. 2019. 海藻希瓦氏菌感染对半滑舌鳎肠道菌群结构及相关功能基因表达的影响[J]. 南方农业学报,50(10):2300-2307. [Zhang Y Y,Han Z R,Sun J F,Lü A J,Hu X C,Liu J F. 2019. Effects of infection with Shewanella algae on the microbial communities and expression of related functional genes in the intestine of Cynoglossus semilaevis[J]. Journal of Southern Agriculture,50(10):2300-2307.]
Barbe V,Cruveiller S,Kunst F,Lenoble P,Meurice G,Sekowska A,Vallenet D,Wang T Z,Moszer I,Médigue C,Danchin A. 2009. From a consortium sequence to a unified sequence:The Bacillus subtilis 168 reference genome a decade later[J]. Microbiology(Reading),155(6):1758-1775.
Biswa P,Doble M. 2013. Production of acylated homoserine lactone by gram-positive bacteria isolated from marine water[J]. FEMS Microbiology Letters,343(1):34-41.
Cabello F C. 2006. Heavy use of prophylactic antibiotics in aquaculture:A growing problem for human and animal health and for the environment[J]. Environmental Microbiology,8(7):1137-1144.
Ca?ada-Ca?ada F,Mu?oz de la Pe?a A,Espinosa-Mansilla A. 2009. Analysis of antibiotics in fish samples[J]. Analytical and Bioanalytical Chemistry,395(4):987-1008.
Chen B,Peng M F,Tong W T,Zhang Q H,Song Z F. 2020. The quorum quenching bacterium Bacillus licheniformis T-1 protects zebrafish against Aeromonas hydrophila infection[J]. Probiotics and Antimicrobial Proteins,12(1):160-171.
de Cloppeleir H,Defoirdt T,Vanhaecke L,Vlaeminck S E,Carballa M,Verstraete W,Boon N. 2011. Long-chain acyl-homoserine lactones increase the anoxic ammonium oxidation rate in an OLAND biofilm[J]. Applied Microbio-logy and Biotechnology,90(4):1511-1519.
Dong Y H,Gusti A R,Zhang Q,Xu J L,Zhang L H. 2002. Identification of quorum-quenching N-Acyl homoserine lactonases from Bacillus species[J]. Applied and Environmental Microbiology,68(4):1754-1759.
Dong Y H,Wang L Y,Zhang L H. 2007. Quorum-quenching microbial infections: Mechanisms and implications[J]. Phi-losophical Transactions of the Royal Society of London,362(1483):1201-1211.
Dong Y H,Zhang L H. 2005. Quorum sensing and quorum-quenching enzymes[J]. Journal of Microbiology,43:101-109.
Flint H J,Scott K P,Louis P,Duncan S H. 2012. The role of the gut microbiota in nutrition and health[J]. Nature Reviews. Gastroenterology & Hepatology,9(10):577-589.
Jiang G L,Su M X. 2009. RETRACTED ARTICLE:Quorum-sensing of bacteria and its application[J]. Journal of Ocean University of China,8(4):385-391.
Ley R E,Lozupone C A,Hamady M,Knight R,Gordon J I. 2008. Worlds within worlds:Evolution of the vertebrate gut microbiota[J]. Nature Reviews. Microbiology,6(10):776-788.
Li H,Zhong Q P,Wirth S,Wang W W,Hao Y T,Wu S G,Zou H,Li W X,Wang G T. 2014. Diversity of autochthonous bacterial communities in the intestinal mucosa of grass carp(Ctenopharyngodon idellus)(Valenciennes) determined by culture-dependent and culture-in-dependent techniques[J]. Aquaculture Research,46(10):2344-2359.
Li Q,Peng W,Wu J,Wang X F,Ren Y X,Li H,Peng Y,Tang X W,Fu X S. 2019. Autoinducer-2 of gut microbiota,a potential novel marker for human colorectal cancer,is associated with the activation of TNFSF9 signaling in macrophages[J]. Oncoimmunology,8(10):e1626192.
Nunes K S D,Vallim J H,Assalin M R,Queiroz S C N,Paraiba L C,Jonsson C M,Reyes F G R. 2018. Depletion study,withdrawal period calculation and bioaccumulation of sulfamethazine in tilapia(Oreochromis niloticus) trea-ted with medicated feed[J]. Chemosphere,197:89-95.
Parshukov A N,Kashinskaya E N,Simonov E P,Hlunov O V,Izvekova G I,Andree K B,Solovyev M M. 2019. Variations of the intestinal gut microbiota of farmed rainbow trout,Oncorhynchus mykiss(Walbaum),depending on the infection status of the fish[J]. Journal of Applied Microbiology,127(2):379-395.
Rosa J,Leston S, Castro M,Freitas A,Barbosa J,Pardal M ?,Rema P,Dias J,Ramos F. 2018. Evaluation of antimicrobials residues in farmed gilthead seabream(Sparus aurata) after administration through medicated feed[J]. Food Control,86:110-116.
Roy V,Adams B L,Bentley W E. 2011. Developing next gene-ration antimicrobials by intercepting AI-2 mediated quorum sensing[J]. Enzyme and Microbial Technology,49(2):113-123.
Sapkota A,Sapkota A R,Kucharski M,Burke J,McKenzie S,Walker P,Lawrence R. 2008. Aquaculture practices and potential human health risks:Current knowledge and future priorities[J]. Environment International,34(8):1215-1226.
Schneider J,Yepes A,Garcia-Betancur J C,Westedt I,Mielich B,López D. 2012. Streptomycin-induced expression in Bacillus subtilis of YtnP,a lactonase-homologous protein that inhibits development and streptomycin production in Streptomyces griseus[J]. Applied and Environmental Microbiology,78(2):599-603.
Thaiss C A,Zmora N,Levy M,Elinav E. 2016. The micro-biome and innate immunity[J]. Nature,535(7610):65-74.
Thompson J A,Oliveira R A,Djukovic A,Ubeda C,Xavier K B. 2015. Manipulation of the quorum sensing signal AI-2 affects the antibiotic-treated gut microbiota[J]. Cell Reports,10(11):1861-1871.
Traxler M F,Kolter R. 2015. Natural products in soil microbe interactions and evolution[J]. Natural Product Reports,32(7):956-970.
Zhao R,Zhang H M,Zou X,Yang F L. 2016. Effects of inhi-biting acylated homoserine lactones(AHLs) on anammox activity and stability of granules[J]. Current Microbio-logy,73(1):108-114.
Zhou S X,Zhang A,Yin H P,Chu W H. 2016. Bacillus sp. QSI-1 modulate quorum sensing signals reduce Aeromo-nas hydrophila level and alter gut microbial community structure in fish[J]. Frontiers in Cellular and Infection Microbiology,6:184. doi:10.3389/fcimb.2016.00184.
(責任编辑 兰宗宝)
收稿日期:2020-02-29
基金项目:上海市协同创新中心基金项目(ZF1206);南京创业人才“321”计划项目(D-8005-14-0005)
作者简介:*为通讯作者,宋增福(1971-),博士,副教授,主要从事水产病害防控技术研究工作,E-mail:zfsong@shou.edu.cn。赵祯(1996-),研究方向为水生动物微生态学,E-mail:251070057@qq.com
