聚乙二醇介导咖啡炭疽菌遗传转化体系的建立
2020-02-22陆英贺春萍吴伟怀梁艳琼黄兴郑金龙李锐易克贤
陆英 贺春萍 吴伟怀 梁艳琼 黄兴 郑金龙 李锐 易克贤
摘 要:【目的】建立高效制備咖啡炭疽菌原生质体及聚乙二醇(PEG)介导的遗传转化体系的方法,为开展咖啡炭疽菌的致病分子机理研究打下基础。【方法】以咖啡炭疽菌野生型菌株BSC2-2为试验材料,通过PEG介导原生质体转化法将含有氯嘧磺隆标记和绿色荧光蛋白报告基因(GFP)的质粒pCB1532-G转入BSC2-2原生质体中,对获得的转化子进行遗传稳定检测、PCR分子检测和激光共聚焦显微观察。【结果】BSC2-2对氯嘧磺隆的耐受浓度为200.0 mg/L。最佳遗传转化体系为:28 ℃下用2.5%裂解酶酶解BSC2-2菌丝2 h,收集原生质体,再经MTC缓冲液冲洗重悬后将质粒pCB1532-G转入原生质体,在RM培养基中混匀再生,获得转化子。GFP基因的PCR扩增和分生孢子荧光观察结果表明,GFP基因已成功插入并整合到咖啡炭疽菌BSC2-2基因组中。转化子与野生型菌株在菌落形态、生长速率及致病力上无明显差别,表明GFP基因在咖啡炭疽菌BSC2-2基因组中稳定遗传。【结论】成功建立了PEG介导的咖啡炭疽菌遗传转化体系,获得与野生型菌株在菌落形态、生长速率及致病性上无明显差别的转化子,为后续研究咖啡炭疽菌的基因功能和致病机理提供技术支持。
关键词: 咖啡炭疽菌;PEG介导遗传转化;转化子鉴定; 生长;致病性
中图分类号: S435.712 文献标志码: A 文章编号:2095-1191(2020)11-2706-07
Establishment of genetic transformation system of coffee Collectotrichum using polyethylene glycol-mediated method
LU Ying, HE Chun-ping, WU Wei-huai, LIANG Yan-qiong, HUANG Xing,
ZHENG Jin-long, LI Rui, YI Ke-xian*
(Environment and Plant Protection Institute, Chinese Academy of Tropical Agricultural Sciences/Key Laboratory for Monitoring and Control of Tropical Agricultural and Forest Invasive Alien Pests, Ministry of Agriculture and Rural
Affairs/Hainan Key Laboratory for Detection and Control of Tropical Agricultural Pests, Haikou 571101, China)
Abstract:【Objective】To establish the polyethylene glycol(PEG)-mediated transformation technology system of co-ffee Collectotrichum. This results have established foundation for the study of molecular mechanism of pathogenic molecules of coffee anthracnose. 【Method】Fresh hypha of coffee Collectotrichum strain BSC2-2 was used as recipient and then transformed a plasmid pCB1532-G harboring Chlorimuron ethyl and green fluorescence protein(GFP) gene into the protoplast of BSC2-2 mediated by PEG. The obtained transformants were screened and identified by genetic stability test, PCR and laser confocal microscopic observation. 【Result】The tolerance concentration of BSC2-2 to Chlorimuron ethyl was 200.0 mg/L. The optimum condition for preparing protoplasts and transformation conditions were that digesting the fresh mycelia by using 2.5% lysing enzyme at 28 ℃ for 2 h to produce an efficient yield of protoplasts and then collecting protoplasts. After washing by MTC buffer, the protoplasts were incubated with expression plasmid pCB1532-G and mixed with RM medium and transformants have been obtained. Verifications of the putative transformants by PCR amplification analysis and green fluorescent observation indicated that the GFP gene had successfully transformed in the genome of BSC2-2. Moreover, there was no obvious difference in colony morphology, growth rate and pathogenicity between transformants and wild-type stains. These results indicated that GFP gene was stably inherited in genome of BSC2-2. 【Conclusion】The PEG-mediated genetic transformation system has been successfully established. There is no significant difference in colony morphology, growth rate and pathogenicity between transformants and wild-type stains. The results can provide technical support for the further research on the gene function and pathogenic mechanism of coffee Collectotrichum.
Key words: coffee Collectotrichum; PEG-mediated genetic transformation;transformants identification;growth;pathogenicity
Foundation item: National Key Research and Development Program of China(2018YFD0201100)
0 引言
【研究意义】咖啡为茜草科(Rubiaceae)咖啡属(Coffea)多年生经济作物,主要分布于拉丁美洲、中西亚和东南亚等地(龙宇宙等,2019)。咖啡产量、产值及消费量均位居世界三大饮料作物(咖啡、茶叶和可可)之首,每年零售额达700亿美元左右(Hoffmann,2014;Chu et al.,2016;Dongw et al.,2017;Muluneh,2018),且咖啡种植业具有可循环和绿色低碳的产业特点,故近年来咖啡在我国的种植面积逐渐增加,较大幅度提高了咖啡种植户的经济效益(杨曌,2017)。我国咖啡种植区主要分布在云南和海南等热带地区。其中,云南省以种植小粒咖啡为主,主要分布在南部和西南部的思茅、保山、德宏、西双版纳和文山等地;海南省以种植中粒咖啡为主,主要种植于万宁、澄迈、文昌和海口等地(欧阳欢等,2012)。近年来,随着我国咖啡种植面积的不断扩大,咖啡病害日益严重,由炭疽菌(Colletotrichum spp.)引起的咖啡炭疽病是咖啡树上一种极易暴发流行的主要病害,在我国咖啡产区连年发生,病原菌可侵染嫩叶、叶柄、枝条和咖啡浆果等部位,引起叶片脱落、枝条干枯和果实腐烂,严重影响咖啡的产量和品质(Nguyen et al.,2009;van der Vossen and Walyaro,2009;Avelino et al.,2018)。现有的防治措施主要是培育抗病品种、化学防治和生物防治等。化学防治虽然取得一定的成效,但同时带来环境污染、抗药性和生态安全隐患等问题(郑肖兰等,2015;Cao et al.,2019)。目前,国内外对咖啡炭疽病的研究多集中在病原菌鉴定、生物学特性和防治药剂筛选等方面,鲜有针对咖啡炭疽菌致病机理的报道,在一定程度上限制了对炭疽病害侵染过程和致病机理的认识。遗传转化是研究病原菌致病分子机理的基本工具,因此,建立高效的遗传转化体系可为从基因水平解析咖啡炭疽病菌的致病机理提供技术基础。【前人研究进展】聚乙二醇(PEG)介导原生质体转化技术是炭疽菌研究中常用的一种基因功能手段,具有操作简便、无需特殊仪器等优点,是常用的遗传转化方法之一。该方法通过细胞壁降解酶作用酶解细胞壁获得原生质体,在PEG的作用下将外源DNA整合到受体基因组中,通过抗生素筛选最终获得转化子(Liu and Friesen,2012;沈慧敏等,2017;赵美等,2019;Cai at al., 2019;Niu et al.,2019)。获得高质量的原生质体是衡量遗传转化技术成功的关键因素,原生质体的数量和质量与菌龄、酶解液的组分和酶解时间等密切相关。高静等(2011)选择50 mg/mL崩溃酶和10 mg/mL裂解酶共同酶解苹果腐烂病菌菌丝2 h,释放4×107个/mL原生质体,成功建立苹果腐烂病菌的遗传转化体系。张俊等(2011)使用10 mg/mL溶壁酶与芒果炭疽菌丝振荡培养3~4 h,获得高质量的原生质体。韩小路等(2016)选用0.25 g/mL崩溃酶和0.05 g/mL溶壁酶共同酶解苹果刺盘孢菌菌丝3 h,获得高质量的原生质体。杜艳等(2017)在建立梨炭疽病原菌遗传转化体系时筛选到最佳的酶解组合为裂解酶+崩溃酶+蜗牛酶,获得的原生质体数量明显高于使用单一酶类。张雷刚等(2018)在研究PEG介导的黑附球菌遗传转化体系时发现,单一使用裂解酶与多种酶组合获得的原生质体数量存在明显差异。曾泉等(2019)在建立辣椒炭疽菌遗传转化体系时,仅用单一裂解酶作为细胞壁降解酶即取得较理想的结果。【本研究切入点】咖啡炭疽病作为咖啡树上一种严重的病害,目前尚无有关咖啡炭疽菌遗传转化体系方面的研究报道。【拟解决的关键问题】以氯嘧磺隆抗性基因作为筛选标记,探索原生质体制备过程中裂解酶组合、裂解浓度、裂解时间等条件,建立稳定、高效的PEG介导咖啡炭疽菌遗传转化体系,为后续开展咖啡炭疽菌致病机理和基因功能研究提供技术支持。
1 材料与方法
1. 1 试验材料
咖啡炭疽菌野生型菌株BSC2-2(Colletotrichum gloeosporioides),由中国热带农业科学院环境与植物保护研究所热带特色经济作物病害研究室于2019年从海南省白沙县咖啡种植园的感病咖啡叶片中分离纯化获得。携带绿色荧光蛋白报告基因(GFP)和氯嘧磺隆抗性基因的质粒pCB1532-G由海南大学植物保护学院林春花博士饋赠。rTaq聚合酶、真菌基因组提取试剂盒和质粒提取试剂盒购自宝生物工程(大连)有限公司;GFP引物序列委托上海英潍捷基贸易有限公司合成;裂解酶(Lysing enzyme)、溶壁酶(Lywallzyme)、蜗牛酶(Snailase)和氯嘧磺隆(Chlorimuron ethyl)购自生工生物工程(上海)股份有限公司; PDA培养基、PDB培养基、RM再生培养基、MTC缓冲液、40% PEG Buffer(pH 7.5)和Top Ager培养基配制参考韩小路等(2016)、张雷刚等(2018)的方法。
1. 2 试验方法
1. 2. 1 原生质体制备与再生 将活化好的BSC2-2菌饼接种至装有100 mL PDB的培养基中,28 ℃、180 r/min振荡培养3 d,双层灭菌纱布过滤,收集菌丝,用无菌水清洗3遍,再用0.8 mol/L NaCl冲洗2次,然后称取0.5 g菌丝装于50 mL灭菌离心管中,加入10 mL酶解液,所用细胞壁降解酶为溶菌酶、裂解酶和蜗牛酶。先以2.5%酶解液浓度进行试验,筛选适合的酶种类或组合,试验设7个酶解体系,分别为溶菌酶、裂解酶、蜗牛酶、溶菌酶+裂解酶、裂解酶+蜗牛酶、溶菌酶+蜗牛酶和溶菌酶+裂解酶+蜗牛酶;根据已确定的最佳酶种类,按1.0%、1.5%、2.0%、2.5%和3.0%的酶解液浓度,在摇床上28 ℃ 80 r/min振荡酶解2.0 h,确定最佳酶解浓度;最后根据最优酶解体系分别将菌丝酶解1.0、1.5、2.0、2.5和3.0 h。用3层擦拭纸和1层纱布过滤酶解混合物到50 mL离心管中,室温下3500 r/min离心10 min,收集原生质体,用MTC缓冲液冲洗原生质体后重悬,血球计数板计数。每处理3次重复,每重复计数5次。
1. 2. 2 咖啡炭疽菌对氯嘧磺隆敏感性测定 将BSC2-2菌饼(直径5 mm)分别接种到含0、12.5、25.0、50.0、100.0、150.0和200.0 mg/L氯嘧磺隆的PDA培养基上,28 ℃培养5 d,测量菌落直径,每处理3 次重复。
1. 2. 3 原生质体转化 参照高静等(2011)的转化方法,略有改动。调整原生质体终浓度至1×107个/mL。将20~30 mL pCB1532-G质粒加入200 mL原生质体中,室溫下放置30 min;加入1 mL 40% PEG Buffer,混匀,室温下放置25 min;将原生质体混合液与200 mL温热的RM再生培养基混合倒板;培养基凝固后在平板上用10 mL Top Age培养基(含有筛选浓度的氯嘧磺隆)覆盖,25 ℃倒置培养3 d。
1. 2. 4 转化子鉴定
1. 2. 4. 1 利用GFP特异性引物对转化子基因组进行PCR验证 转化子总DNA按照真菌基因组提取试剂盒使用说明进行提取。GFP特异性引物:GFP-F:5'-TACTGCAGATGGTGAGCAAGGGCGAG-3';GFP-R:5'-CGGGATCCCTTGTACAGCTCGTCCATG-3'。PCR反应体系25.0 μL:0.5 μL rTaq聚合酶(5 U/μL),2.5 μL 10×PCR Buffer(含Mg2+),2.0 μL dNTPs(2.5 mmol/L),上、下游引物(10 μmol/L)各1.0 μL,1.0 μL DNA模板(30 ng/μL),灭菌ddH2O补足至25.0 μL。扩增程序:95 ℃预变性3 min;95 ℃ 1 min,60 ℃ 1 min,72 ℃ 1 min,进行35个循环;72 ℃延伸5 min。
1. 2. 4. 2 转化子荧光检测 挑取转化子分生孢子和菌丝样品制片,在奥林巴斯FV1000激光共聚焦显微镜在蓝光(488 nm)下进行荧光观察、拍照。
1. 2. 5 转化菌株生物学特性分析
1. 2. 5. 1 转化菌株生长情况 转化菌株及野生型菌株置于PDA培养基上,28 ℃培养5 d后,在菌落边缘打取0.5 cm×0.5 cm菌饼,置于新的PDA培养基上,28 ℃条件下培养,分别于接种后第3、4、5、6和7 d测量菌落直径和观察产孢情况,每处理4次重复。
1. 2. 5. 2 转化菌株致病性测定 采用离体叶片伤口接种法,具体操作参照Cao等(2019)的方法。每处理4次重复。
1. 3 统计分析
试验所得数据均采用SAS 9.0进行统计分析,并以Duncans新复极差法进行多重比较。
2 结果与分析
2. 1 咖啡炭疽菌对氯嘧磺隆的敏感性测定结果
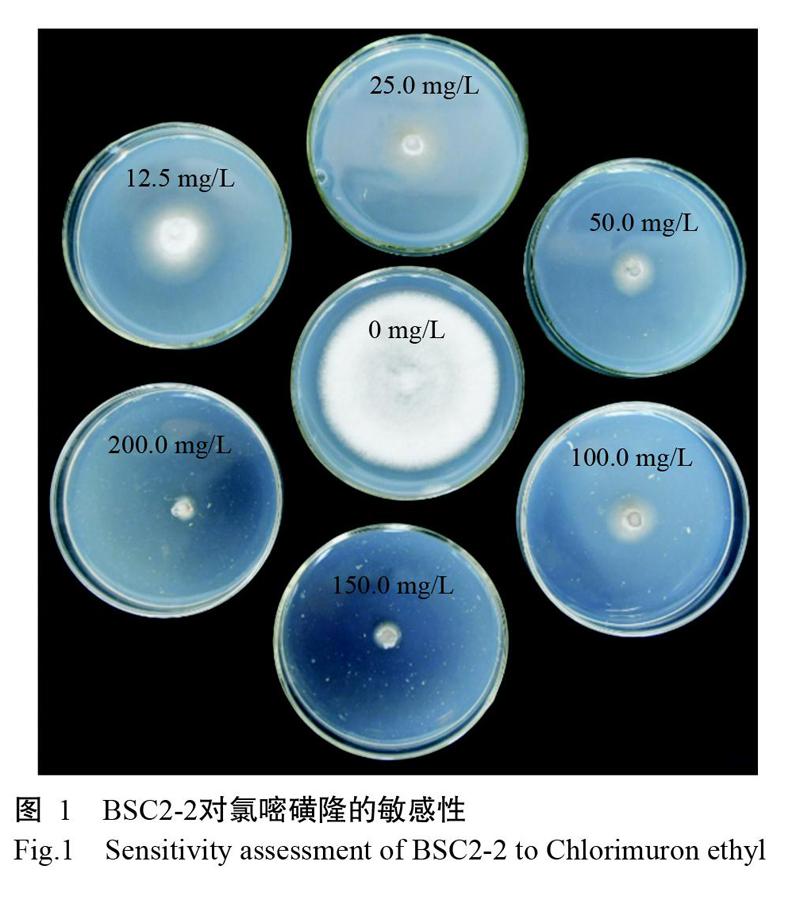
将BSC2-2在含有不同浓度梯度氯嘧磺隆的PDA培养基上进行培养观察,结果(图1)显示,培养5 d后BSC2-2菌落直径随氯嘧磺隆浓度的增加而逐渐变小,在200.0 mg/L氯嘧磺隆的PDA培养基上,BSC2-2生长被完全抑制,因此,选用200.0 mg/L氯嘧磺隆为转化子的筛选浓度。
2. 2 原生质体制备条件优化结果
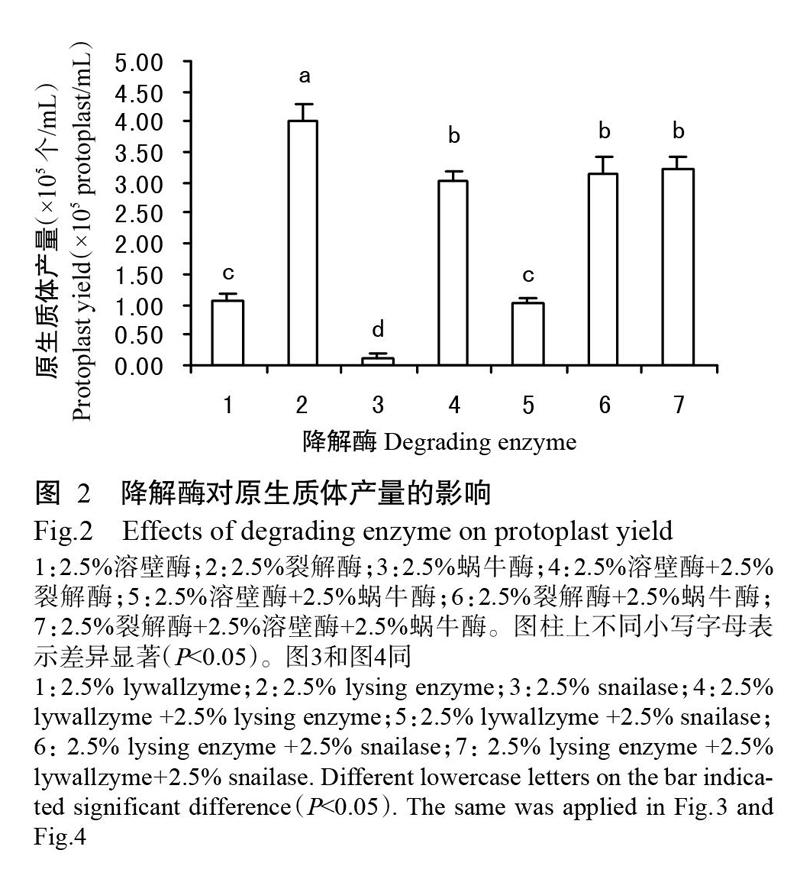
2. 2. 1 降解酶种类对原生质体产量的影响 由图2可知,在单独使用2.5%裂解酶作为细胞壁降解酶处理菌丝时,获得的原生质体产量最高,达4.03×105 个/mL,显著高于其他处理的原生质体产量(P<0.05,下同),其次是2.5%溶壁酶,2.5%蜗牛酶的效果最差,只获得0.13×105 个/mL的原生质体;2.5%裂解酶+2.5%溶壁酶组合使用时获得的原生质体产量为3.02×105 个/mL,效果不如单独使用2.5%裂解酶。2.5%蜗牛酶+2.5%裂解酶、2.5%蜗牛酶+2.5%溶壁酶组合使用时,获得原生质体数量非常少。因此,选用2.5%裂解酶制备原生质体。
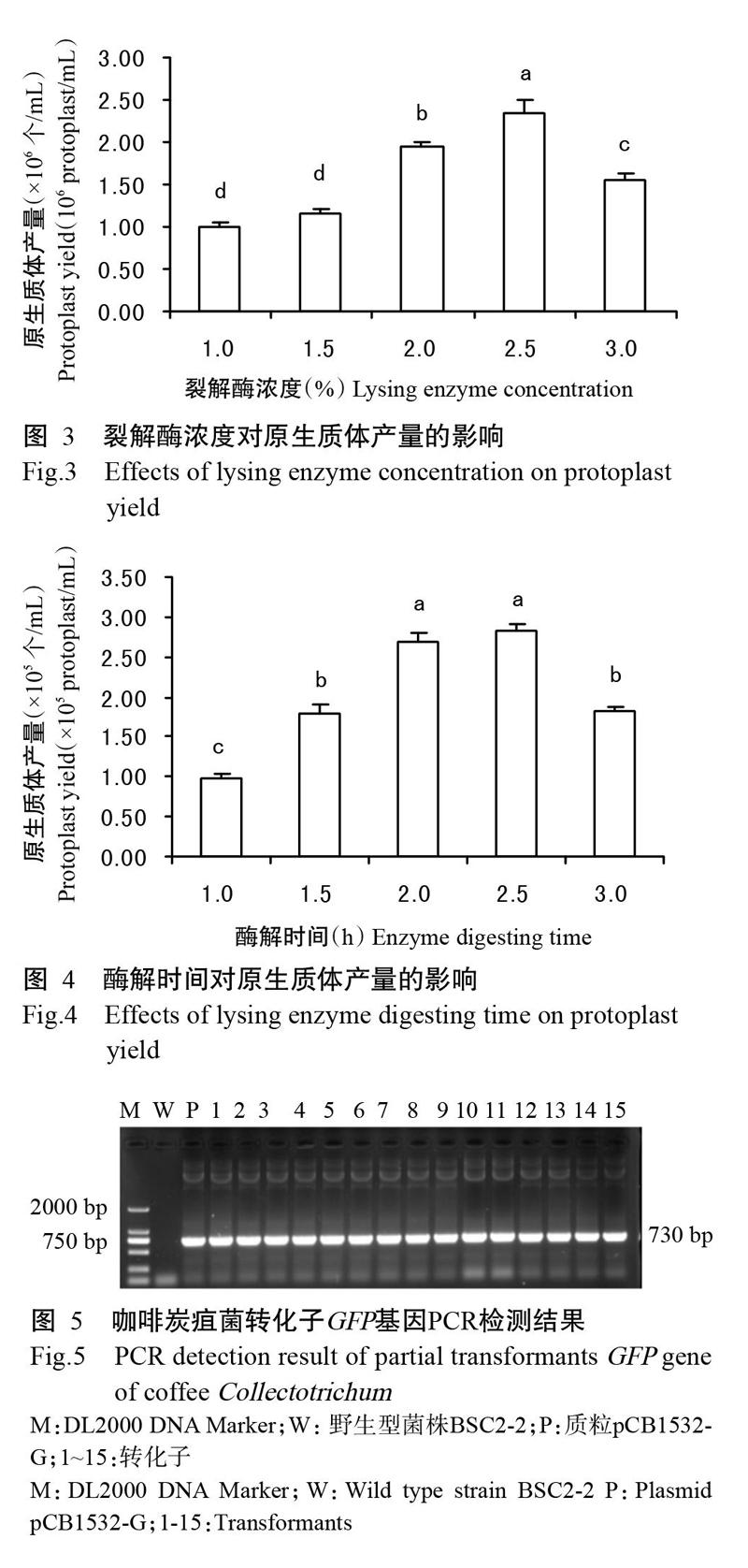
2. 2. 2 裂解酶浓度对原生质体产量的影响 用含不同浓度裂解酶的酶解液处理菌丝,结果(图3)显示,在一定浓度范围内,原生质体数量随裂解酶浓度的升高而增加,当裂解酶浓度为2.5%时,释放的原生质体数量达最高值,为2.33×106 个/mL,显著高于其他浓度处理;但裂解酶浓度升高到3.0%时,产生的原生质体数量显著减少。
2. 2. 3 酶解时间对原生质体产量的影响 用含2.5%裂解酶的酶解液分别酶解菌丝1.0、1.5、2.0、2.5和3.0 h,随着酶解时间的延长,释放的原生质体数量呈上升趋势,至2.5 h时释放的原生质体数量达最高值,为2.84×105个/mL,随后开始减少(图4),其中酶解2.0 h与酶解2.5 h的原生质体产量间无显著差异(P>0.05),因此,选择2.0 h作为收集原生质体用于遗传转化的最佳酶解时间。
2. 3 转化子的分子验证结果
将所有的转化子在含氯嘧磺隆的PDA培养基上连续培养10代后,发现所有的转化子仍可表现出对氯嘧磺隆的抗性,表明转化子所获得的抗性能稳定遗传。利用GFP基因的特异性引物GFP-F/GFP-R对随机挑取的15个转化子进行PCR扩增,结果(图5)显示,所有转化子和质粒均能在730 bp处扩增出单一条带,而野生型菌株未能扩增出GFP基因片段,说明GFP基因已成功插入并整合到咖啡炭疽菌BSC2-2基因组中,且可稳定遗传。
2. 4 转化子的显微荧光观察结果
随机挑取转化子,在激光共聚焦显微镜下观察分生孢子,可观察到明显的绿色荧光(图6)。说明GFP基因已成功整合到咖啡炭疽菌基因组中,且能很好地表达。
2. 5 转化菌株与野生型菌株的生物学特性比较分析结果
2. 5. 1 生长情况差异分析 采用十字交叉法测量菌落直径,结果显示转化菌株与野生型菌株的菌落形态无差别(图7),转化菌株与野生型菌株生长速率无明显差异(表1)。
2. 5. 2 转化菌株致病性测定 选取大小相近的咖啡嫩叶作为接种材料,用接种针轻微刺伤叶片表面,然后将PDA上培养5 d的待测菌株取直径5 mm的菌饼接种于叶片针刺伤口处,以无菌PDA为对照,接种5 d 后观察叶片发病情况。结果(图8)表明,转化菌株及野生型菌株接种的咖啡叶片均出现病斑且病斑扩展速度无明显差异,而对照未发病。
3 讨论
PEG介导原生质体转化是真菌中应用较广泛的一种遗传操作方法,具有转化效率高、操作简便及體系成熟等特点,已成熟应用于稻瘟菌、镰刀菌和炭疽菌等丝状真菌遗传转化研究中(Sweigard et al.,1992; Gu et al.,2015;曹苏珊等,2020)。本研究探索了原生质体制备过程中酶组合、酶浓度和酶解时间等条件,并成功构建了以GFP为报告基因、基于咖啡炭疽病菌的PEG转化体系,为后续基因功能研究提供了技术支持。
与其他遗传方法相比,PEG介导的遗传转化方法具有操作简单、不需要特殊仪器、周期短等优点,已成为目前基因功能研究的常用方法之一。其中,制备高质量的原生质体是建立遗传转化体系的一个关键步骤,是影响转化效率的关键因素之一。在制备原生质体时,常用蜗牛酶、崩溃酶、溶壁酶和裂解酶等单一或多种酶类组合除去真菌细胞壁。由于不同真菌细胞壁成分有所差异,对裂解酶组合、裂解浓度和裂解时间也各不相同(张颖等,2014;张雷刚等,2018)。高静等(2011)建立PEG介导的苹果腐烂病菌遗传转化体系时,在纤维素酶、溶菌酶和蜗牛酶共同酶解菌丝2 h的条件下获得高质量的原生质体;杨树炭疽菌中以1%裂解酶酶解菌丝3.5 h,获得108个/mL的原生质体(刘玲玲等,2017)。本研究单独使用2.5%裂解酶处理咖啡炭疽菌2.0~2.5 h时获得的原生质体产量最高,其次是2.5%溶壁酶,单独使用2.5%蜗牛酶制备原生质体的效果最差;2.5%裂解酶+2.5%溶壁酶+2.5%蜗牛酶组合使用未能提高酶解效果。因此,在制备原生质体时应筛选适合的细胞壁裂解酶和裂解时间。
使用有效抗生素标记筛选转化子是关键步骤。在转化炭疽菌属真菌时,潮霉素基因是目前使用较广泛的选择标记,对节黧豆炭疽菌(Robinson and Sharon,1999)、芒果炭疽菌(张俊等,2011)、黄瓜炭疽病菌(Zhou et al.,2011a)、鳄梨炭疽菌(Zhou et al.,2011b)、杨树炭疽菌(李思蒙等,2013)和苹果炭疽菌(王海艳等,2013)等的生长有良好的抑制效果,抑制浓度为50~300 mg/L。本研究的咖啡炭疽菌菌株对潮霉素基因的敏感性不高,转化时易挑取假阳性菌株,而该菌株对氯嘧磺隆的敏感性较高。由此看来,潮霉素对刺盘孢属不同种的生长抑制存在明显差异,可能与病菌种间和复合种内的生理特性差异有关。
4 结论
以咖啡炭疽菌野生型菌株BSC2-2为受体,通过PEG介导原生质体转化法将含有氯嘧磺隆标记和GFP报告基因的质粒pCB1532-G转入BSC2-2原生质体中,获得与野生型菌株在菌落形态、生长速率及致病性上无明显差别的转化子,成功建立了PEG介导的咖啡炭疽菌遗传转化体系,为研究咖啡炭疽菌的基因功能和致病机理提供技术支持。
参考文献:
曹苏珊,薛静,陈绪清,王倩楠,张秀海,安贤惠. 2020. 磁性纳米颗粒介导的椭圆小球藻转化体系的建立[J]. 江苏农业学报,36(2):306-311. [Cao S S,Xue J,Chen X Q,Wang Q N,Zhang X H,An X H. 2020. Establishment of Chlorella ellipsoidea transformation system mediated by magnetic nanoparticles[J]. Jiangsu Journal of Agricultral Science,36(2):306-311.]
杜艳,刘永锋,常有宏,蔺经,乔俊卿,刘邮洲. 2017. 梨炭疽病菌原生质体遗传转化体系的建立及GFP标记菌株的获得[J]. 江苏农业学报,33(2): 295-300. [Du Y,Liu Y F,Chang Y H,Lin J,Qiao J Q,Liu Y Z. 2017. Establishment of genetic transformation system of Colletotrichum gloeosporioides protoplast and generation of GFP-tagged transformants[J]. Jiangsu Journal of Agricultral Science,33(2): 295-300.]
高静,李艳波,柯希望,康振生,黄丽丽. 2011. PEG介导的苹果腐烂病菌原生质体转化[J]. 微生物学报,51(9): 1194-1199. [Gao J,Li Y B,Ke X W,Kang Z S,Huang L L. 2011. Development of genetic transformation system of Valsamali of apple mediated by PEG[J]. Acta Microbiologica Sinica,51(9): 1194-1199.]
韩小路,白静科,张伟,张荣,孙广宇. 2016. PEG介导的苹果果生刺盘孢Colletrotrichum fructicola 原生质体转化[J]. 西北农业学报,25(3): 442-449. [Han X L,Bai J K,Zhang W,Zhang R,Sun G Y. 2016. PEG-mediated transformation of Colletrotrichum fructicola[J]. Acta Agriculturae Boreali-occidentalis Sinica,25(3): 442-449.]
李思蒙,王永林,黃冬辉,田呈明. 2013. 杨树炭疽病菌原生质体遗传转化体系的建立及绿色荧光蛋白的表达[J]. 林业科学,49(5): 121-127. [Li S M,Wang Y L,Huang D H,Tian C M. 2013. Establishment of a PEG-mediated genetic transformation system and expression of green fluorescence protein in Colletotrichum gloeosporioides[J]. Scientia Silvae Sincae,49(5): 121-127.]
刘玲玲,王永林,熊典广,徐鑫,田呈明,梁英梅. 2017. 杨树腐烂病菌(Cytospora chrysosperma)原生质体遗传转化体系的构建[J]. 微生物学通报,44(10): 2487-2497. [Liu L L,Wang Y L,Xiong D G,Xu X,Tian C M,Liang Y M. 2017. Genetic transformation system of Cytospora chrysosperma the causal agent of poplar canker[J]. Microbiology China,44(10): 2487-2497.]
龙宇宙,董云萍,孙燕. 2019. 咖啡品种简介[J]. 世界热带农业信息,(9):12. [Long Y Z,Dong Y P,Sun Y. 2019. Coffee varieties[J].World Tropical Agriculture Information,(9): 12.]
欧阳欢,王庆煌,龙宇宙,董云萍,符红梅. 2012. 海南咖啡产业链延伸和拓展对策[J]. 农业现代化研究,33(1): 55-58. [Ouyang H,Wang Q H,Long Y Z,Dong Y P,Fu H M. 2012. Thinking about extension and expansion of Hainan coffee industry China[J]. Research of Agricutural Modernization,33(1): 55-58.]
沈慧敏,李超,高利,刘太国,刘博,陈万权. 2017. 原生质体法介导真菌遗传转化的研究进展[J]. 植物保护,43(2): 25-28. [Shen H M,Li C,Gao L,Liu T G,Liu B,Chen W Q. 2017. Research progress in transformation of fungi mediated by protoplasts[J]. Plant Protection,43(2):25-28.]
王海艳,李保华,张清明,李桂舫,董向丽,王彩霞. 2013. 农杆菌介导苹果炭疽病菌的遗传转化及转化子鉴定[J]. 中国农业科学,46(9): 1799-1807. [Wang H Y,Li B H,Zhang Q M,Li G F,Dong X L,Wang C X. 2013. Transformation of agribacterium tumefaciens-mediated Colletotrichum gloeosporioides and identification of transformants[J]. Scientia Agricultura Sinica.,46(9): 1799-1807.]
杨曌. 2017. 咖啡主要病虫害的症状识别与防治措施探讨[J]. 农业开发与装备,(1): 146-147. [Yang Z. 2017. Symptom recognition and control measures of main di-seases and insect pests of coffee[J]. Agricultural Development & Equipments,(1): 146-147.]
曾泉,满益龙,陈岳,张鑫,张卓,李成刚,杜娇,张德咏,刘勇,谭新球. 2019. 辣椒胶孢炭疽菌遗传转化体系的建立[J]. 植物保护,45(4): 156-161. [Zeng Q,Man Y L,Chen Y,Zhang X,Zhang Z,Li C G,Du J,Zhang D Y,Liu Y,Tan X Q. 2019. Successful development of genetic transformation system on Colletotrichum gloeosporioides from infected chili plants[J]. Plant Protection,45(4): 156-161.]
赵美,王陈骄子,周而勋,舒灿伟. 2019. 丝状真菌遗传转化系统的最新研究进展[J]. 基因组学与应用生物学,38(3): 1138-1143. [Zhao M,Wang C J Z,Zhou E X,Shu C W. 2019. The latest research progress on genetic transformation system of filamentous fungi[J]. Genomics and App-lied Biology,38(3): 1138-1143.]
张俊,吕延超,刘晓妹,张欣,张贺,蒲金基. 2011. 芒果尖孢炭疽病病原菌的绿色荧光蛋白基因标记[J]. 热带作物学报,32(9): 1708-1710. [Zhang J,Lü Y C,Liu X M,Zhang X,Zhang H,Pu J J. 2011. Green fluorescent protein transformed Colletrichum acutatum from mango[J]. Chinese Journal of Tropical Crops,32(9): 1708-1710.]
張雷刚,罗淑芬,周宏胜,胡花丽,李鹏霞. 2018. PEG介导的黑附球菌遗传转化体系的建立[J]. 菌物学报,37(2):205-214. [Zhang L G,Luo S F,Zhou H S,Hu H L,Li P X. 2018. Establishment of genetic transformation system of Epicoccum nigrum using PEG-mediated method[J]. Mycosystema,37(2): 205-214.]
张颖,李黎,许玉彬,王少伟,王刚. 2014. 小麦纹枯病菌原生质体制备条件及再生菌株致病性研究[J]. 河南农业科学,43(8): 82-85. [Zhang Y,Li L,Xu Y B,Wang S W,Wang G. 2014. Protoplast preparation conditions of Rhizoctonia cerealis and pathogenicity of regenerated strains[J]. Journal of Henan Agricultural Sciences,43(8): 82-85.]
郑肖兰,贺春萍,高亚男,张广宇,习金根,郑金龙,梁艳琼,李锐,吴伟怀,易克贤. 2015. 咖啡炭疽病菌生物学特性及其毒力测定[J]. 热带农业科学,35(12): 94-102. [Zheng X L,He C P,Gao Y N,Zhang G Y,Xi J G,Zheng J L,Liang Y Q,Li R,Wu W H,Yi K X. 2015. Biological characteristics and toxicity determination of the Colleto-trichum gloeosporioides penz from Coffee Arabica Linn.[J]. Chinese Journal of Tropical Agriculture,35(12): 94-102.]
Avelino J,Allinne C,Cerda R H,Willocquet L. 2018. Multiple-disease system in coffee: From crop loss assessment to susrainable management[J]. Annial review of Phytopathology,56(27):1-25.
Cai N,Wang F,Nong X Q,Wang G J,McNeill M,Cao G C,Hao K,Liu S F,Zhang Z H. 2019. Visualising confirmation of the endophytic relationship of Metarhizium anisopliae with maize roots using molecular tools and fluorescent labelling[J]. Biocontrol Science and Technology,29(11):1023-1036.
Cao X R,Xu X M,Chen H Y,West J S,Luo D Q. 2019. Characteristics and distribution of Colletotrichum species in coffee plantations in Hainan,China[J]. Plant Pathology,68(6):1146-1156.
Chu R,Wan L S,Peng X R,Yu M Y,Zhang Z R,Zhou L,Li Z R,Qiu M H. 2016. Characterizxation of new Entkaurane diterpenoids of Yunnan Arabica coffee beans[J]. Na-tural products and bioprospecting,6(4): 217-23.
Dongw J,Zhao J P,Hu R S,Dong Y P,Tan L H. 2017. Differentiation of Chinese robusta coffees according to species,using a combined electronic nose and tongue,with the aid of chemometrics[J]. Food Chemistry,229: 743-751.
Gu Q,Zhang C Q,Liu X,Ma Z H. 2015. A transcription factor FgSte12 is required for pathogenicity in Fusarium graminearum[J]. Molecular Plant Pathology,16(1):1-13.
Hoffmann J. 2014. The world atlas of coffee: From beans to brewing-coffee explored,explained and enjoyed[M]. London: London James Hoffman Octopus Publishing Group.
Liu Z H,Friesen T L. 2012. Polyethylene glycoll(PEG)-mediated transformation in filamentous fungal pathogens[M]/Bolton M D,Thomma B P H J. Plant Fungal Pathogens[M]. New York: Humana Press:365-375.
Muluneh B E. 2018. Review on the management of coffee berry disease(Colletrichum kahawae) in Ethiopia[J]. Food science and quality management,76: 73-76.
Nguyen T H P,Sall T,Bryngelsson T,Liljeroth E. 2009. Varia-tion among Colletotrichum gloeosporioides isolates from infected coffee berries at different location in Vietnam[J]. Plant Pathology,58:898-909.
Niu X Q,Pei M T,Liang C Y,Lü Y X,Wu X Y,Zhang R N,Lu G D,Yu F Y,Zhu H,Qin W Q. 2019. Genetic transformation and green fluorescent protein labeling in Ceratocystics paradoxa from coconut[J]. International Journal of Molecular Sciences,20(10): 2387.
Robinson M,Sharon A. 1999. Transformation of the bioherbieide Colletotrichum gloeosporioides f. sp. Aeschynomene by electroporation of germinated conidia[J]. Current Genetics,36(12): 98-104.
Sweigard J A,Chumle Y F G,Valent B. 1992. Disruption of a Magnaporthe grisea cutinase gene[J]. Molecular & Gene-ral Genetic,232(3):183.
van der Vossen H A M,Walyaro D J. 2009. Additional evidence for oligogenic inheritance of durable host resistance to coffee berry disease(Colletotrichum kahawae) in Arabica coffee(Coffea arabica L.)[J]. Euphytica,165: 105-111.
Zhou X Y,Li G T,Xu J R. 2011a. Efficient approaches for generating GFP fusion and epitope-tagging constructs in filamentous fungi[J]. Methods in Molecular Biology,722: 199-212.
Zhou X Y,Liu W D,Wang C F,Xu Q J,Wang Y,Qing S L,Xu J R. 2011b. AMADS-box transcription factor Mo-Mcm1 is required for male fertility,microconidium production and virulence in Magnaporthe oryza[J]. Molecular Microbiology,80(1): 33-53.
(責任编辑 麻小燕)
收稿日期:2020-03-09
基金项目:国家重点研发计划项目(2018YFD0201100)
作者简介:*为通讯作者,易克贤(1963-),博士,研究员,博士生导师,主要从事抗性育种研究工作,E-mail:yikexian@126.com。陆英(1976-),博士,副研究员,主要从事植物病理学研究工作,E-mail:ytluy2010@163.com
