氨基酸态氮对禾谷镰刀菌生长及DON毒素产生的影响
2020-02-22张升张伟王丽李孝军崔俊涛
张升 张伟 王丽 李孝军 崔俊涛

摘要:为阐明土壤不同氮素形态尤其是有机氮形态与土壤有害生物种群发生、发展的关系,以禾谷镰刀菌供试菌株,初步研究了5种氨基酸态氮对其生长及DON毒素产生的影响。结果表明:0.20%氮源添加量下的100 ml液体培养基中,各培养基中菌丝干质量差异显著,培养基中菌丝干质量从大到小的顺序为赖氨酸培养基(1.27 g)>硝酸钠培养基(0.88 g)>谷氨酸培養基(0.84 g)>酪氨酸培养基(0.52 g)>缬氨酸培养基(0.45 g)>蛋氨酸培养基(0.36 g)。赖氨酸培养基发酵液中DON毒素含量最高,达到2 951 μg/L,其他不同氮源培养基发酵液中DON毒素含量大小顺序为酪氨酸(1 418 μg/L)>谷氨酸(240 μg/L)>硝酸钠(224 μg/L)>缬氨酸(214 μg/L)>蛋氨酸(50 μg/L),毒素含量与氮源添加量呈正相关关系。生物测定结果显示,赖氨酸液体培养基发酵液的抑制效果最为明显,种子萌发抑制率、胚根抑制率、胚芽抑制率分别达到了63.0%、60.9%、63.0%,其次为酪氨酸(41.0%、34.4%、34.8%)、谷氨酸(26.0%、18.8%、23.9%)、硝酸钠(25.0%、15.6%、21.7%)、缬氨酸(25.0%、14.1%、21.7%)和蛋氨酸(7.0%、9.4%、17.4%)。对比5种氨基酸,当赖氨酸作为唯一氮源时,对禾谷镰刀菌的生长和产毒作用显著,可提高病原菌的侵染、定殖寄主植物的能力,从而诱导茎腐病的发生。
关键词:禾谷镰刀菌;氨基酸态氮;赖氨酸;DON毒素
中图分类号:S154.34文献标识码:A文章编号:1000-4440(2020)06-1403-08
Abstract:To elucidate the relationship between different nitrogen forms, especially organic nitrogen forms, and the occurrence and development of soil pest, the effects of five amino acid nitrogen on the growth of Fusarium graminearum and the production of DON toxin were studied by using Fusarium graminearum strains. The results showed that the mycelial dry weight in each medium was significantly different when 100 ml liquid medium was added with 0.20% nitrogen source, and the mycelial dry weight in mediums followed the order of lysine medium (1.27 g)> sodium nitrate medium (0.88 g)> glutamic acid medium (0.84 g)> tyrosine medium(0.52 g)> valine medium(0.45 g)> methionine medium(0.36 g). The content of DON toxin was the highest in the fermentation broth of lysine medium, which reached 2 951 μg/L. The content of DON toxin in the fermentation broth of different nitrogen sources followed the order of tyrosine medium(1 418 μg/L)> glutamic acid medium(240 μg/L)> sodium nitrate medium (224 μg/L)> valine medium(214 μg/L)> methionine medium(50 μg/L). Toxin content was positively correlated with nitrogen source addition. The results of bioassay showed that lysine liquid medium had the most obvious inhibitory effect on seed germination, radicle and germ, inhibition rates were 63.0%, 60.9% and 63.0% , respectively, followed by tyrosine medium(41.0%, 34.4%, 34.8%), glutamate medium (26.0%, 18.8%, 23.9%) , sodium nitrate medium (25.0%, 15.6%, 21.7%), valine medium (25.0%, 14.1%, 21.7%), methionine medium(7.0%, 9.4%, 17.4%). When lysine was used as the only nitrogen source, it had significant effect on the growth and toxin production of Fusarium Graminearum, which could increase the ability of pathogen to infect and colonize the host plant, and induce stem rot.
Key words:Fusarium graminearum;amino acid nitrogen;lysine;DON toxin
土壤有机态氮是土壤氮素的主要存在形式,占土壤全氮的90%以上 [1],其中氨基酸态氮占全氮的40%,直接影响着土壤肥力和供氮能力[2]。因此,以往有关土壤氮素的研究主要集中在2个方面:一是土壤不同形态氮肥对作物产量和品质的影响[3];二是土壤微生物在土壤氮素转化中的作用以及如何提高土壤氮肥利用率[4]。但有关土壤氮素种类及其转化对土壤有害微生物的影响却鲜见报道,因此,阐明土壤不同氮素形态尤其是有机氮形态与土壤有害生物种群发生、发展的关系及其对有害生物代谢的影响,无论在理论上丰富耕地地力培肥理论及土壤有害生物防治理论,还是在实践上提出和采取切实可行的措施,将耕地地力培肥与土壤有害生物防治有机地结合起来都具有重要意义。
由于禾谷镰刀菌(Fusarium graminearum)广泛分布于世界各地,习居于各种不同类型土壤中,是小麦、玉米、水稻三大禾谷类作物土传病害的主要病原菌,每年不仅直接导致农作物减产,而且还导致农产品失去食用价值[5-7]。因此,为了探明东北玉米主产区玉米茎腐病逐年加重趋势是否与玉米根际分泌的主要氨基酸种类和浓度有关[8-9],本试验初步研究5种氨基酸态氮对禾谷镰刀菌生长及DON毒素产生的影响,以此为阐明土传病害的发生机制及其防治提供依据。
1材料与方法
1.1供试材料和培养基
禾谷镰刀菌(Fusarium graminearum):在试验田玉米茎腐病的病变组织中分离得到。谷氨酸、赖氨酸、缬氨酸、蛋氨酸、酪氨酸,北京索来宝生物科技有限公司产品。玉米品种为吉农大58。Czapek培养基[10]:硝酸钠2 g,磷酸氢二钾1 g,硫酸镁(MgSO4·7H2O)0.5 g,氯化钾0.5 g,硫酸亚铁0.01 g,蔗糖30 g,蒸馏水1 000 ml,高温高压灭菌(121 ℃,2.4×105 Pa,20 min)后使用。固体培养基:每1 000 ml培养基加入20 g琼脂。禾谷镰刀菌产孢培养基[11]:1 g/L NH4NO3,1 g/L KH2PO4,15 g/L羧甲基纤维素钠,1 g/L酵母粉,0.5 g/L MgSO4·7H2O。
1.2不同氨基酸对禾谷镰刀菌生长的影响试验
在无氮的Czapek基础培养基中分别添加质量浓度梯度为0.05 g/L、0.10 g/L、0.20 g/L、0.40 g/L 5种氨基酸(谷氨酸、赖氨酸、缬氨酸、蛋氨酸、酪氨酸),作为氨基酸培养基,对照为Czapek培养基,3次重复。
液体培养:100 ml不同氨基酸培养基接种0.5 ml禾谷镰刀菌孢子悬液[11](1×106CFU/ml的孢子悬液),25 ℃,120 r/min振荡培养7 d,整瓶采样,进行抽滤。抽滤后放置于105 ℃的烘箱中4 h,菌丝烘干,称质量,菌丝质量=总质量-滤纸质量。
固体培养:上述各不同氮源添加量的液体培养基中加入琼脂,制成固体培养基。用灭菌后的打孔器,在禾谷镰刀菌平板上打取5 mm菌碟[12],放置于各种氮源固体培养基中,恒温培养箱中25 ℃培养,在1 d、2 d、3 d、4 d、5 d、6 d、7 d的同一时间,采用十字交叉法[13],测量菌落直径。
1.3不同氨基酸对DON毒素产生的影响试验
采用FD-600型呕吐毒素快速检测仪[14](上海飞测生物科技有限公司)检测液体培养基发酵液中的DON毒素。
液体摇床培养阶段完成后的6组发酵液,经过滤灭菌后取(1.00±0.02) ml于10 ml离心管中,加入5 ml提取液(V甲醇∶V水=4∶1),使用漩涡混匀器振荡5 min后,4 000 r/min离心1 min,取上清液。取100 μl离心上清液加入1 000 μl样品稀释液中,用漩涡混匀器混匀3~5 s,然后取100 μl加入到呕吐毒素荧光定量检测试纸条的加样孔中。置于37 ℃恒温孵育器中温育8 min,8 min后将试纸条插入荧光免疫定量分析仪中读数,读数值即为样品的实际检测浓度。每组重复3次,取平均值。
1.4代谢产物毒性测定
挑取长势均匀、颗粒饱满的玉米种子,放入2%次氯酸钠溶液中浸泡10 min,然后无菌水冲洗3次。将已经灭菌的双层滤纸放入培养皿中,取出完成培养后的液体培养基发酵液,过滤掉菌丝后,高温高压灭菌(121 ℃,2.4×105 Pa,20 min),取15 ml发酵液倒入培养皿中,以加入不含氮源的Czapek液体培养基作为对照,将已消毒的玉米种子放入培养基中,每个培养基中放10粒种子,3次重复,置于光照培养箱中,培养7 d,取样。记录玉米种子萌发状况、胚芽长度、胚根长度。计算种子萌发抑制率和对胚根、胚芽的生长抑制率[15],萌发抑制率=[(对照萌发率-处理萌发率)/对照萌发率]×100%,胚根(胚芽)生长抑制率=[(对照平均长度-处理平均长度)/对照平均长度]×100%。
1.5数据分析
运用Excel、IBM Spss Statistic 24进行统计分析。
2结果与分析
2.1不同氨基酸对禾谷镰刀菌生长的影响
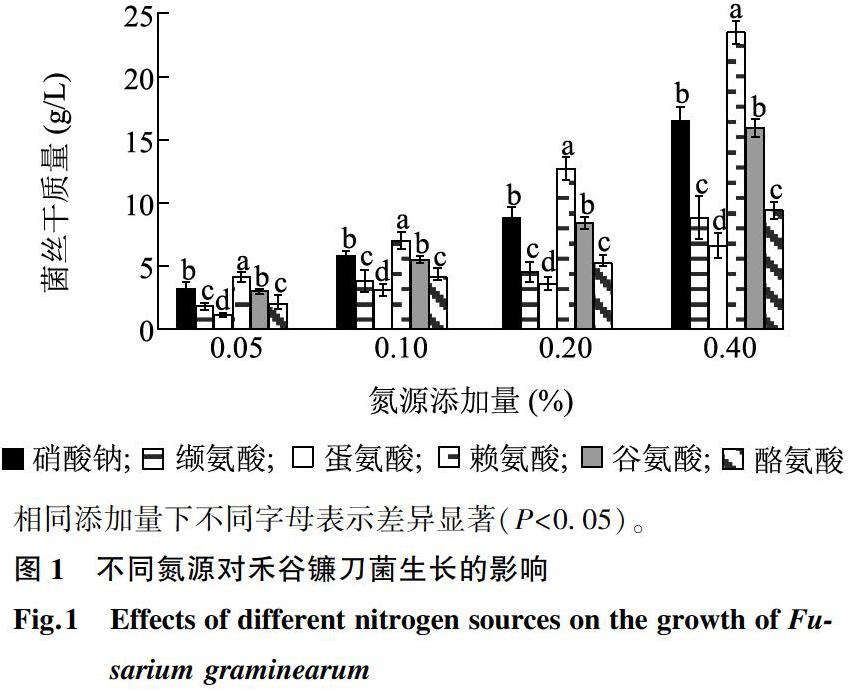
培养基中菌丝干质量变化如图1所示,氮源添加量为0.40%时,以赖氨酸为氮源的菌丝干质量显著高于其他氮源,培养基中菌丝干质量23.5 g/L,大于硝态氮氮源的硝酸钠培养基中菌丝干质量,硝酸钠培养基中菌丝干质量为16.5g/L,因此赖氨酸对禾谷镰刀菌的生长促进作用最强,其次为硝酸钠,蛋氨酸对禾谷镰刀菌的生长促进作用较小。在氮源添加量为0.20%时,赖氨酸培养基中菌丝干质量最大,为12.7 g/L,对禾谷镰刀菌的生长促进作用最强,其次为硝酸钠和谷氨酸,其培养基中菌丝干质量分别到达了8.8 g/L和8.4g/L,蛋氨酸對禾谷镰刀菌的生长促进作用最小。在氮源添加量为0.10%时,赖氨酸对禾谷镰刀菌的生长促进作用最强,菌丝干质量达到了7.0 g/L,其次为硝酸钠和谷氨酸,其培养基中菌丝干质量分别为5.8 g/L和5.5g/L,蛋氨酸培养基的菌丝干质量最小。在0.05%氮源添加量下,赖氨酸对禾谷镰刀菌的生长促进作用最强,培养基中菌丝干质量4.1 g/L,蛋氨酸对禾谷镰刀菌的生长促进作用最小。综上所述,培养基中菌丝干质量与氮源添加量呈正相关关系,不同氨基酸对禾谷镰刀菌的生长促进作用存在差异,其大小顺序为,赖氨酸>硝酸钠>谷氨酸>酪氨酸>缬氨酸>蛋氨酸。
在0.05%氮源添加量下,不同氮源赖氨酸、硝酸钠、谷氨酸、酪氨酸、缬氨酸、蛋氨酸对禾谷镰刀菌菌落生长的促进作用不同(图2),其促进作用顺序为赖氨酸>硝酸钠>谷氨酸>酪氨酸>缬氨酸>蛋氨酸。与液体培养试验结果相一致。0.10%氮源添加量下,与0.05%氮源添加量的菌落相比,菌落直径明显增加,培养7 d时赖氨酸培养基中菌落直径达到8.5 cm。0.20%氮源添加量下,相对于0.05%、0.10%氮源添加量,培养基中菌落生长速度较快,不同氮源对禾谷镰刀菌菌落的生长促进作用表现出差异性。0.40%氮源添加量下,各培养基中菌落生长速度较快,7 d时菌落直径都到达培养皿直径。赖氨酸对于禾谷镰刀菌菌落的生长促进作用最强,蛋氨酸对禾谷镰刀菌菌落的生长促进作用最弱,其促进顺序为赖氨酸>硝酸钠>谷氨酸>酪氨酸>缬氨酸>蛋氨酸。根据菌落直径的变化趋势,将不同氮源对禾谷镰刀菌菌落的生长促进作用分为3个等级:第1等级,赖氨酸;第2等级,硝酸钠、谷氨酸;第3等级,酪氨酸、缬氨酸、蛋氨酸。
无论是液体培养试验还是固体培养试验,都验证了不同氨基酸对禾谷镰刀菌的生长存在不同的促进作用,不同氮源对禾谷镰刀菌生长的促进作用顺序为赖氨酸>硝酸钠>谷氨酸>酪氨酸>缬氨酸>蛋氨酸。
2.2不同氨基酸对禾谷镰刀菌产生DON毒素的影响
不同培养基发酵液的DON毒素含量如表1所示,0.40%氮源添加量下,赖氨酸培养基发酵液中毒素含量最高,达到4 524 μg/L,其次为酪氨酸培养基发酵液,其DON含量为2 271 μg/L,蛋氨酸培养基发酵液中DON毒素含量为91 μg/L,蛋氨酸对禾谷镰刀菌产DON毒素的促进作用最低;在0.20%氮源添加量下,賴氨酸培养基发酵液中毒素含量最高,其培养基发酵液中DON含量为2 951 μg/L,其次为酪氨酸培养基发酵液,蛋氨酸培养基发酵液中DON毒素含量为50 μg/L;在0.10%氮源添加量下,赖氨酸培养基发酵液中毒素含量最高,DON含量为1 752 μg/L,其次为酪氨酸培养基发酵液,蛋氨酸培养基发酵液中DON毒素含量为31 μg/L;在0.05%氮源添加量下,赖氨酸培养基发酵液中毒素含量最高,DON含量为799 μg/L,其次为酪氨酸培养基发酵液,蛋氨酸培养基发酵液中DON毒素含量为11 μg/L。综上所述,不同氮源对禾谷镰刀菌产DON毒素的促进作用存在差异,大小顺序为赖氨酸>酪氨酸>谷氨酸>硝酸钠>缬氨酸>蛋氨酸,并且谷氨酸、硝酸钠、缬氨酸对禾谷镰刀菌产DON毒素的促进作用相互之间差异不显著。促进禾谷镰刀菌生长的氨基酸,不一定促进禾谷镰刀菌产DON毒素的能力,反之亦然。
2.3不同氮源添加量的培养基发酵液对玉米种子萌发的影响
在0.05%氮源添加量下,培养基发酵液对玉米种子萌发的影响如表2所示。赖氨酸培养基发酵液对玉米种子萌发的抑制效果显著,其萌发抑制率达到了38.0%,胚根抑制率35.9%,胚芽抑制率26.1%;酪氨酸培养基发酵液的抑制效果低于赖氨酸培养基发酵液,萌发抑制率23.0%,胚根抑制率21.9%,胚芽抑制率19.6%。谷氨酸、硝酸钠、缬氨酸培养基发酵液对玉米种子萌发的抑制效果差异不明显,蛋氨酸培养基发酵液对玉米种子萌发的抑制效果最弱。
在0.10%氮源添加量下,各氨基酸培养基发酵液对玉米种子萌发的影响如表3所示。赖氨酸培养基发酵液对玉米种子萌发的抑制效果明显,萌发抑制率达到了48.0%,胚根抑制率45.3%,胚芽抑制率41.3%;酪氨酸培养基发酵液的抑制效果低于赖氨酸培养基发酵液,萌发抑制率27.0%,胚根抑制率26.6%,胚芽抑制率23.9%。谷氨酸、硝酸钠、缬氨酸培养基发酵液对玉米种子萌发的抑制效果差异不明显,蛋氨酸培养基发酵液对玉米种子萌发的抑制效果最弱。
在0.20%氮源添加量下,各氨基酸培养基发酵液对玉米种子萌发的影响如表4所示。赖氨酸培养基发酵液对玉米种子的萌发抑制效果明显,萌发抑制率达到了63.0%,胚根抑制率60.9%,胚芽抑制率63.0%;酪氨酸培养基发酵液的抑制效果低于赖氨酸培养基发酵液,萌发抑制率41.0%,胚根抑制率34.4%,胚芽抑制率34.8%。谷氨酸、硝酸钠、缬氨酸培养基发酵液对玉米种子萌发的抑制率效果差异不明显,蛋氨酸培养基发酵液对玉米种子萌发的抑制效果最弱。
在0.40%氮源添加量下,各氨基酸培养基发酵液对玉米种子萌发的影响如表5所示。赖氨酸培养基发酵液对玉米种子萌发的抑制效果显著,萌发抑制率达到了81.0%,胚根抑制率84.4%,胚芽抑制率83.0%;酪氨酸培养基发酵液的抑制效果低于赖氨酸培养基发酵液,萌发抑制率50.0%,胚根抑制率41.0%,胚芽抑制率47.8%。谷氨酸、硝酸钠、缬氨酸培养基发酵液对玉米种子萌发的抑制效果差异不明显,蛋氨酸培养基发酵液对玉米种子萌发的抑制效果最弱。
氨基酸培养基发酵液对玉米种子萌发存在一定的抑制效果,抑制玉米种子萌发的培养基氮源顺序为赖氨酸>酪氨酸>谷氨酸>硝酸钠>缬氨酸>蛋氨酸,这与DON毒素试验的结果一致,说明禾谷镰刀菌所产的DON毒素会直接作用于种子,从而影响种子的萌发及胚根、胚芽的生长。
2.4DON毒素与玉米种子萌发的皮尔森相关性分析
0.05%氮源添加量下,培养基发酵液中毒素含量与玉米种子萌发抑制率、胚根抑制率、胚芽抑制率的相关性分析结果显示,毒素含量与萌发抑制率的相关系数r=0.972,毒素含量与胚根抑制率的相关系数r=0.986,毒素含量与胚芽抑制率的相关系数r=0.946,毒素含量与种子萌发抑制率、胚根抑制率、胚芽抑制率均呈极显著正相关关系(表6)。0.10%氮源添加量下,培养基发酵液中DON毒素含量与玉米种子萌发抑制率的相关系数r=0.978,毒素含量与胚根抑制率的相关系数r=0.985,毒素含量与胚芽抑制率的相关系数r=0.990,毒素含量与种子萌发抑制率、胚根抑制率、胚芽抑制率均呈极显著正相关关系(表7)。0.20%氮源添加量下,培养基发酵液中DON毒素含量与玉米种子萌发抑制率的相关系数r=0.947,毒素含量与胚根抑制率的相关系数r=0.994,毒素含量与胚芽抑制率的相关系数r=0.991,毒素含量与种子萌发抑制率、胚根抑制率、胚芽抑制率均呈极显著正相关关系(表8)。0.40%氮源添加量下,培养基发酵液中DON毒素含量与玉米种子萌发抑制率的相关系数r=0.923,毒素含量与胚根抑制率的相关系数r=0.924,毒素含量与胚芽抑制率的相关系数r=0.982,毒素含量与种子萌发抑制率、胚根抑制率、胚芽抑制率均呈极显著正相关关系(表9)。
3讨论
本试验证明促进禾谷镰刀菌生长的氮源顺序为赖氨酸>硝酸钠>谷氨酸>酪氨酸>缬氨酸>蛋氨酸,促进禾谷镰刀菌产DON毒素的氮源顺序为赖氨酸>酪氨酸>谷氨酸>硝酸钠>缬氨酸>蛋氨酸。相对于酪氨酸,谷氨酸更能促进禾谷镰刀菌的生长,但对于禾谷镰刀菌产DON毒素的促进作用却低于酪氨酸。可见,促进禾谷镰刀菌生长的氨基酸,不一定促进禾谷镰刀菌产生DON毒素,反之亦然。相对于硝态氮,赖氨酸不仅能促进禾谷镰刀菌的生长,而且可以促进禾谷镰刀菌DON毒素的产生,而谷氨酸、酪氨酸、缬氨酸、蛋氨酸对禾谷镰刀菌生长的促进作用低于硝态氮;赖氨酸、酪氨酸、谷氨酸对禾谷镰刀菌产DON毒素的促进作用强于硝态氮,缬氨酸、蛋氨酸弱于硝态氮。缬氨酸、蛋氨酸对于禾谷镰刀菌的生长和产DON毒素的作用较小。试验中赖氨酸促进产毒这一现象,与Gardiner等 [16-17]结论不一致。马跃亭[18]使用多种氨基酸作为氮源培养禾谷镰刀菌,发现赖氨酸作为氮源时,对禾谷镰刀菌产生DON毒素有刺激作用,由此推测与Gardiner等 [16-17]结论不一致的原因是地域因素。氨基酸作为氮源,可以强烈刺激禾谷镰刀菌中Tri5基因的表达,从而促使禾谷镰刀菌增加DON毒素的产生[19]。氨基酸作为氮源可以刺激禾谷镰刀菌产DON毒素,本试验中硝酸钠作为禾谷镰刀菌的氮源时,对禾谷镰刀菌生长的促进作用强于谷氨酸、酪氨酸,但对禾谷镰刀菌产毒性的促进作用却弱于二者。
单端孢霉烯毒素是最常见的禾谷镰刀菌毒素,单端孢霉烯产物的丢失不会影响病菌侵染小麦或玉米的能力,但它會影响病菌对寄主植物的整个侵染过程,说明单端孢霉烯族毒素在小麦和玉米上是影响侵染进程的致病力因子[20-24]。本试验结果表明赖氨酸作为禾谷镰刀菌的生长氮源时,可以促进其DON毒素的产生,而DON毒素为茎腐病的致病性因子,DON毒素含量增加,会导致禾谷镰刀菌的致病性增强,从而诱导茎腐病病害发生。
禾谷镰刀菌的主要产毒类群有3类:3-AcDON型、15-AcDON型、NIV型。3-AcDON型、15-AcDON型可产生DON毒素,NIV型可以产生雪腐镰刀菌烯醇(NIV)。DON型群体比NIV型群体产生的毒素多,对寄主植物的侵染率高,致病力强;3-AcDON型群体比15-AcDON型产生的毒素多[25-29]。在侵染植物寄主时,DON毒素的毒力强于NIV毒素,说明DON毒素是导致植株感病的主要毒素。本试验结果证明赖氨酸不仅能促进禾谷镰刀菌生长,而且促使其DON毒素产生。如果土壤环境中存在过多的赖氨酸,会加快禾谷镰刀菌的生长及其DON毒素的产生。DON毒素作为茎腐病的主要致病因子,在土壤环境下过多的存在,会提高病原菌侵染植株、定殖寄主植物的能力,从而诱导茎腐病发生。
本试验结果证明,5种氨基酸作为唯一氮源时,对禾谷镰刀菌生长的作用顺序为赖氨酸>谷氨酸>酪氨酸>缬氨酸>蛋氨酸,对禾谷镰刀菌产DON毒素的作用顺序为赖氨酸>酪氨酸>谷氨酸>缬氨酸>蛋氨酸,并且促进效果随着氨基酸添加量的增加而增大。赖氨酸作为唯一氮源时,对禾谷镰刀菌的生长和产毒作用显著,能提高病原菌的侵染、定殖寄主植物的能力,从而诱导茎腐病的发生。
参考文献:
[1]寇恒. 土壤氮素及其研究方法综述[J].亚热带水土保持,2018,30(2):64-67,70.
[2]STEVENSON F J. Organic forms of soil nitrogen[M]//STEVENSON F J. Nitrogen in Agricultural Soils. Madison,Wis USA:Am Soc of Agron Inc, 1982.
[3]尹彩霞,左竹,李桂花. 不同形态氮肥对玉米产量和土壤浸提性有机质的影响[J].中国土壤与肥料,2011(3):27-30,86.
[4]仇少君,彭佩钦,刘强,等. 土壤微生物生物量氮及其在氮素循环中作用[J].生态学杂志,2006(4):443-448.
[5]张悦,施维,李丹,等.禾谷镰刀菌全基因组候选效应因子预测与分析[J]. 江苏农业科学,2019,47(6):81-84.
[6]王芝涵,王春伟,高海馨,等. 引起玉米穗腐病的禾谷镰刀菌LAMP快速检测方法的建立[J]. 江苏农业学报,2019,35(3):581-585.
[7]曹坤,管明,陈康,等. 一株拮抗禾谷镰刀菌和降解呕吐毒素解淀粉芽孢杆菌的筛选及在饲料贮存中的应用[J]. 江苏农业科学,2019,47 (8):179-183,190.
[8]王建林,陆翠珍,檀华蓉,等. 磁场处理对玉米种子中氨基酸含量的影响[J].安徽农业科学,2010,38(35):19965-19970.
[9]程耀恺. 玉米中的氨基酸[J].国外畜牧学(饲料),1988(1):44.
[10]王绍萍,鲍文生,唐晓波,等. 黄绿青霉菌不同培养基上产毒能力差异的试验研究[J]. 黑龙江医学, 2002, 26(7):498.
[11]云英子,周欣,郭谱胜,等. 禾谷镰刀菌中磷脂酰肌醇转运蛋白功能分析[J].植物病理学报,2017,47(6):747-755.
[12]秦涵淳,杨腊英,李松伟,等. 培养基营养成分对香蕉枯萎病尖孢镰刀菌生长的影响[J].热带作物学报,2009,30(12):1852-1857.
[13]孟程程. 小麦-玉米轮作模式下两种作物茎基腐病的病原鉴定[D].泰安:山东农业大学,2019.
[14]肖理文,徐秀,赵皖,等. 基于时间分辨荧光纳米微球的呕吐毒素快速定量检测试纸条的研制及性能研究[J].粮食加工,2017,42(3):36-39.
[15]徐晗,闫晗,褚晋,等. 尖孢镰刀菌粗毒素对水稻种子萌发及根系生长的影响[J].辽宁农业科学,2017(4):83-85.
[16]GARDINER D M,KAZAN K,MANNERS J M. Nutrient profiling reveals potent inducers of trichothecene biosynthesis in Fusarium graminearum[J]. Fungal Genet Biol,2009,46(8): 604-613.
[17]GARDINER D M,KAZAN K,PRAUD S,et al.Early activation of wheat polyamine biosynthesis during Fusarium head blight implicates putrescine as an inducer of tricho -thecene mycotoxin production [J]. BMC Plant Biology,2010,10(6): 289-301.
[18]马跃亭. 小麦籽粒DON含量影响因素相关性分析及氨基酸对赤霉菌产毒的影响[D].镇江:江苏科技大学, 2019.
[19]侯瑞,金巧军. 禾谷镰刀菌真菌毒素DON生物合成途径及调控机制研究进展[J].江苏农业科学,2018,46(17):9-13.
[20]DESJARDINS A E,HOHN T M,MCCORMICK S P. Trichothecene biosynthesis in Fusarium species: chemistry, genetics, and significance.[J]. Microbiological Reviews,1993,57(3): 595-604.
[21]DESJARDINS A E, PLATTNER R D,PROCTOR R H. Genetic and biochemical aspects of fumonisin production.[J]. Advances in Experimental Medicine and Biology,1996,392: 165-173.
[22]DESJARDINS A E,PLATTNER R D,PROCTOR R H. Linkage among genes responsible for fumonisin biosynthesis in Gibberella fujikuroi mating population A[J]. Applied and Environmental Microbiology,1996,62(7): 2571-2576.
[23]BAI G H,DESJARDINS A E,PLATTNER R D. Deoxynivalenol-nonproducing fusarium graminearum causes initial infection, but does not cause disease spread in wheat spikes[J]. Mycopathologia,2002,153(2): 91-98.
[24]HARRIS L J,DESJARDINS A E,PLATTNER R D, et al. Possible role of trichothecene mycotoxins in virulence of Fusarium graminearum on maize[J]. Plant Dsease,1999,83(10) :954.
[25]TODD J W, RANDALL M C, ALEJANDRO P R, et al. An adaptive evolutionary shift in Fusarium head blight pathogen populations is driving the rapid spread of more toxigenic Fusarium graminearum in North America[J]. Fungal Genetics and Biology, 2008, 45(4):473-484.
[26]李偉,胡迎春,陈莹,等. 长江流域禾谷镰孢菌群部分菌株系统发育学、产毒素化学型及致病力研究[J].菌物学报,2010,29(1):51-58.
[27]GALE L R, HARRISON S A, WARD T J,et al.Nivalenol-type populations of Fusarium and F. asiaticum are prevalent on wheat in southern Louisiana[J]. Phytopathology, 2011,101(1):124-134.
[28]张昊. 中国麦类赤霉病菌群体遗传多样性及生态适应性研究[D].北京:中国农业科学院,2011.
[29]DESJARDINS A E,MANANDHAR G,PLATTNER R D,et al. Occurrence of Fusarium species and mycotoxins in nepalese maize and wheat and the effect of traditional processing methods on mycotoxin levels[J]. Journal of Agricultural and Food Chemistry,2000,48(4): 1377-1383.
(责任编辑:张震林)
