原位漫反射红外光谱研究Ni-Fe/γ-Al2O3催化CO甲烷化反应
2020-02-22武瑞芳王永钊赵永祥
武瑞芳,王 宁,周 翔,王永钊,赵永祥
(山西大学化学化工学院,精细化学品教育部工程研究中心,山西 太原 030006)
近年来,质子交换膜燃料电池因其环境友好、操作温度低且工作效率高而受到关注[1-4]。氢气是质子交换膜燃料电池的燃料,主要通过蒸汽重整和碳氢化合物的部分氧化等途径制得[5-7],但上述反应制得的氢气中不可避免地含有体积分数1%~2%的CO,极易毒化燃料电池的电极[8-10]。富氢气体中微量CO的脱除广泛采用CO甲烷化法,在报道的众多CO甲烷化催化剂中,Ni基催化剂因其催化活性高,选择性好以及成本相对低廉等优势受到研究者的青睐[11]。
在CO甲烷化反应中,双金属Ni基催化剂显示出比单金属催化剂更高的催化活性和稳定性[12-17]。本课题组前期研究工作表明,与Ni/γ-Al2O3和Fe/γ-Al2O3催化剂相比,Ni-Fe/γ-Al2O3双金属催化剂表现出更优异的CO甲烷化催化性能。在相同反应条件下,220 ℃时Fe/γ-Al2O3催化剂未表现出CO甲烷化催化活性,Ni/γ-Al2O3催化剂上CO转化率仅为48%,而Ni-Fe/γ-Al2O3双金属催化剂上CO则完全甲烷化。通过XRD、N2物理吸附-脱附、H2-TPR、H2-TPD等表征结果显示,3种催化剂的织构性质并无明显差异,但Ni-Fe/γ-Al2O3催化剂还原后形成Ni-Fe合金,H2吸附量明显增加[18]。为了进一步探究Ni/γ-Al2O3、Fe/γ-Al2O3和Ni-Fe/γ-Al2O3催化剂催化活性差异的原因,本文采用原位漫反射红外光谱对3种催化剂上CO、CO-H2混合气的吸附行为进行比较研究,旨在阐明催化剂上吸附物种的演变规律,为高性能CO甲烷化催化剂的研发提供理论参考。
1 实验部分
1.1 催化剂制备
称取一定量Ni(NO3)2·6H2O和Fe(NO3)2·9H2O配制成单一盐水溶液和一定计量比的混合盐水溶液,然后分别等体积浸渍于γ-Al2O3载体上[(40~60)目,比表面积253 m2·g-1],充分搅拌并静置0.5 h后,120 ℃干燥3 h,空气气氛400 ℃焙烧3 h,H2气氛400 ℃还原3 h,H2流速30 mL·min-1。所得催化剂为负载质量分数10%Ni/γ-Al2O3、10%Fe/γ-Al2O3和6%Ni-4%Fe/γ-Al2O3,分别标记为Ni/γ-Al2O3、Fe/γ-Al2O3和Ni-Fe/γ-Al2O3催化剂。
1.2 原位漫反射红外光谱实验
原位漫反射红外光谱实验采用HVC-DRP-3型高温漫反射池,在德国布鲁克公司TENSOR27型傅里叶变换红外光谱仪上进行。将一定量的催化剂粉末装入样品池,并刮平样品表面,以利于增强漫反射信号。
样品池首先通入氦气(流速20 mL·min-1)并逐渐升温至350 ℃,恒温30 min以吹尽催化剂表面的空气。然后降至室温,切换为常压氢气(流速为30 mL·min-1)并程序升温(2 ℃·min-1)至400 ℃,在此温度下还原催化剂1 h。还原结束后切换为氦气吹扫30 min,降至室温后切换为CO或体积分数0.5%CO-H2混合气,控制流速为15 mL·min-1,使气体在催化剂表面进行动态吸附,然后每隔一定时间进行红外扫描,扫描次数为128次,分辨率为4 cm-1。
2 结果与讨论
2.1 Fe/γ-Al2O3催化剂
图1为不同温度下Fe/γ-Al2O3催化剂上CO吸附的原位漫反射红外光谱图。由图1可以看出,Fe/γ-Al2O3催化剂在2 174 cm-1和2 118 cm-1处出现气相CO的吸收峰[19],除此之外,未观察到其他红外吸收峰。
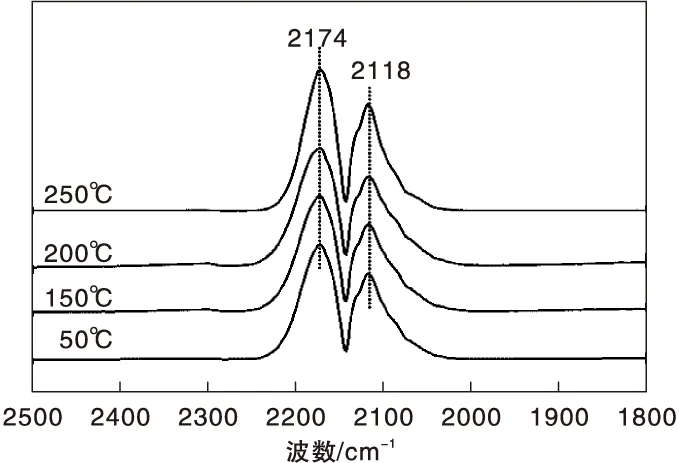
图1 不同温度下Fe/γ-Al2O3催化剂上CO吸附的原位漫反射红外光谱图Figure 1 In-situ DRIFTS of CO adsorbed on Fe/γ-Al2O3 catalyst at different temperatures
图2为不同温度下Fe/γ-Al2O3催化剂上CO-H2混合气吸附的原位漫反射红外光谱图。与图1相比,气相CO的吸收峰强度明显减弱,这是由于混合气中CO的体积分数较小所致。此外,该催化剂上未观察到其他任何吸收峰。显然,无论H2存在与否,Fe/γ-Al2O3催化剂均未表现出CO吸附行为,这是其不具有CO甲烷化催化活性的直接原因。

图2 不同温度下Fe/γ-Al2O3催化剂上CO-H2混合气吸附的原位漫反射红外光谱图Figure 2 In-situ DRIFTS of CO and CO-H2 mixed gas adsorbed on Fe/γ-Al2O3 catalyst at different temperatures
2.2 Ni/γ-Al2O3催化剂
图3为不同温度下Ni/γ-Al2O3催化剂上CO吸附的原位漫反射红外光谱图。由图3可以看出,50 ℃时Ni/γ-Al2O3催化剂表面除了气相CO吸收峰外,在2 059 cm-1处还出现明显的线式CO(COL)吸收峰[19-21]。随着温度升高,COL峰强度明显增强,但在110 ℃后开始呈下降趋势。200 ℃时,在2 359 cm-1和2 341 cm-1处出现气相CO2的吸收峰,表明随着温度升高,部分化学吸附的CO发生歧化反应[22]。在(110~250) ℃,COL峰强度随着温度的升高逐渐减弱,表明CO在Ni/γ-Al2O3催化剂表面化学吸附变弱。

图3 不同温度下Ni/γ-Al2O3催化剂上CO吸附的原位漫反射红外光谱图Figure 3 In-situ DRIFTS of CO adsorbed on Ni/γ-Al2O3 catalyst at different temperatures
图4为不同温度下Ni/γ-Al2O3催化剂上CO-H2混合气吸附的原位漫反射红外光谱图。

图4 不同温度下Ni/γ-Al2O3催化剂上CO-H2混合气吸附的原位漫反射红外光谱图Figure 4 In-situ DRIFTS of CO-H2 mixed gas adsorbed on Ni/γ-Al2O3 catalyst at different temperatures

2.3 Ni-Fe/γ-Al2O3催化剂
图5为不同温度下Ni-Fe/γ-Al2O3催化剂上CO吸附的原位漫反射红外光谱图。由图5可知,50 ℃时除了气相CO吸附峰外,在2 057 cm-1处也出现微弱的COL吸收峰,且峰强度随着温度的升高逐渐增大,这与CO在Ni/γ-Al2O3催化剂上的吸附行为明显不同,后者的COL吸收峰强度随温度升高先增大后减小。可见,与Ni/γ-Al2O3催化剂相比,Ni-Fe/γ-Al2O3催化剂表面存在较强的CO化学吸附中心,与Ni-Fe/γ-Al2O3催化剂中Ni-Fe合金的形成有关[18]。

图5 不同温度下Ni-Fe/γ-Al2O3催化剂上CO吸附的原位漫反射红外光谱图Figure 5 In-situ DRIFTS of CO adsorbed on Ni-Fe/γ-Al2O3 catalyst at different temperatures

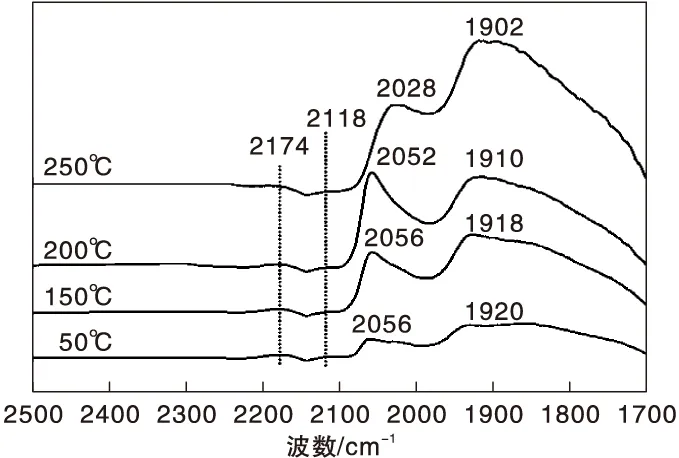
图6 不同温度下Ni-Fe/γ-Al2O3催化剂上CO-H2混合气吸附的原位漫反射红外光谱图Figure 6 In-situ DRIFTS of CO-H2 mixed gas adsorbed on Ni-Fe/γ-Al2O3 catalyst at different temperatures
3 结 论
(1) 在CO吸附条件下,Fe/γ-Al2O3催化剂上未发生CO化学吸附,Ni/γ-Al2O3和Ni-Fe/γ-Al2O3催化剂上均有线式CO形成,但后者对CO的吸附能力明显强于前者。
(2) 在CO-H2混合气吸附条件下,Ni/γ-Al2O3催化剂表面以镍羰基氢化物吸附为主,而Ni-Fe/γ-Al2O3催化剂表面则以镍多氢羰基氢化物吸附为主,特别是桥式镍多氢羰基氢化物。
(3) 镍多氢羰基氢化物的Ni中心对CO分子反键π轨道更强的反馈电子能力导致Ni-C键增强,C-O键削弱,更有利于C-O键断裂进而加氢进行甲烷化反应,因而Ni-Fe/γ-Al2O3催化剂显示出更高的CO甲烷化催化活性。
