大黄素介导IRS-2/PI3K/Akt通路干预大鼠非酒精性脂肪性肝炎的实验研究
2020-02-19寇小妮解新科郝明霞宋春荣吴维
寇小妮,解新科,郝明霞,宋春荣,吴维
非酒精性脂肪性肝炎(NASH)的特点是肝脂肪堆积、炎性反应和不同程度的纤维化[1]。NASH患者主要病理生理特点是胰岛素抵抗,所以改善胰岛素抵抗在预防NASH进展方面具有治疗潜力[2]。肝脏是胰岛素的主要靶器官之一,在葡萄糖稳态中起着重要作用。在肝脏中,胰岛素受体底物2 (IRS-2) /磷脂酰肌醇3-激酶(PI3K)信号转导通路在调节胰岛素的糖代谢作用中起着关键作用[3]。胰岛素受体(IR)具有2个α亚基和2个跨膜β亚基的细胞内酪氨酸激酶域,α亚基增加内在酪氨酸激酶活性,触发一系列磷酸化反应,激活下游的关键靶点,包括IRS-2、PI3K和丝苏氨酸蛋白激酶(Akt)[4]。大黄素是中药大黄的主要有效成分,具有抗炎、抗氧化和抗纤维化等功能[5]。大黄素可以抑制线粒体呼吸链活性、激活AMP活化蛋白激酶(AMPK),降低肝脏能量状态[6]。然而,大黄素作用的确切分子靶点仍不明确。既往有研究在高脂喂养的胰岛素抵抗大鼠模型中检测到了大黄素对肝糖原含量的影响[7]。然而,目前尚无大黄素对IRS-2/PI3K/Akt信号通路影响的研究。因此,本研究建立胰岛素抵抗相关的大鼠NASH模型,并用大黄素进行治疗,检测IRS-2/PI3K/Akt信号通路中关键功能分子的表达,探讨大黄素防治NASH的可能作用机制,报道如下。
1 材料与方法
1.1 实验动物 选取雄性8周龄SD大鼠35只[由甘肃中医药大学实验动物中心提供,许可证号:SCXK (甘) 2015-0005],体质量200~240 g,动物饲养在SPF环境中自由进食和饮水,动物相关处置均符合《中华人民共和国实验动物管理条例》要求,适应性喂养1周后进行实验。
1.2 试剂与仪器 大黄素(陕西森弗生物技术有限公司);普通饲料、高脂饲料(普通饲料∶猪油∶蔗糖∶胆固醇∶胆盐=83∶10∶5∶1.5∶0.5,上海斯莱克实验动物有限公司);血清胰岛素测定试剂盒(中国原子能同位素研究所);兔抗人IRS-2、p-IRS-2、PI3K、p-PI3K、Akt、p-Akt(美国Santa Cruz公司);兔抗体辣根过氧化物酶HRP标记亲和纯化山羊抗兔IgG二抗和兔抗β-actin单克隆抗体(武汉艾美捷科技有限公司);蛋白抽提试剂盒(武汉博士德生物工程有限公司);ECL 超敏发光液、PVDF膜(美国 Millpore 公司);HE染色试剂盒(中国国药集团);组织脱水机、包埋机、全自动轮转切片机等病理配套设备(德国Leica公司);光学显微镜(日本Nikon公司);Au2700型全自动生化分析仪(日本Olympus公司);凝胶成像仪(美国UVP 公司);BIO-RAD垂直电泳仪(美国BIO-RAD公司)。
1.3 分组及造模 根据随机数字表法选取25只大鼠给予高脂饲料喂养12周制备NASH模型[8]。12周后取5只大鼠进行称重、检测血糖血脂等生化学指标及行肝组织病理检测,以肝指数明显增加,胰岛素抵抗指数(HOMA-IR)、血脂指标及肝功能指标明显升高,肝脏病理组织学示肝小叶结构模糊,出现脂肪空泡,确定建立NASH模型制备成功。剩余20只大鼠随机分为模型组(10只)和大黄素组(10只),另取同龄10只未造模大鼠作为正常对照组。大黄素组大鼠给予20 mg/kg的大黄素灌胃,正常对照组和模型组给予等量生理盐水,连续给予8周。禁食12 h后麻醉大鼠,心脏采血,分离血清,分离肝组织并称重,计算肝指数 = 肝脏湿重/体质量。-80℃保存备用。
1.4 检测指标与方法
1.4.1 空腹血糖、空腹胰岛素检测:用酶联免疫吸附法测定空腹胰岛素,操作方法按说明书进行,并计算HOMA-IR,HOMA-IR=空腹血糖×空腹胰岛素/22.5。
1.4.2 肝功能及血脂指标检测:AU2700型全自动生化分析仪测定血清中丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、三酰甘油(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)的含量。
1.4.3 肝脏病理学检查:取相同部位大鼠肝脏组织进行固定,经脱水、包埋,切成厚度为1 μm切片,用苏木精和伊红(HE)染色,在显微镜下观察病理变化,选出一个具有代表性的图像。
1.4.4 蛋白表达检测: Western-blot法检测IRS-2、p-IRS-2、PI3K、p-PI3K、Akt、p-Akt蛋白相对表达量,取一块肝组织,用生理盐水洗涤2次,进行研碎,根据肝组织重量加入相应蛋白抽提试剂,进行蛋白提取,最后进行蛋白浓度的测定,调整蛋白浓度至相同,加入1/5体积的5×Buffer进行变性,进行电泳,每孔上样量为30 μg,将印迹转移到PVDF膜上,然后用5%脱脂牛奶在室温下封膜1 h,加入兔抗IRS-2、p-IRS-2、PI3K、p-PI3K、Akt、p-Akt(1∶1 000)和β-actin(1∶10 000)抗体,4℃过夜,冲洗后,将膜与辣根过氧化物酶HRP标记山羊抗鼠IgG二抗(1∶10 000)在室温下孵育30 min。用ECL法进行显色,采集图像,以β-actin作为内参并进行分析。
2 结 果
2.1 各组大鼠肝指数、空腹血糖、空腹胰岛素和HOMA-IR水平比较 模型组大鼠肝指数、空腹血糖、空腹胰岛素和HOMA-IR水平较正常对照组增高,差异有统计学意义(P<0.05);大黄素组大鼠肝指数、空腹血糖、空腹胰岛素和HOMA-IR水平较模型组降低,差异有统计学意义(P<0.05),见表1。
2.2 各组大鼠肝功能及血脂水平比较 模型组大鼠ALT、AST、TG、TC和LDL-C水平较正常对照组增高,HDL-C水平较正常对照组降低,差异有统计学意义(P<0.05);大黄素组大鼠ALT、AST、TG、TC和LDL-C水平较模型组降低,HDL-C水平较模型组增高,差异有统计学意义(P<0.05),见表2。
2.3 各组大鼠肝组织病理学改变 正常对照组大鼠肝脏结构正常,肝索、肝窦排列整齐,无明显病变;模型组出现弥漫性肝细胞脂肪变,存在炎性细胞浸润和细胞气球样变性,肝细胞索排列紊乱,小叶内见大量炎细胞浸润及少量点状肝细胞坏死,部分坏死灶融合成片,未见明显纤维化;大黄素组治疗后组织脂肪变程度明显减轻,炎细胞浸润明显减少,见图1。
2.4 各组大鼠肝组织中IRS-2、p-IRS-2、PI3K、p-PI3K、Akt、p-Akt蛋白相对表达量比较 模型组大鼠IRS-2、p-IRS-2、PI3K、p-PI3K、Akt、p-Akt蛋白相对表达量较正常对照组降低,差异有统计学意义(P<0.05);大黄素组大鼠IRS-2、p-IRS-2、PI3K、p-PI3K、Akt、p-Akt蛋白相对表达量较模型组增高,差异有统计学意义(P<0.05),见表3、图2。
3 讨 论
目前,NASH已被公认为一种重要的健康问题,其发病率在世界范围内呈上升趋势[9]。然而,NASH的发病机制尚不完全清楚,动物模型是研究肝胰岛素抵抗病理生理学的重要工具,因此提出了许多啮齿动物模型对其进行研究。高脂饮食模型可以重现人类NASH的组织病理学特征,被广泛用于NASH的研究[10],本研究通过高脂喂养大鼠12周,不仅表现为脂肪肝化,而且表现为胰岛素抵抗,给予大黄素治疗后,可见肝指数下降,脂肪变性明显改善,肝组织损伤明显减轻,同时血清ALT、AST和TG、TC、LDL-C水平降低,葡萄糖耐受不良和胰岛素抵抗得到了有效改善。同时,动物实验数据显示,大黄素可改善肝脏脂肪变性和肝脏炎性反应,并在一定程度上改善肝纤维化[11]。这些结果与本研究的数据一致。但大黄素治疗NASH的作用机制尚不清楚。
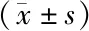
表1 各组大鼠肝指数、空腹血糖、空腹胰岛素和HOMA-IR水平比较
注:与正常对照组比较,aP<0.05;与模型组比较,bP<0.05
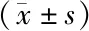
表2 各组大鼠肝功能和血脂水平比较
注:与正常对照组比较,aP<0.05,与模型组比较,bP<0.05
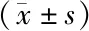
表3 各组大鼠肝组织中IRS-2、p-IRS-2、PI3K、p-PI3K、Akt、p-Akt蛋白表达水平比较
注:与正常对照组比较,aP<0.05;与模型组比较,bP<0.05
正常对照组 模型组 大黄素组
图1 各组大鼠肝组织病理学改变(HE染色,×200)
大黄素改善胰岛素抵抗的作用可能是由于IR表达和磷酸化增加及下游IRS-2/PI3K/Akt信号转导通路增强导致的。本研究首次揭示了大黄素对IRS-2/PI3K/Akt通路的影响。在本研究的NASH和胰岛素抵抗大鼠模型中,检测到了肝脏中被抑制的IRS-2/PI3K/Akt信号通路。IRS-2、Akt和PI3K显著降低,而大黄素处理显著逆转了这些分子事件。本研究中最重要的新发现是大黄素抑制了脂肪变性肝脏的胰岛素表达。动物实验数据显示,大黄素可改善肝脏脂肪变性和肝脏炎性反应,并在一定程度上改善肝纤维化[12-13]。这些结果与本研究的数据一致,胰岛素抵抗引起NASH的主要原因是高胰岛素血症和脂代谢紊乱,促进胰岛素与IR的α亚基结合,诱导β亚基酪氨酸激酶活化,导致IRS-2磷酸化,从而诱发一系列生化改变[14]。IRS-2/PI3K/Akt通路在维持胰岛素与其相应IR结合的信号传导中发挥重要作用[15]。IRS-2在肝脏和胰腺组织中大量表达,当其表达降低时,会影响胰岛素信号的有效传递,导致IR的发生[16]。PI3K过度表达抑制IR与IRS-2的结合,从而抑制PI3K 的活性[15]。大黄素可以诱导Neuro2a细胞中GSK-3β/ PI3K/Akt信号通路的激活[17]。在对糖尿病肾病(DN)大鼠的研究中发现,PI3K/Akt信号通路在DN早期病变的发展中起着重要作用,大黄素能显著促进DN大鼠p-Akt蛋白表达[18-19]。GSK-3β在胰岛素受体相关信号通路中的作用受到越来越多的重视,细胞实验涉及GSK-3β过表达阻止酪氨酸残基进行胰岛素受体磷酸化,并减少IRS-2水平,从而削弱胰岛素信号通路[20-21]。
综上,大黄素可以改善NASH大鼠肝脏脂肪沉积及胰岛素抵抗,其机制与IRS-2/PI3K/Akt信号通路激活有关,但具体机制尚需进一步的研究。
利益冲突:所有作者声明无利益冲突
作者贡献声明
寇小妮:设计研究方案,实施研究过程,论文撰写,论文修改;解新科:实施研究过程,资料搜集整理;郝明霞:进行统计学分析;宋春荣:设计研究思路,分析试验数据,论文审核;吴维:数据收集,分析整理
