维生素K2通过降低D-双功能蛋白活性抑制肝癌的实验研究
2020-02-19孔令玉路欣姜玲玲
孔令玉,路欣,姜玲玲
维生素K2(vitamin K2,VK2)是一种脂溶性维生素。研究已经证明,VK2对包括肝癌在内的许多肿瘤细胞增殖具有抑制作用[1]。尽管,有关VK2抑制肝癌细胞增殖分子机制研究涉及抑制核转录因子、细胞周期调节蛋白和信号通路等多种学说[2-5],但仍存在有待解决的问题。肝细胞肝癌(hepatocellular carcinoma,HCC)是发病率较高的肿瘤之一,其恶性程度高,致死率极高,并且具有术后预后差等特征,目前已经成为全球第二大致死性癌症[6-7]。近年来医学界对于其发病机制和靶向治疗的研究受到了越来越多的重视,但由于特异性基因诊断较少,而且针对于某些基因研发的靶向治疗药物效果欠佳,因此,探讨肝癌的致病机制和寻找更安全有效的治疗药物具有重要的临床意义和应用价值。
D-双功能蛋白(D-bifunctional protein,DBP)作为一种重要的氧化还原代谢酶,能够促进雌二醇(E2)脱去氢离子而失去活性,因此,生物体内雌二醇量的改变可作为DBP活性增减的指标。实验研究表明,DBP在肝癌HepG2细胞明显高表达,且能够降低雌二醇表达水平促进肝癌细胞增殖[8]。而且肝癌患者中DBP的表达与肿瘤标志物的表达具有良好的相关性,因此,DBP很有可能成为肝癌诊断和治疗的新靶点[9]。最近一项研究报道,HepG2细胞内VK2可与DBP相结合而影响其活性[10],因此VK2很有可能通过与DBP相互作用,降低其活性,上调E2水平,来发挥其抑制肝癌细胞增殖的作用[11]。因此本研究探讨了VK2对DBP过表达引起的肝癌细胞增殖的抑制机制,为DBP作为肝癌诊断和治疗新靶点提供了更有利的实验依据,为VK2和DBP作为预防和治疗肝细胞肝癌的分子机制提供更好的基础证据和靶向治疗方向,报道如下。
1 材料与方法
1.1 实验材料
1.1.1 实验细胞与分组:人源的肝癌细胞HepG2实验细胞由中国医学科学院(北京协和医学院)肿瘤研究所提供。将细胞分为过表达DBP组(DBP组)和empty组及敲低DBP组(siDBP组)和siNC组,过表达DBP组和敲低DBP组分别给予0~100 μmol/L 不同浓度的维生素K2处理。
1.1.2 实验试剂:DBP质粒(本实验室保存);小干扰RNA(siRNA),siD-双功能蛋白(siDBP):上游5′GUACCUUUGUAUUUGAGGAdTdT3′,下游5′UCCUCAAAUACAAAGGUACdTdT3′,siNC:上游5′UUCUCCGAACGUGUCACGUTT 3′,下游:5′ACGUGACACGUUCGGAGAATT 3′(上海生物工程技术公司);Lipofectamine 2000TM转染试剂(美国Invitrogen公司);兔源-抗人DBP单克隆抗体(美国Santa Cruz公司);兔源-抗人β-actin多克隆内参抗体(美国Santa Cruz公司);CCK-8试剂(日本ojindo公司);雌二醇(E2)(美国Sigma公司);125碘(125I)雌二醇放射免疫试剂盒(天津九鼎公司);维生素K2(北京百灵威科技公司)。
1.2 细胞转染 将HepG2细胞种在孔板中,于37℃、5 % CO2条件下培养24 h,待细胞生长至70 %左右融合度时进行转染。首先按照转染试剂的说明将适量的质粒[空载体质粒(Empty)和过表达质粒(DBP)]、小干扰RNA[对照小干扰RNA(siNC)和目的小干扰RNA(siDBP)]分别溶于无血清无抗生素的RPMI1640培养液中,混匀。将与转染试剂同浓度的Lipofectamine 2000TM溶于无血清无抗生素RPMI1640培养液中,混匀,室温静置5 min。将上述4种转染试剂分别与脂质体混匀,室温静置20 min。最后将孔板中原有的培养基弃去,并用新鲜无血清无抗生素RPMI1640培养基洗涤细胞2次,将各组脂质体和质粒混合液均匀滴入每孔细胞中,置培养箱37℃培养。6 h后更换为含10 % 胎牛血清的RPMI1640培养基,继续培养48 h用于后续实验。
1.3 Western-blot检测DBP表达 处理后的细胞经过蛋白提取、蛋白定量后用裂解液稀释成5 μg/μl浓度的悬液,加5×上样缓冲液95℃煮沸5 min。制作SDS-PAGE,进行蛋白上样和凝胶电泳,电泳后将蛋白胶转至PVDF膜,5%脱脂奶粉进行封闭,分别加兔抗人DBP和β-actin抗体(1∶1 000) 4 ℃冰箱过夜温育,TPBS洗膜,用荧光二抗进行室温静置孵育1 h (1∶5 000),用TBST洗膜2次,每次约10 min,最后Odyssey发光仪进行扫描。
1.4 细胞计数试剂盒(CCK-8)检测 按照说明书将CCK-8试剂与无血清的RPMI1640培养基以1∶4的比例混合,将转染后培养48 h的96孔板中的培养基去除,每孔加入100 μl CCK-8的混合液,于37℃、5 % CO2条件下培养4 h。最后用酶标仪在450 nm处读取吸光度值。
1.5 E2水平检测 按照E2放射免疫试剂盒的说明,取8个试管,分别标记为总T、NSB、S0、标准品S1、标准品S2、标准品S3、标准品S4、标准品S5,按照试剂盒说明,分别加入稀释缓冲液,标准品10、50、100、250、750 pg/ml、标记物及抗体,充分混匀,置于37℃ 1.5 h后加入分离剂充分混匀,4℃ 3 600 r/min离心20 min,弃上清液,在γ计数仪上测定各管的放射性活度强度(cpm)。以cpm读数为纵坐标,标准品浓度为横坐标绘制标准曲线。取待测培养基200 μl,代替标准品,加入标记物及抗体,充分混匀,置于37℃ 1.5 h后加入分离剂充分混匀,4℃ 3 600 r/min离心20 min,弃上清液,在γ计数仪上测得cpm值,利用标准曲线得出待测样品E2的含量。结果以每毫升样品含有E2的量 (ng/ml) 表示。
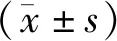
2 结 果
2.1 DBP高表达对肝癌HepG2细胞增殖的影响 Western-blot实验结果显示,DBP过表达质粒和干扰RNA转染HepG2细胞后,能够有效干预DBP的表达(图1A、B)。CCK-8分析实验证明,DBP过表达和敲低能相应地增加(1.76±0.22 vs. 1.83±0.27,P<0.05)和减少(1.84±0.25 vs. 1.77±0.21,P<0.05)细胞的数量(图1C、D)。
2.2 DBP高表达对细胞E2分泌的影响 结果显示,DBP过表达降低了细胞E2分泌水平[(20.76±3.42)ng/ml vs.(17.23±2.65)ng/ml,P<0.05]。
2.3 维生素K2对肝癌细胞增殖的影响 CCK-8分析结果显示,与对照组(Empty)相比,DBP过表达组HepG2细胞增殖加强(P<0.05),当分别给予不同浓度的VK2(0、1、10、30、50、100 μmol/L)处理48 h后,细胞的增殖呈浓度依赖性降低(P<0.05)(图2 A);用siRNA敲低了DBP的表达后,细胞的增殖明显降低(P<0.05),但是VK2的处理对细胞的增殖影响不大(P>0.05)(图2 B)。
2.4 不同浓度VK2对E2、DBP表达的影响 用不同浓度的VK2(0、20、50、100 μmol/L)处理对照组(Empty)和过表达DBP组的HepG2细胞 48 h后,检测培养基中E2的水平。结果显示,随着VK2剂量的增加,培养基中E2水平也随之增加(P<0.05)(图3 A)。但是用100 μmol/L浓度的VK2分别处理Empty组和过表达DBP 组的HepG2细胞后,DBP蛋白表达无明显变化(图3 B)。
3 讨 论
肝细胞癌作为致死性较高的癌症,在全球约排在第3位,男性患病率高于女性,而观察发现肝细胞癌的发病也与地域性相关,因其预后较差,成为影响人民健康的重要威胁[12]。尽管近年来肝癌切除手术有一定的进展,但是患者的术后生存质量和5年生存率并不高[13]。最初发现VK是在血液凝固的过程中发挥作用,并且有研究报道其对骨骼健康及心血管疾病有积极作用[14]。此外,近年有相关研究表明,维生素K在肿瘤的形成和生长过程中有抑制作用,特别是VK家族中的VK2在肝细胞癌的增殖中表现出抑制作用[15-16]。
注:A.DBP过表达质粒(DBP)转染HepG2细胞Western-bolt检测DBP表达;B.DBP干扰RNA(siDBP)转染HepG2细胞Western-bolt检测DBP表达;C. DBP /Empty质粒转染HepG2细胞后CCK-8检测细胞增殖;D.siDBP/siNC转染HepG2细胞后CCK-8检测细胞增殖有报道显示,维生素K2的类似物四烯甲萘醌不仅可以抑制肝癌的进展,更重要的是能降低肝癌术后的复发率和转移率[4-5]。这些研究结果表明,VK2在HCC的治疗和术后康复中发挥了潜在的抗肿瘤特性。
图1 DBP过表达对肝癌细胞增殖的影响
注:A. DBP过表达质粒/空质粒处理HepG2细胞后加入不同浓度VK2,CCK-8检测细胞增殖;B.siDBP/siNC干扰RNA处理HepG2细胞后加入不同浓度VK2,CCK-8检测细胞增殖
图2 维生素K2对肝癌细胞增殖的影响
注:A. DBP过表达质粒/空质粒处理HepG2细胞后加入不同浓度VK2,放射免疫检测E2水平;B.DBP过表达质粒/空质粒处理HepG2细胞后加入100 μmol/L VK2,Western-bolt检测DBP表达
图3 维生素K2对肝癌细胞中DBP活性的影响
D-双功能蛋白(DBP)是生物组织细胞器过氧化物酶体中极其重要的一种氧化还原酶。DBP在哺乳动物的肝、心脏、脑、前列腺等组织中都有表达。更重要的是DBP可以催化雌二醇(E2)脱氢失去活性,从而产生雌酮[11]。以往研究也发现,人肝癌病理组织中DBP高表达,肝癌HepG2 细胞中DBP表达升高从而降低E2水平表达后,使促癌细胞增殖基因cyclin D1及PCNA等的表达明显升高,而这些最终导致了肝癌细胞的增殖[8-9]。最近有研究发现,合成后的生物素VK2能够与DBP相结合导致DBP活性降低[10]。本实验中,VK2与DBP相互作用降低DBP的活性,进而使细胞内E2的水平显著增加,进而起到了抑制HCC细胞增殖的重要作用。
综上,维生素K2对肝癌细胞增殖有较好的抑制作用。VK2通过与DBP相互作用,降低了DBP的催化活性,升高了E2的表达水平,从而抑制肝癌细胞的增殖。本研究初步阐明VK2通过DBP抑制肝癌细胞增殖的相关机制,为肝癌的诊断和术后联合监测提供新的思路。
利益冲突:所有作者声明无利益冲突
作者贡献声明
路欣:实施研究过程,论文撰写和修改;孔令玉:实施部分实验,分析实验数据,统计学分析;姜玲玲:设计研究思路,论文审核
