改良QuEChERS结合超高效液相色谱-四极杆/静电场轨道阱高分辨质谱法测定果蔬中15种植物生长调节剂残留
2020-02-18
(广西-东盟食品药品安全检验检测中心,广西南宁 530021)
植物生长调节剂(Plant growth regulators,PGRs)是一类天然或合成的用于调节植物生长发育的化合物[1],对农作物起到增产、改善品质、缩短生长周期、延长保鲜期的作用,广泛用于果蔬生产。近年来种植户受利益驱动超范围超剂量使用PGRs的事件屡有发生,如江西果农使用氯吡脲不当导致西瓜裂瓜,“毒豆芽”中添加4-氯苯氧乙酸钠、6-苄基腺嘌呤等,这些事件引起公众和监管部门对植物生长调节剂残留毒性的高度关注。我国将植物生长调节剂纳入农药进行管理,PGRs大部分为高效、低毒、低残留农药,但随着人们对PGRs的逐步深入研究,发现一些残留的植物生长调节剂通过食物链积累和生物放大,造成生殖障碍、性早熟[2],引起肝损害[3],甚至致畸、致突变、致癌[4]。据农药信息网数据统计,我国登记使用的植物生长调节剂共51种,GB 2763-2016《食品安全国家标准 食品中农药最大残留限量》[5]中规定了24种PGRs的最大残留限量,本文研究的15种植物生长调节剂中仅有2,4-二氯苯氧乙酸制定了果蔬中最大残留限量并有配套检测标准,4-氟苯氧乙酸、4-氯苯氧乙酸、6-苄基腺嘌呤、赤霉素、多效唑、氯吡脲、噻苯隆、异戊烯腺嘌呤、吲哚丁酸、吲哚乙酸10种农药规定在豆芽中不允许检出[6],并且有补充检验标准[7]。矮壮素、丁酰肼、氯化胆碱、烯效唑4种农药尚未制定最大残留限量且未指定检测方法,缺失安全控制指标。
植物生长调节剂一般以低浓度存在于复杂基质中,对仪器的灵敏度要求高。用于植物生长调节剂残留的分析方法主要有气相色谱法[8]、高效液相色谱法[9]、色谱-质谱联用法[10-11]。色谱法作为曾经的主流分析技术,定性能力与抗干扰能力不足,无法应对多残留分析的挑战。色谱-质谱联用技术因其快速准确、高灵敏度以及能够同时检测多种目标化合物而逐渐成为农药多残留分析的主流方法。低分辨质谱如色谱-三重四级杆质谱分辨力不足,容易受同位素离子干扰,局限于分析靶向性化合物。高分辨率质谱技术能够提供高分辨率、精确相对分子量、全扫描灵敏度以及高选择性,推动了靶向性和非靶向性化合物的筛查技术迅速发展[12],如飞行时间质谱和静电场轨道阱质谱。飞行时间质谱对电场的稳定性要求极高,仪器的质量准确度受环境温度影响较大[13]。特别是后者将四级杆与静电场轨道阱相结合,提高了高分辨质谱的定量能力[14],且操作简单,易于维护,目前广泛应用于代谢组学、复杂基质中农药多残留分析。
植物生长调节剂在植物体内经过代谢后残留量低,植物中糖、色素、有机酸等基质干扰目标化合物的检测,样品需进行提取、净化及富集,提高方法灵敏度。目前PGRs前处理方法有固相萃取[15]、基质固相分散萃取[16]、分子印迹固相萃取[17]、多壁碳纳米管固相萃取[18]、磁固相萃取[19]和QuEChERS方法[20-21],其中经典的QuEChERS方法采用有机溶剂提取、无水硫酸镁和氯化钠盐析分层、N-丙基乙二胺(PSA)固相萃取剂净化水果、蔬菜样品。多壁碳纳米管(MWCNTs)为新型纳米固相萃取材料[22],因其独特的中空结构和大比表面积而具有卓越的吸附能力[23],本实验以MWCNTs替代PSA吸附水果和蔬菜基质中的干扰物质。
本文以韭菜、番茄、豆芽、葡萄、柑橘为样品基质,采用改良的QuEChERS方法提取净化样品,结合超高效液相色谱/静电场轨道阱高分辨质谱(UPLC-Q-Orbitrap HRMS)技术建立15种植物生长调节剂的测定方法,并对市售100批水果蔬菜中PGRs进行快速筛查,以期为果蔬中植物生长调节剂风险筛查提供技术支撑。
1 材料与方法
1.1 材料与仪器
甲醇、乙腈、甲酸 色谱纯,德国默克公司;无水硫酸镁、乙酸、甲酸铵 分析纯,北京化工厂;N-丙基乙二胺(PSA)、石墨化炭黑(GCB) 天津博纳艾杰尔科技有限公司;多壁碳纳米管(MWCNTs、长度10~30 μm,外径10~20 nm,内径5~10 nm,纯度>95%,比表面积>200 m2/g) 南京先丰纳米材料科技有限公司;QuEChERS提取盐包(含6 g无水硫酸镁和1.5 g无水乙酸钠) 美国waters公司;标准物质:2,4-二氯苯氧乙酸、4-氟苯氧乙酸、4-氯苯氧乙酸、6-苄基腺嘌呤、矮壮素、赤霉素、丁酰肼、多效唑、氯吡脲、氯化胆碱、噻苯隆、烯效唑、异戊烯腺嘌呤、吲哚丁酸、吲哚乙酸 ,纯度均大于99%,德国Dr. Ehrenstorfer Gmbh公司;样品共100批,韭菜、番茄、芹菜、黄瓜、葡萄、柑橘各10批,豆芽40批 采集于广西各地农贸市场与超市、水果蔬菜种植基地;将样品切碎后用组织粉碎机充分粉碎混匀,别装入洁净容器中,密封并标记,于-18 ℃保存备用。
Ultimate 3000超高效液相色谱仪 美国Dionex公司;串联Q Exactive高分辨质谱仪 配备加热电喷雾离子源(HESI-Ⅱ源),美国Thermo Fisher Scientific公司;X3R高速冷冻离心机 美国Thermo Fisher Scientific公司;XS205 DU电子天平 瑞士梅特勒-托利多公司;Vortex 3涡旋振荡器 德国IKA公司;Multi Reax全自动振荡仪 德国Heidolph;Multivap氮吹仪 美国Organomation公司;Milli-Q超纯水器 美国Millipore公司。
1.2 实验方法
1.2.1 样品提取与净化 称取10 g(精确至0.01 g)经粉碎混匀的样品,置于50 mL聚丙烯离心管中,加入1%乙酸乙腈溶液10 mL,涡旋1 min,加入提取盐包,剧烈振荡2 min后4 ℃ 5000 r/min离心5 min,吸取1.5 mL上清液至内含10 mg MWCNTs及200 mg硫酸镁的15 mL离心管中,涡旋混匀2 min,4 ℃ 10000 r/min离心5 min,精密吸取1 mL上清液于10 mL离心管中,40 ℃水浴中氮气吹至近干,加乙腈定容至1 mL,用微孔滤膜(0.22 μm)过滤,取续滤液,测定。
1.2.2 标准溶液的配制 准确称取15种标准物质各10 mg(精确至0.1 mg),分别置于10 mL量瓶中,用乙腈溶解并定容至刻度,配制成1 mg/mL的标准储备溶液。分别精密量取各标准储备溶液1 mL,置于同一100 mL量瓶中,用乙腈稀释并定容至刻度,得到10 μg/mL混合标准中间溶液。精密量取混合标准中间溶液各1 mL,分别置于10、100 mL量瓶中,用乙腈稀释并定容至刻度,分别得到1、100 μg/L混合标准溶液。
取韭菜、番茄、芹菜、黄瓜、葡萄、柑橘、豆芽空白样品(阴性样品),每份10.00 g,与1.2.1同法操作,得到空白基质溶液。分别取0.02、0.05 mL(浓度为100 μg/L)、0.01、0.02、0.05、0.1、0.5 mL(浓度为1 μg/mL)混合标准溶液至1 mL量瓶中,用空白基质溶液稀释成2.0、5.0、10. 0、20. 0、50.0、100. 0、500.0 μg/L的基质混合标准工作溶液。
1.2.3 色谱条件 Hypersil GOLD aq C18柱(2.1 mm×100 mm,1.9 μm);柱温:30 ℃;进样体积:5 μL;流速:0.5 mL/min;流动相:A为含0.1%甲酸的5 mmol/L甲酸铵溶液,B为乙腈。梯度洗脱程序:0~0.5 min,5% B;0.5~10 min,5%~95% B;10.0~12.0 min,95% B;12.0~15.0 min,5% B。
1.2.4 质谱条件 UPLC-Q-orbitrap液质联用仪配加热的电喷雾电离(HESI-Ⅱ);鞘气流速为45 arb;毛细管温度为 320 ℃;喷雾电压正离子为3.1 kV、负离子为2.75 kV;采用全扫描/数据依赖的二级子离子扫描(Full MS/dd-MS2);正、负离子模式;一级扫描参数:扫描范围为50~500 u,分辨率为70000,最大注入时间为 100 ms,控制目标离子数为3×106;二级扫描参数:分辨率为17500,二级为5×105,最大注入时间一级为50 ms,控制目标离子数为5×105;归一化碰撞能量为20%、40%、60%。
1.3 数据处理
对15种化合物进样测定获得其精确质量数、同位素、保留时间、二级碎片,通过Trace Finder数据处理系统建立15种化合物的数据库。
2 结果与分析
2.1 色谱条件的优化
流动相是影响色谱分离一个重要因素,液相色谱柱中化合物的保留不仅受到流动相的影响,还受到改性剂的影响。基于乙腈离子化能力强于甲醇,且基线噪音较低,故首选乙腈作为有机相。本实验重点考察纯水和0.1%甲酸、5 mmol/L甲酸铵、0.1%甲酸5 mmol/L甲酸铵溶液三种流动相改性剂对目标化合物的分离效果、峰形和响应强度的影响(图1),发现在纯水系统中,4-氯苯氧乙酸、矮壮素、吲哚丁酸、吲哚乙酸峰形和分离效果差,赤霉素峰分裂。在0.1%甲酸溶液中,抑制了[M-H]-离子,2,4-二氯苯氧乙酸、4-氯苯氧乙酸、4-氟苯氧乙酸、赤霉素响应低。在5 mmol/L甲酸铵溶液中,抑制了[M+H]+离子,矮壮素、丁酰肼、多效唑、吲哚丁酸、吲哚乙酸响应强度低。在5 mmol/L甲酸铵溶液中添加0.1%甲酸,提高电离效率,稳定离子,矮壮素、吲哚乙酸、吲哚丁酸、赤霉素峰形得到改善,4-氯苯氧乙酸、多效唑形成尖锐的峰形。综上,选择乙腈和含0.1%甲酸5 mmol/L甲酸铵作为流动相。15种PGRs(浓度为100.0 μg/L)提取离子流色谱图见图1。
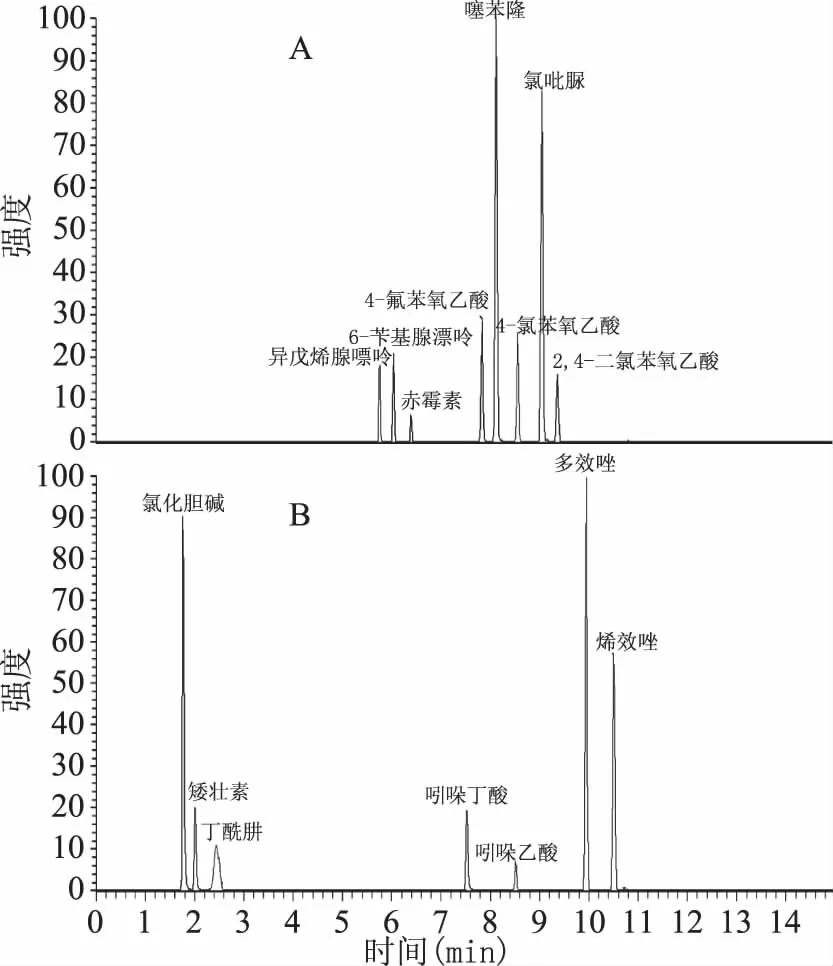
图1 15种植物生长调节剂的提取离子流色谱图Fig.1 Extracting ion chromatograms of 15 plant growth regulators注:A为正离子模式;B为负离子模式。
2.2 质谱条件的优化
取100.0 μg/L的15种化合物混合标准溶液注入质谱,采用Full MS/dd-MS2 模式进行数据采集,Full MS定量,dd-MS2定性,分析15种农药的分子离子峰[M+H]+和[M-H]-精确质量数。根据欧盟委员会卫生和食品安全总局(2017)的SANTE文件的指导原则,高分辨质谱确证识别点至少为4[24],本实验每种化合物选择一个母离子和一个子离子,识别点为4.5,满足检测要求。首先在50~500 u扫描范围内获得全扫描数据,将获取母离子质量数列入包含列表(inclusion list)中,缩小扫描范围,使目标化合物得到尽可能多的数据点,避免产生假阴性结果。当全扫描监测到列表里的母离子且信号超过设定值,母离子以20%、40%和60%的阶梯式碰撞能量进行二级碎裂,从而获取碎片离子信息。分辨率和质量数偏差是高分辨质谱两个重要参数,分辨率高、质量数偏差小,选择性高,易造成假阴性结果;分辨率低、质量数偏差大,易产生假阳性结果,因此15种化合物的一级、二级分辨率分别设置为70000、17500,表1列出了15种化合物分子式、保留时间、质量数偏差等参数。

表1 15种植物生长调节剂的分子式、保留时间和母离子Table 1 Molecular formula,retention time,precursor ions of 15 plant growth regulators
2.3 提取溶剂的选择
本实验首先对提取溶剂进行优化,基于所分析的目标化合物均为极性物质,选择韭菜样品,分别考察甲醇、乙腈和含1%乙酸乙腈溶液提取效果,甲醇提取时,发现大部分化合物回收率高于130%,应该是甲醇共提物中极性杂质成分较多引起基质效应增强所致;比较乙腈与含1%乙酸乙腈溶液回收率,后者普遍高于前者,特别是含羧酸化合物回收率都在75%~109%,说明乙腈中加入一定量的酸,形成稳定的缓冲体系,利于酸性化合物的离子化,因此选择1%乙酸乙腈作为最佳提取溶剂。
2.4 吸附剂的选择
果蔬中基质干扰多为脂类、色素、糖、有机酸等,本实验考察N-丙基乙二胺(PSA)、石墨化炭黑(GCB)、多壁碳纳米管(MWCNTs)3种吸附剂的净化效果。PSA去除有机酸、糖类、脂肪酸,GCB去除色素和甾醇,MWCNTs去除色素能力强[25]。选择韭菜(富含硫化物和叶绿素)为基质,考察色素去除效果和回收率,取1.5 mL提取液分别单独加入100、200 mg PSA和5、10、15、20 mg GCB、MWCNTs,色素去除效果MWCNTs>GCB>PSA,结果见图2,随着MWCNTs用量的增加,提取液基本接近无色,说明MWCNTs对色素有较强的吸附作用。采用200 mg PSA,2,4-二氯苯氧乙酸、赤霉素、4-氟苯氧乙酸等酸性化合物和矮壮素、丁酰肼等强极性化合物回收率普遍低于60%,与PSA为极性吸附剂和对酸性化合物有吸附作用有关。GCB使用量为20 mg时,4-氟苯氧乙酸、4-氯苯氧乙酸等具有平面结构化合物回收率均低于35%~70%,这是由于GCB具有正六元环结构,易吸附平面结构化合物[26]。MWCNTs加入量为20 mg时,平面结构化合物回收率在57%~89%,说明MWCNTs具有中空结构对平面化合物吸附较弱,当MWCNTs添加量为10 mg时,化合物回收率在71%~109%,满足检测要求,综合考虑只采用10 mg MWCNT作为吸附剂。

图2 韭菜经不同种类吸附剂净化后提取液的照片Fig.2 Photography of cleanup performance of extract for leek with different sorbents注:A~B:200、100 mg PSA;C~F:5、10、 15、20 mg GCB;G~J:5、10、15、20 mg MWCNTs。
2.5 基质效应
基质效应(Matrix Effect,简称ME)普遍存在痕量分析的物质中,影响检测结果的准确性[27],根据基质成分对目标化合物响应强度的不同影响,基质效应分为基质增强和基质抑制效应。实验采用韭菜、豆芽空白基质标准曲线与乙腈为溶剂标准曲线的比值评价ME,当ME介于0.9~1.1时,基质干扰程度较低;当ME<0.9或>1.1时,为基质抑制或增强。表2结果表明大部分化合物存在基质效应,因此本实验采用基质匹配校准曲线定量,以消除基质对检测结果造成的误差。
2.6 线性范围和定量限
以基质混合标准工作溶液进样测定,用外标法定量,以峰面积为纵坐标(y)、质量浓度为横坐标(x,μg/L),15种目标化合物在2.0~500.0 μg/L的浓度范围内线性关系良好,r均大于0.990,见表2。基于高分辨质谱的色谱图中通常不存在背景噪音,检出限(LOD)和定量限(LOQ)的计算不宜采用信噪比的方法,将回收率在70%~120%范围内且RSD<20%的最低加标水平定为方法的定量限[11,24],15种目标化合物中吲哚乙酸、赤霉素LOQ为20.0 μg/kg,其余13种化合物LOQ均为10.0 μg/kg。
2.7 回收率与精密度
以韭菜、豆芽为基质,取10.00 g样品,置于50 mL聚丙烯具塞离心管中,分别添加0.01、0.05、0.1 mL的混合标准溶液(1 μg/mL),加入1%乙酸乙腈溶液至10 mL,其余按1.2.1方法操作,进行低、中、高3个浓度水平的加标回收试验,每个添加水平测定6次,平均回收率为69.8%~107.2%,相对标准偏差为1.4%~9.9%,结果见表3。
2.8 实际样品的测定
采用本方法对韭菜、番茄、芹菜、黄瓜、葡萄、柑橘、豆芽共100批样品测定15种植物生长调节剂,结果16批豆芽检出4-氯苯氧乙酸钠,含量在0.032~0.24 mg/kg,根据国家食品药品监督管理总局、农业部、国家卫生和计划生育委员会关于豆芽生产过程中禁止使用6-苄基腺嘌呤等物质的公告(2015年第11号)[6],豆芽不允许检出6-苄基腺嘌呤、4-氯苯氧乙酸钠、赤霉素等物质,本实验同时按照SN/T 3725-2013 《出口食品中对氯苯氧乙酸残留量的测定》标准方法测定,本方法与其他方法的相对标准偏差为1.2%~9.8%,说明本方法准确可靠。

表2 15种植物生长调节剂基质效应、线性范围、相关系数Table 2 Matrix effect,linear ranges,correlation coefficients(r)of the 15 plant growth regulators
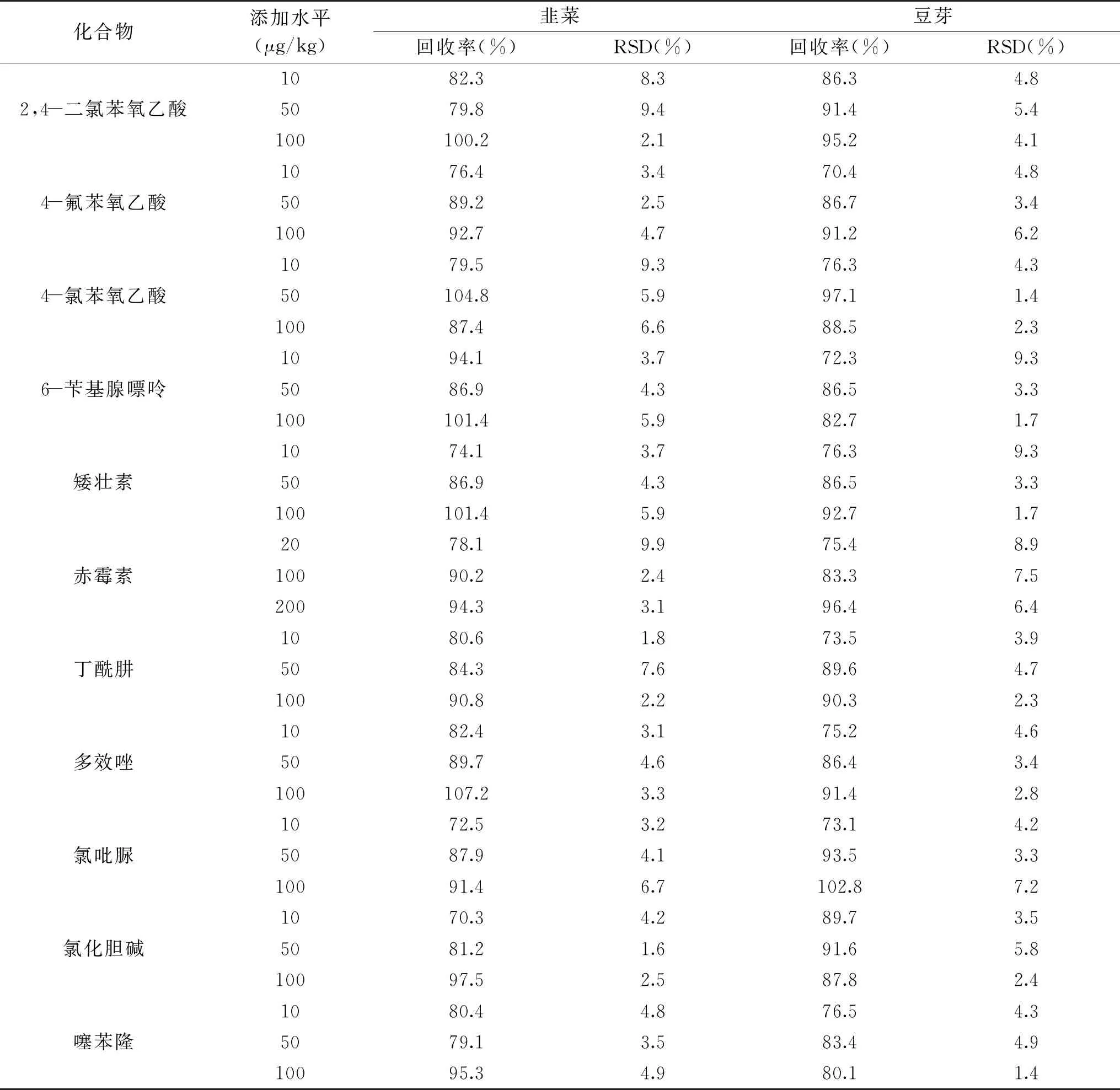
表3 15种植物生长调节剂的加标回收率和相对标准偏差(n=6)Table 3 Recovery rates and RSD of the 15 plant growth regulators(n=6)
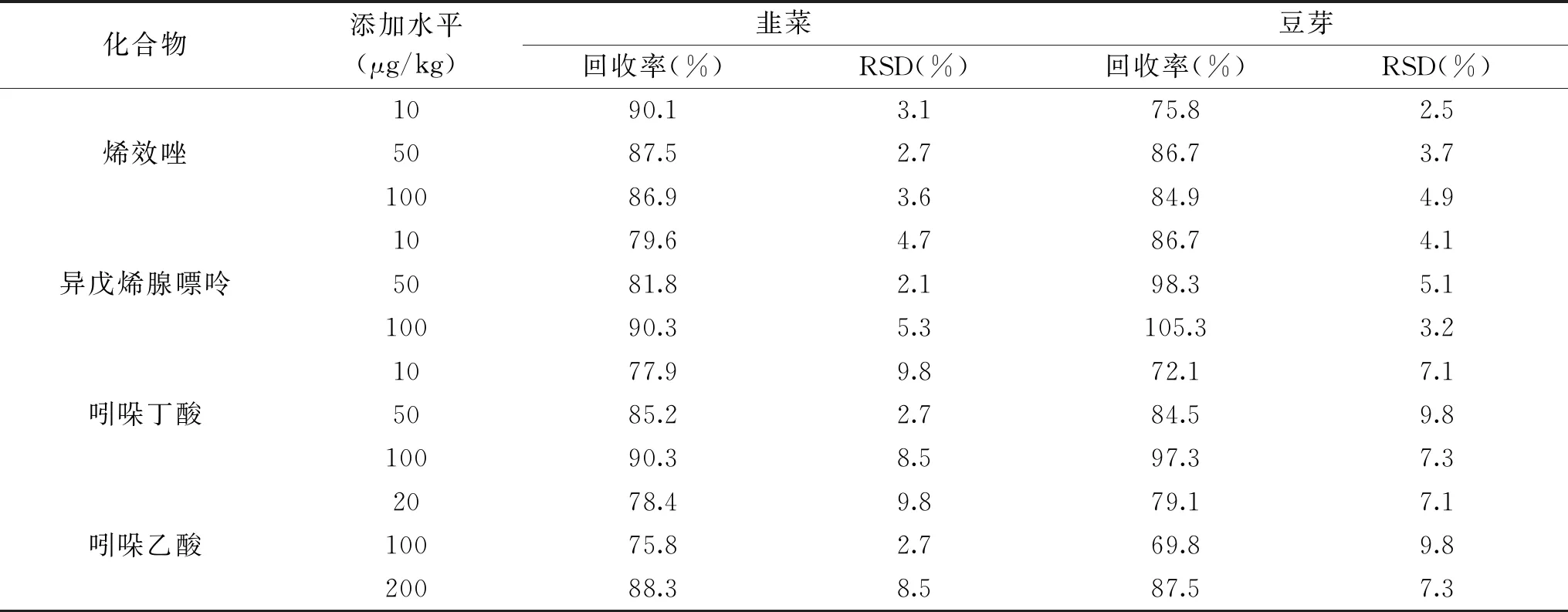
续表
3 结论
本研究建立了以1%乙酸乙腈为提取剂、多壁碳纳米管为吸附剂的改良QuEChERS方法,结合超高效液相色谱-四级杆/静电场轨道阱高分辨质谱法对100批韭菜、番茄、芹菜、黄瓜、葡萄、柑橘、豆芽中的15种PGRs残留量进行测定,其中16批豆芽检出4-氯苯氧乙酸钠,且残留量超出标准规定,表明果蔬中植物生长调节剂存在一定的食品安全风险。该方法简便快速、灵敏度高,能够满足果蔬中的植物生长调节剂日常检测和风险筛查要求。
