天麻素对甲基苯丙胺诱导的神经元毒性损害的保护作用
2020-02-18闫倩文石振金张枫弋周一卿黄兆奎王一航张冬先洪仕君李利华
闫倩文,石振金,张枫弋,周一卿,黄兆奎,王一航,张冬先,洪仕君,李利华
(昆明医科大学法医学院,云南 昆明 650500)
甲基苯丙胺(methamphetamine,MA)的滥用给人体健康和社会安定造成了极大地危害。目前,MA滥用人员呈低龄化趋势,严重危害青少年身体健康。褪黑素(melatonin,MT)可通过调控下丘脑视上核交叉的冲动发放频率来改善睡眠,具有抗氧化应激,保护线粒体,抗凋亡,还有调节免疫、抑制肿瘤生长、延缓衰老、降血压及镇痛等多重功效[1]。大量研究结果提示,MT可以缓解MA诱导的神经毒性损害。MT可通过降低MA介导的氧化应激起到保护作用,此外它还可以维持线粒体的稳态、降低神经炎症因子等的表达[2]。体内研究表明,MT可以对抗MA暴露导致的高热、多巴胺降低以及多巴胺转运体的减少[3]。
天麻素(gastrodin,GAS)是云南特有植物药物天麻最主要的活性成分。临床上多用于治疗头晕、神经退行性疾病等。本课题组此前致力于研究天麻素在毒品戒断方面的作用并取得初步研究结果[4-5]。本研究选取众多研究确认对MA诱导的神经毒性损害有保护作用的MT作为阳性对照,探讨天麻素对MA诱导的神经毒性损害的保护作用及其效果,为毒品戒断治疗药物的筛选提供新的依据。
1 材料与方法
1.1 药品与试剂盐酸甲基苯丙胺由云南公安刑事科学技术研究所合法提供,配制成10 g·L-1(53.85 mmol·L-1)溶液(生理盐水稀释),过滤除菌,4 ℃保存。天麻素由生物医学研究工程中心陆地教授赠予,配制成10 g·L-1(33.86 mmol·L-1)溶液(生理盐水稀释),过滤除菌,4 ℃保存。MT(Meilunbio 公司,MB1475-S),用二甲基亚砜(dimethyl sulfoxide,DMSO)溶解为20 g·L-1,-20 ℃避光保存。聚-L-赖氨酸 氢溴酸盐(Sigma公司,P2636);DMEM培养基(Biological Industries公司,01-050)、胰酶(Biological Industries公司,03-050);神经元培养基、B27 supplement、胎牛血清、双抗、谷氨酰胺(Gibco公司);DMSO(Solarbio公司,D8370),DNA酶(Solarbio公司,D8071),细胞增殖-毒性检测试剂盒(Cell Counting Kit-8, CCK-8)(Biosharp公司,BS350B);细胞凋亡检测试剂盒(Roche公司,11684795910);含半胱氨酸的天冬氨酸蛋白水解酶3(cysteinyl aspartate specific proteinasecysteinyl aspartate specific proteinase-3, caspase-3)抗体(兔抗,1 ∶200,Proteintech公司,19677-1-AP); 神经元标志物(the class III β tubulin specific antibody, Tuj1)(鼠抗,1 ∶200,Proteintech公司,66375-1-Ig);荧光二抗(DyLight 488, Goat anti-mouse IgG 1 ∶500,Abbkine 公司,A23210);荧光二抗(Dylight 594, Goat anti-rabbit IgG,1 ∶500,Abbkine 公司,A23420)。
1.2 实验动物SPF级24 h内新生SD大鼠,购于昆明医科大学实验动物中心,合格证号:SCXK(滇)K2015-0002。
1.3 实验仪器超净台(Thermo scientific公司),二氧化碳培养箱(Thermo scientific公司),倒置显微镜(Leica公司),全波长酶标仪(Thermo公司),荧光显微镜(Leica公司)。
1.4 方法
1.4.1细胞培养 取SPF级24 h内新生SD大鼠,75%冷乙醇浸泡3~5min无菌条件下断颈处死,取脑,显微镜下剥离脑膜,夹取皮质组织,剪碎,胰酶37 ℃消化10 min,终止消化后过滤,离心,加适量培养基重悬制成细胞悬液,细胞计数,按既定浓度接种于培养板,放入细胞培养箱培养4 h后换神经元培养基,3 d后给药。
1.4.2不同浓度MA对皮质神经元活性的影响 细胞以4×105~5×105的接种密度接种于96孔板,培养72 h后加不同浓度MA溶液(0 mmol·L-1、0.125 mmol·L-1、0.25 mmol·L-1、0.5mmol·L-1、1 mmol·L-1、2 mmol·L-1)分别处理24 h,每组3个复孔。弃掉培养基,每孔加90 μL神经元培养基和10 μL CCK-8混合液,温箱孵育2 h后测定细胞活力值。用全波长酶标仪测量波长450 nm的吸光度值,检测不同浓度的MA对神经元活性的影响。
1.4.3不同浓度GAS对MA诱导的皮质神经元毒性损害的保护作用 皮质神经元培养3 d后,加不同浓度GAS(0 mg·L-1、12.5 mg·L-1、25 mg·L-1、50 mg·L-1、100 mg·L-1)分别处理2 h后,再给MA最佳给药浓度作用24 h,每组3个复孔。用CCK-8试剂盒检测细胞活力值,确定最佳干预浓度。
1.4.4不同浓度MT对MA诱导的皮质神经元毒性损害的保护作用 皮质神经元培养3 d后,加不同浓度MT(0、0.1、1、10、100 μmol·L-1),分别处理2 h后,再给MA最佳给药浓度24 h。用CCK-8试剂盒检测细胞活力值,确定最佳干预浓度。
1.4.5细胞免疫荧光技术、DNA断裂的原位末端标记法(terminal dexynucleotidyl transferase(TdT)-mediated dUTP nick end labeling, TUNEL)检测细胞凋亡 培养细胞3 d后,随机分为对照组、0.5 mmol·L-1MA组、25 mg·L-1GAS+0.5 mmol·L-1MA组、10 μmol·L-1MT+0.5 mmol·L-1MA组,每组3个复孔。弃掉培养基,用PBS洗涤3次×3 min;加1ml 4%多聚甲醛溶液固定15 min,然后滴加PBS 3次×3 min。取出爬片置于载玻片上,滴加含5%羊血清0.3%Triton的PBS(0.01mol·L-1)封闭液100 μL,37 ℃孵育30min;弃掉封闭液,滴加一抗(Tuj1抗体1:200,Caspase-3抗体1 ∶200),4 ℃过夜。PBS漂洗3次×3 min;避光加入二抗(1 ∶500)和TUNEL反应混合液,37 ℃避光孵育1 h;漂洗3次×3 min;滴加含DAPI的抗荧光淬灭剂进行细胞核染色,室温孵育3 min;将玻片倒扣在载玻片上,荧光显微镜观察结果。
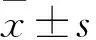
2 结果
2.1 各实验组细胞活力值测定MA给药组细胞活力值如Fig 1A所示,与对照组相比,0.5 mmol·L-1MA组、1 mmol·L-1MA组、2 mmol·L-1MA组细胞活力显著降低(P<0.01);0.5mmol·L-1MA组与0.125 mmol·L-1MA、0.25 mmol·L-1MA组相比皮质神经元细胞活力显著降低,差异有统计学意义(P<0.01);1 mmol·L-1MA组、2 mmol·L-1MA组细胞活力比0.5 mmol·L-1MA组显著降低,差异有统计学意义(P<0.05或P<0.01);据此确定MA最佳给药浓度为0.5 mmol·L-1。
GAS+MA组细胞活力值如Fig 1B所示,与0.5 mmol·L-1MA组相比,25 mg·L-1GAS+0.5 mmol·L-1MA组细胞活力值显著上升(P<0.01);故选取25 mg·L-1作为GAS最佳干预浓度。
MT+MA组细胞活力值如Fig 1C所示,与0.5 mmol·L-1MA组相比,10 μmol·L-1MT+0.5 mmol·L-1MA组细胞活力值明显上升(P<0.05);故选取10 μmol·L-1作为MT最佳干预浓度。
2.2 不同实验组的细胞形态改变
2.2.1不同MA剂量给药组细胞形态改变 如Fig 2所示,随着MA浓度增加,皮质神经元胞体逐渐皱缩,出现空泡化,甚至死亡;突触也逐渐变短消失。当MA浓度为2 mmol·L-1时,细胞几乎全部死亡,突触消失。
2.2.2不同剂量GAS+MA给药组细胞形态改变 如Fig 3所示,与对照组比较,MA组细胞数目减少,突触变细小、断裂;不同剂量天麻素干预后,有细胞形态呈不同程度改善。

Fig 1 Cell viability value of different experimental groups

2.2.3不同剂量MT+MA给药组的细胞形态改变 如Fig 4所示,与对照组比较,MA组细胞皱缩,数目减少,突触变短;不同剂量MT干预后细胞形态呈不同程度改善。

Fig 2 Morphological changes of cortical neurons after 24 h treatment with different concentrations of MA
A: Control group; B: 0.125mmol·L-1MA group; C: 0.25mmol·L-1MA group; D: 0.5 mmol·L-1MA group; E: 1mmol·L-1MA group; F: 2 mmol·L-1MA group. The arrow showed typical morphological changes of cortical neuron.
2.3 细胞凋亡率检测细胞凋亡率检测结果如Fig 5、6所示,与对照组相比,MA组TUNEL染色阳性细胞显著增多(P<0.01);GAS+MA组和MT+MA组的TUNEL染色阳性细胞比MA组显著减少(P<0.01);GAS+MA组和MT+MA组TUNEL染色阳性细胞经过计数和统计学处理,差异无统计学意义。说明对MA诱导皮质神经元细胞凋亡的干预影响,天麻素可达到与MT一样的干预效果。
2.4 各实验组Caspase-3的表达与对照组比较,MA组Caspase-3表达明显增强;GAS+MA组和MT+MA组Caspase-3均比MA组明显降低。Caspase-3染色阳性细胞,经过计数和统计学处理,差异无统计学意义。提示天麻素对MA诱导的皮质神经元细胞凋亡具有缓解作用,效果与MT相当(Fig 7)。
3 讨论
已有的研究表明,MA可以导致多巴胺和5羟色胺能神经元终末端的损伤,轴突末端可发生肿胀、歪曲、退化等形态学改变;MA还可以导致细胞死亡,在额叶皮质、纹状体、海马等部位均检测出细胞凋亡[6]。研究表明,氧化应激和线粒体功能障碍可能导致MA诱导的多巴胺能神经元细胞凋亡[7]。本研究选取检测凋亡的TUNEL法染色和提示细胞凋亡的指标Caspase-3,比较天麻素和MT的干预效果。
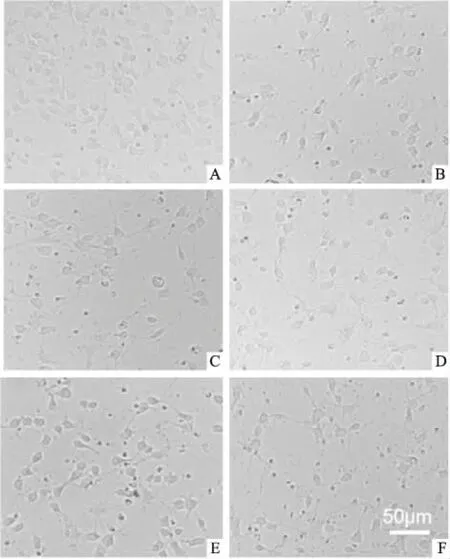
Fig 3 Morphological changes of cortical neurons with different concentrations of gastrodin pre-treatment of 2 h and post-treatment of MA (0.5 mmol·L-1) for 24 h
A: Control group; B: 0.5 mmol·L-1MA group; C: 12.5 mg·L-1GAS+0.5 mmol·L-1MA group; D:25 mg·L-1GAS+0.5mmol·L-1MA group; E: 50 mg·L-1GAS+0.5 mmol·L-1MA group; F: 100 mg·L-1GAS+0.5 mmol·L-1MA group.
研究结果提示,随着MA浓度增加,皮质神经元胞体逐渐萎缩,有的可见空泡样结构,突触逐渐变细、回缩、断裂,消失。当MA浓度为2 mmol·L-1时,视野中细胞胞体几乎全部失去原有正常形态,胞体萎缩、死亡,突触消失。说明MA对皮质神经元已经造成明显毒性损害作用。通过不同梯度浓度干预细胞后,检测发现神经元的活力值与MA作用浓度呈负相关,MA浓度为0.5 mmol·L-1时,可对皮质神经元造成近半数致死的毒性损害。
MA在小鼠模型中可诱导神经元发生固缩、变性、坏死等病变,其程度与剂量和作用时间紧密相关[8]。MA的神经毒性虽已被公认,但其作用机制研究尚不明确,已有的研究结果主要涉及细胞凋亡、自噬、谷氨酸兴奋性毒性、能量代谢、突触可塑性、氧化应激等方面。

Fig 4 Morphological changes of cortical neurons with different concentrations of melatonin pre-treatment of 2 h and post-treatment of MA (0.5 mmol·L-1) for 24 h
A: Control group; B: 0.5 mmol·L-1MA group; C: 0.1 μmol·L-1MA+0.5 mmol·L-1MA group; D: 1 μmol·L-1MA+0.5 mmol·L-1MA group; E: 10 μmol·L-1MA+0.5 mmol·L-1MA group; F: 100 μmol·L-1MA+0.5 mmol·L-1MA group.
MT的神经保护作用机制也涉及多个方面。线粒体氧化损伤和蛋白激酶Cδ(一种蛋白激酶C家族亚型)过度表达,促成甲基苯丙胺诱导的多巴胺能变性,MT对MA介导的线粒体负荷(功能障碍)、氧化应激、促凋亡的保护作用和蛋白激酶Cδ有关[9]。还有研究发现,MA作用于血脑屏障引起炎症反应而产生神经毒性,MT可以通过作用于MT受体,对MA介导的血脑屏障炎症反应起到保护作用[10]。体内实验研究表明,在小鼠MA依赖的模型中,丝裂原活化蛋白激酶(MAPK)信号通路的活性降低,N-甲基-D-天冬氨酸(NMDA)受体亚基NR2A和NR2B以及钙/钙调蛋白依赖性蛋白激酶II(CaMKII)表达改变,经过MT预处理后,可以减弱上述变化促进细胞增殖,实验中发现ERK信号通路的活性下降[11],课题组也正在开展相关的研究工作。Kongsuphol等[12]研究发现,MA抑制了哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)的磷酸化以及下游靶蛋白的表达,MT预处理可以增强mTOR活性及其下游蛋白4E结合蛋白-1(eukaryotic trans-lation initiation factor 4E-binding protein 1,4EBP1)的活性,这也是我们后续研究跟进的方向。

Fig 5 Effects of gastrodin and melatonin pre-treatment for 2 h on cortical neuron apoptosis induced by MA treatment for 24 h
A: Control group; B: MA group; C:Gastrodin 25 mg·L-1+0.5 mmol·L-1MA group; D: Melatonin10 μmol·L-1+0.5 mmol·L-1MA group. DAPI (blue) staining showed the nucleus, Tuj1 (green) staining showed the cortical neuron cell, and TUNEL (red) staining showed the apoptotic cells.

Fig 6 Comparison of TUNEL staining positive cells of different experimental n=3)
**P<0.01vscontrol group,##P<0.01 MA group
本研究中,在MA给药前2 h细胞用不同浓度的天麻素和MT分别预处理干预,再给药MA作用24 h,发现天麻素和MT预处理后的神经元细胞活力有不同程度改善。天麻素干预组天麻素浓度为25 mg·L-1时细胞活力改善较明显;MT干预组MT浓度为10 μmol·L-1时细胞活力改善最明显,与先前报道的研究结果相一致[13]。在细胞凋亡实验中,与对照组相比,MA组TUNEL阳性细胞增多(P<0.01);与MA组相比,天麻素组、MT组TUNEL阳性细胞均减少(P<0.01)。与褪黑素组比较,天麻素组TUNEL阳性细胞计数差异无统计学意义,提示天麻素对MA介导细胞凋亡起到保护作用,且作用效果与MT相当。与对照组相比,MA组Caspase-3表达显著增强,与先前的研究报道MA可以增强Caspase-3的活性表达结果一致[14];经天麻素预处理干预后,可减弱MA诱导的Caspase-3表达增强。
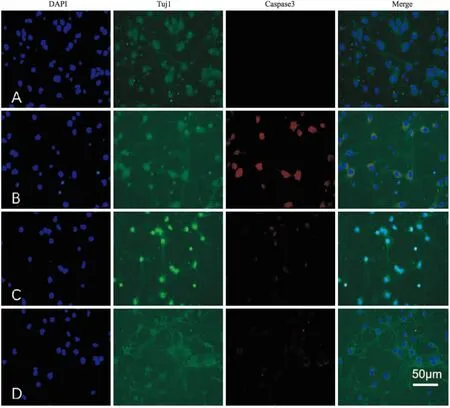
Fig 7 Effects of gastrodin and melatonin pre-treatment of 2 h on expression of caspase-3 in cortical neurons treated with MA for 24 h
A: Control group; B: 0.5 mmol·L-1MA group; C:GAS 25 mg·L-1+0.5mmol·L-1MA group; D: MA 10 μmol·L-1+0.5 mmol·L-1MA group. DAPI (blue) staining showed the nucleus, Tuj1 (green) staining showed the cortical neuron cell, and caspase-3 (red) staining showed the apoptotic cells.
结合文献报道,我们初步分析天麻素对MA诱导的神经毒性的干预机制。课题组先前的研究结果表明,天麻素可以减弱MA诱导SH-SY5Y细胞的自噬,且这种机制可能与Akt/mTOR信号通路有关[5]。天麻素还可以通过降低大鼠星形胶质细胞的活化,降低白介素-6(IL-6)、肿瘤坏死因子α(TNF-α)等炎性因子的表达改善MA导致的神经功能损害[4]。此外,韩学超等[15]研究提示,天麻素可抑制心肌细胞发生氧化应激损伤,最终通过减少凋亡来发挥一定的抗氧化应激损伤的作用。但是确认天麻素干预MA诱导的神经毒性损害机制是否与氧化应激有关,需要更多的证据来证实。
MA介导的神经毒性机制较为复杂,戒断干预研究也尚在初期阶段,本研究通过天麻素干预,发现天麻素对MA诱导的神经元凋亡有明显的改善作用,提示天麻素对MA诱导的神经毒性损害有一定的干预效果,具体作用机制有待深入研究。
