CART治癌大突破
2020-02-16程辉赵倩莹舒婷
程辉 赵倩莹 舒婷
美国年轻妇女碧儿瑟患有恶性淋巴瘤。因为传统放化疗等疗法对她无效,医生向她建议了一种可能适合她、2017年以后才在美国获准使用的新疗法——CART疗法。该疗法有一定风险,甚至可导致死亡。这可能是拯救她的最后手段,因此她同意接受该疗法。
在接受疗法仅几小时后,碧儿瑟的后腰部开始疼痛。她自述这种疼痛就像是经期疼痛。两天后,她的体温升高到38.9℃,血压骤降。不出医生所料,她出现了该疗法的典型副作用之一——细胞因子释放综合征。医生立即用药治疗她。当她的生命体征平稳后,护士每天都要她回答一些简单问题,并让她写几个简单句子,以确保她没有发生神经中毒。此后几天,她看来还算正常。但在治疗后第五天,她在回答护士提问时开始胡言乱语,且她坚信自己回答正确。
随后,碧兒瑟的情况急剧恶化,她开始不停地胡言乱语。很快,她就无法说出一些日常生活用品的名称,也不知道自己身在何处。到她停止胡言乱语时,她双眼无神,进而癫痫发作、四肢颤抖并尿湿病床。医生为她注射抗癫痫药物,并在她喉部插管以帮助呼吸。但药物似乎无效,癫痫依然厉害的碧儿瑟被强制捆绑、固定在病床上。此后她陷入昏迷。谁也没想到的是,第二天傍晚她竟奇迹般地醒了过来,甚至能自主呼吸!
碧儿瑟醒来后环顾病房,却不清楚自己身在何处,也不知道自己是谁。几天后,她终于能开口说出简单句子,说出自己的名字并认出朋友。就这样,她重新找回了生命。出院后,因双脚仍会颤抖,碧儿瑟需要搀扶才能走动。她一度会把陌生人当成熟识的朋友,还说自己见过某种根本不存在的虫子,也无法握稳汤勺或饭碗。但现在,除了端咖啡杯的手仍然颤抖,说话还不算利索,可以说她基本上已恢复正常。她又回到了单口相声表演舞台,但这不等于说她的癌症已经彻底治愈。
看到这里,你也许会问:CART疗法究竟是一种什么疗法?它为什么对一些癌症看起来有很好的疗效?它有什么副作用?它能否被用于治疗其他种类的癌症?现在,我们就来回答这些问题。
方兴未艾
多年来,癌症治疗的基本手段是手术、化疗和放疗。过去20年里,像伊马替尼(格列卫)和曲妥珠单抗(赫赛汀)这样的靶向药物也成为癌症治疗的基本手段。而在过去几年中,免疫疗法异军突起,被科学家称为癌症治疗的“第五支柱”。
过继细胞疗法(简称ACT)是一类快速发展起来的免疫疗法。该疗法简单说就是采集并利用患者自身的免疫细胞来治疗他们的癌症。目前已研发出几种ACT,而迄今为止在临床研发中取得最好成果、被誉为癌症突破性疗法的正是嵌合抗原受体T细胞疗法(简称CART疗法)。

目前基本恢复正常的碧儿瑟。
2017年以前,CART疗法的应用还仅限于临床试验,主要用于晚期血癌患者。但这些案例仍然受到科学家和公众高度关注.原因很简单——CART疗法对一些患者(包括儿童和成人)有显著治疗效果,而其他治疗方法对这些患者都不起作用。
2017年,美国国家食品和药品管理局(简称FDA)批准了两种CART疗法上市,其中一种用于治疗儿童急性淋巴细胞白血病(简称ALL),另一种用于治疗成人晚期淋巴瘤。一些科学家认为,在许多方面,例如在治疗乳腺癌和结直肠癌等实体癌的有效性方面,CART疗法和其他几种ACT疗法都还不太成熟。不过,这方面目前也有一些进展。
不同类型的ACT疗法仍在研发中。经过几十年的艰苦研究,ACT疗法领域终于迎来重要转折点。就在刚刚过去的几年中,CART疗法以及其他ACT疗法取得重大进展。科学家对这些治疗方法的作用机制有更深理解,并将把这些知识运用到后续的研发和测试中。
科学家认为,在接下来几年中,ACT系列疗法将取得前所未有的进展,必将刷新人们对过继细胞疗法的认知。
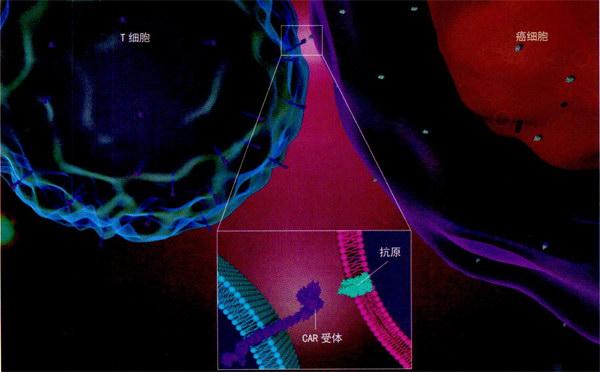
CART细胞寻靶癌细胞(示意图)。
活性药物
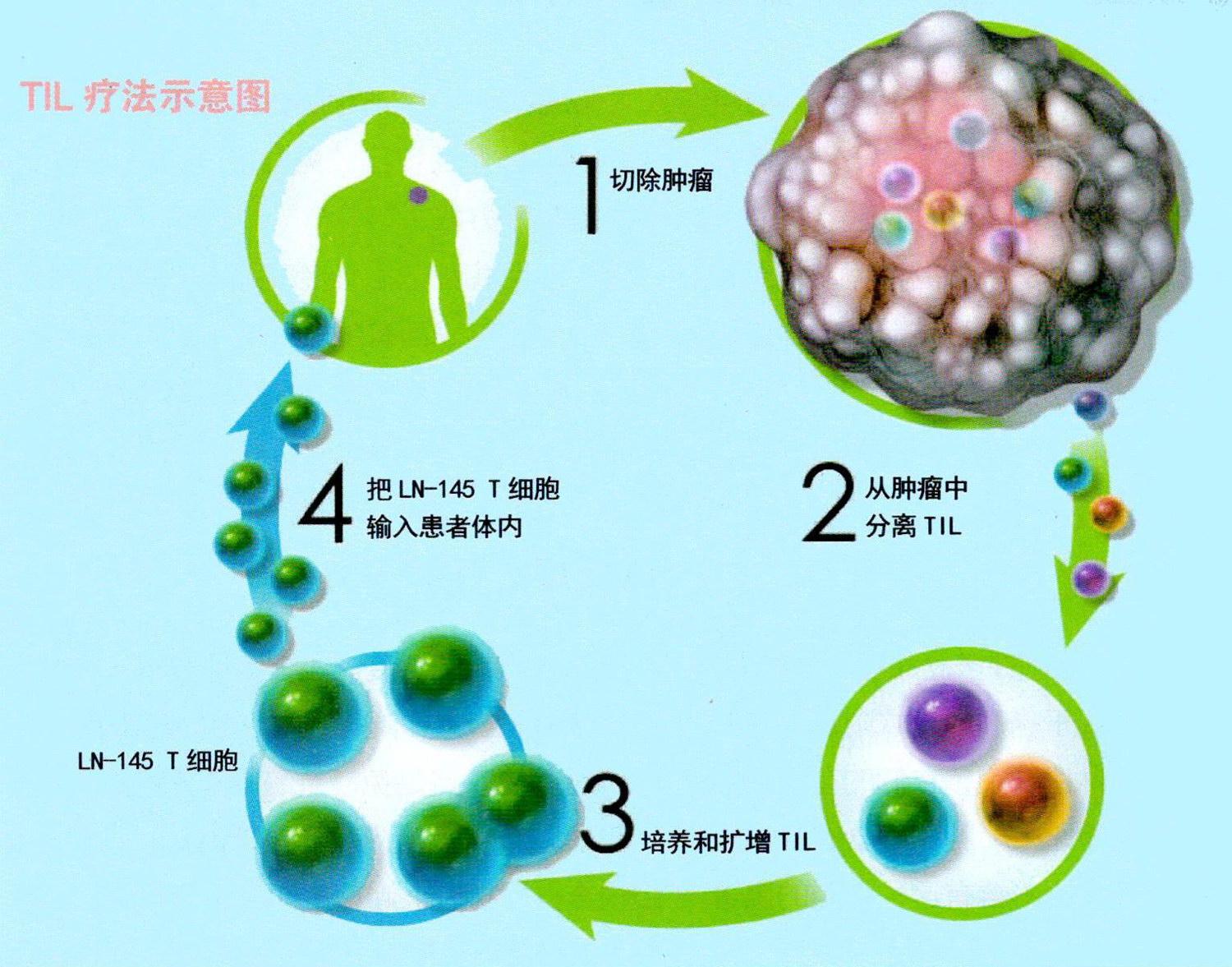
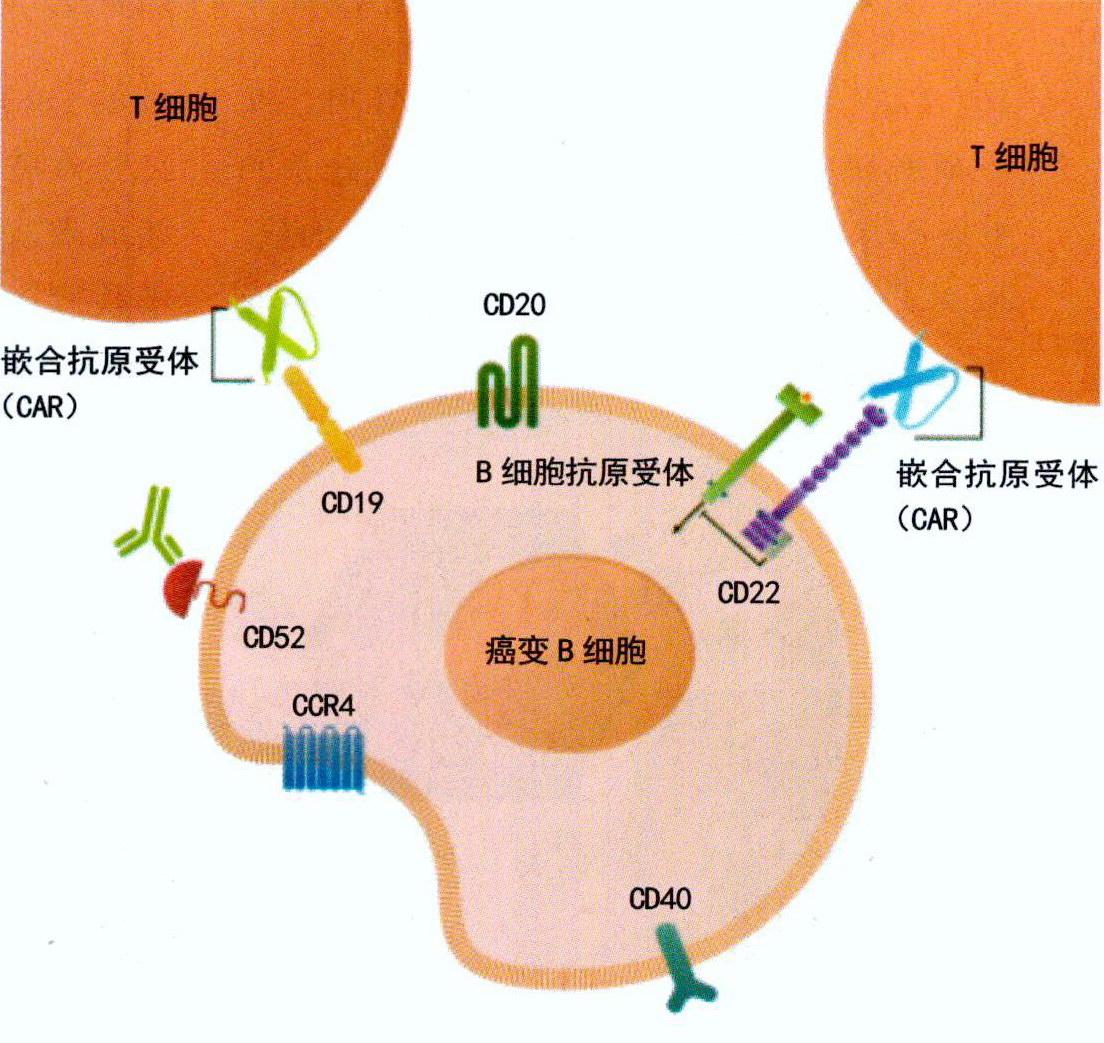
嵌合抗原受体T细胞(简称CART细胞。CART疗法就是把CART细胞作为治疗药物的一种疗法)可被看作是给予患者的一种活性药物。T细胞在协调免疫应答和杀死被病原体感染的细胞方面发挥着重要作用,因此被称为免疫系统的“工兵”。CART疗法需要抽取患者血液并从中分离出T细胞。接下来,利用被去除了致病基因的病毒细胞对T细胞进行基因改造,使其表面产生嵌合抗原受体(即CAR)。这种特殊受体是一种合成(而非自然存在)的分子,它可以使T细胞识别并附着于肿瘤细胞表面特定的蛋白质或抗原。目前疗法的最新成果是寻靶(针对性攻击)B细胞上的一种抗——CD19。在设于治疗现场的实验室,一旦采集的T细胞通过基因改造成表达抗原特异性的CART细胞后,它们就会增殖至数百万至数亿个(根据患者体重和治疗周期决定)CART细胞。最后一步就是将CART细胞输回患者体内。如果一切顺利,那么CART细胞将在患者体内继续增殖,利用经过基因改造后表达的受体来识别并杀死那些表面藏有抗原(例如CD19抗原)的癌细胞。
CART细胞制备
越来越多的CART疗法正在研发中,有的已进入临床试验阶段。虽然这些疗法之间存在很大差异,但它们也有共同点。细胞表面的CAR由合成抗体的片段(或称结构域)组成。这些片段可影响受体对肿瘤细胞上抗体的识别,或影响受体与抗原的结合。
受体要发挥作用,就需要接收来自细胞内部的信号。因此,每个CART细胞在内部都有“信号域”和“共刺激域”将信号传导至细胞表面的受体。这些不同的结构域影响着细胞的整体功能。
随着时间推移,CART细胞内工程技术的进展使改造后的T细胞能够在输回患者体内后继续增殖,并在循环中存活更长时间。科学家在生产一批CART细胞的耗时方面也取得了进展——最初生产需要几个星期,而现在已缩短到7天以内。
效果良好
CART疗法的最初发展主要集中在最常见的儿童癌症——急性淋巴细胞白血病(ALL)。治疗结果表明,80%以上被确诊患有B细胞急性淋巴细胞白血病的儿童可通过化疗被治愈。但对于那些经历化疗或干细胞移植后癌症复发的患者,一直缺乏其他有效治疗手段。
事实上,复发的急性淋巴细胞白血病是儿童癌症患者死亡的头号原因。科学家已经在儿童和年轻成人复发ALL或现有疗法无效的患者中进行了几项CART疗法试验。在其中一项早期试验中,使用的是CD19靶向CART细胞。在试验中接受治疗的30名患者中,有27名的所有癌癥迹象消失(即完全缓解),其中许多患者在治疗后很久仍未出现复发迹象。
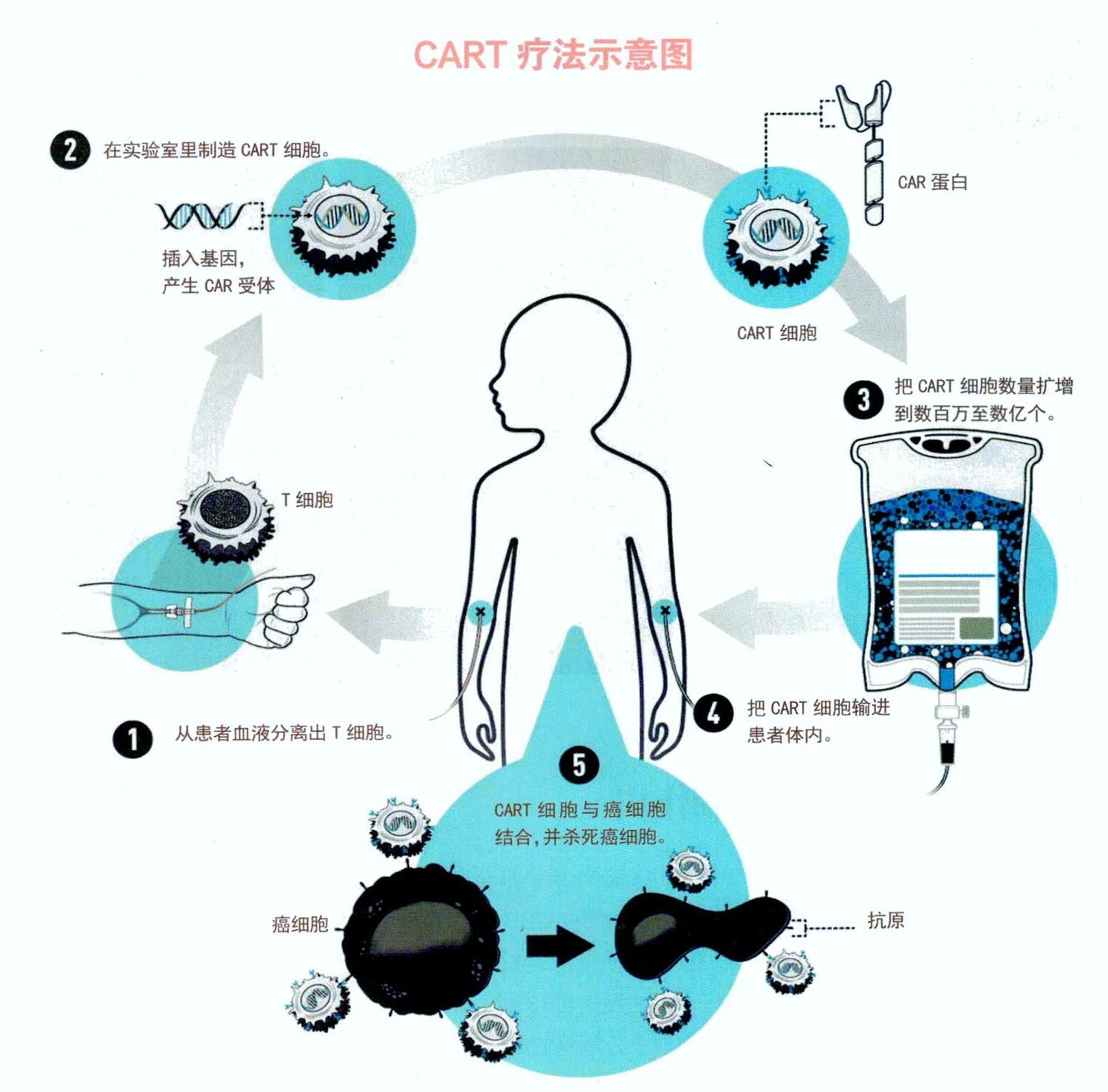
CART疗法怎样进行?
进行疗法需耗时几周,这个过程可划分为以下几个阶段:
1.在患者手臂静脉处插入导管,以便从血液中提取T细胞。这需要2~3小时。
2.提取的T细胞被运送至实验室,经过基因改造成为CART细胞。这需要2~3周。
3.通过静脉滴注将CART细胞输回患者的血液系统。这需要几个小时。
4.细胞在体内攻击并杀死癌细胞。接受CART疗法的患者将受到密切监测。
这些早期成果为针对ALL患儿和青少年患者的CD19靶向CART疗法更大规模的试验奠定了基础。在医药公司资助下,许多参与试验的患者的病情得到完全而持续的缓解。根据临床试验结果,FDA在2017年8月批准了该疗法上市。虽然CD19靶向CART疗法最初是在成人中进行测试的,但在ALL患儿中也取得良好进展。
CD19靶向疗法已被证明在治疗淋巴癌方面同样成功。有研究显示,在参与试验的弥漫性大B细胞淋巴癌患者中超过半数对该疗法产生了完全反应。这彰显了这种方法对治疗侵袭性淋巴瘤患者的潜力,而在此之前这些患者实际上无法被治愈。
更大规模的后续试验结果证实了早期结果,因此FDA批准CART疗法用于一些淋巴癌治疗的临床试验。迄今为止,CART疗法治疗淋巴癌已取得令人难以置信的成功。科学家预测,CART疗法有很大概率会成为几种淋巴癌的常用疗法。CART疗法的突飞猛进,甚至超出了那些很早就看好它的人的期望。
CART疗法最初被认为是一种“精品疗法”,治疗对象仅限于一个非常小而明确的患者群体。过去5年来在CART疗法方面的尝试,其中包括生物制药行业进入该领域,改变了该疗法的应用前景。原本处于癌症末期的一些患者,在接受CART治疗后病情得到真正而持久的缓解。他们不仅延续了寿命,而且生活质量良好。难怪各界对CART疗法寄予厚望。
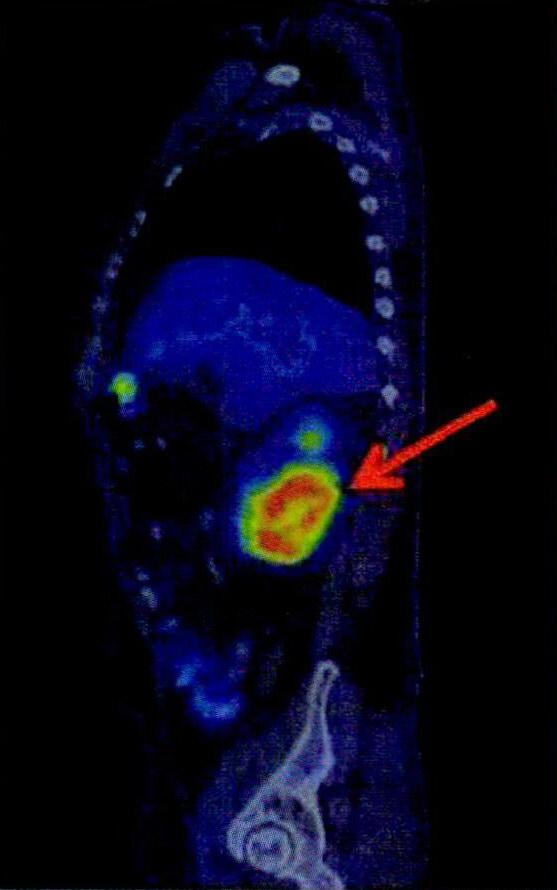
左图为患者在接受CART治疗前的肾肿瘤。
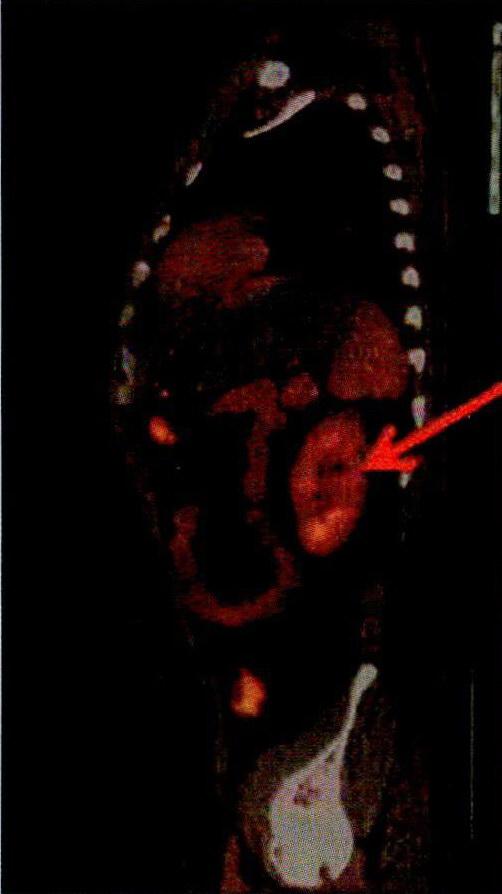
右图显示,患者在接受CART治疗两个月后,肾肿瘤全面消退。
毒副作用
像所有癌症疗法一样,CART疗法也有副作用,甚至有致死风险。其中最常见的副作用就是细胞因子释放综合征(简称CRS)。作为与免疫相关的功能之一,T细胞会释放细胞因子(化学信使)来帮助刺激和引导免疫应答。也就是说,细胞因子的释放本不奇怪。但在发生CRS时,细胞因子异常迅速和大量释放到血液中,会导致患者出现十分危险的高热和血压急剧下降。具有讽刺意味的是,CRS被认为是CART疗法的“靶上”效应。也就是说,CRS的存在证明活性T细胞在体内发挥了作用。一般来说,在接受CART疗法之前曾患其他疾病的患者更可能出现严重的CRS。
许多患者(包括儿童和成人)可通过标准支持疗法(包括采用类固醇)来处理CRS。随着科学家在CART疗法方面获得更多经验,副作用CRS也得到更好的处理。举例来说,几年前严重CRS患者都有特别高的IL-6(T细胞和巨噬细胞应答炎症所释放的细胞因子)水平,因此,阻断IL-6活性成为关键。而采用治疗儿童关节炎等炎症的药物托珠单抗能迅速解决大多数患者的IL-6问题。目前,使用托珠单抗已成为治疗重度CRS的标准疗法。
CART疗法的另一个潜在副作用_脱靶效应,是指B细胞大量死亡,也被称为B细胞再生障碍性贫血。疗法攻击的CD19抗原也在正常的B细胞(B细胞负责产生杀死病原体的抗体)上表达,所以这些正常的B细胞经常被输注的CART细胞杀死,这造成所需抗体不足。为了补充抗体,许多患者必须接受免疫球蛋白治疗,为他们提供对抗感染所必需的抗体。
最近,CART疗法的另一个潜在的致命副作用——脑肿胀(脑水肿)出现在一些正在进行的CART疗法试验中,而临床试验中已有多名患者因疗法诱发的脑水肿而死亡。不过这个现象似乎具有局限性,因为并非所有疗法试验都出现了脑水肿的情况。
其他副作用(如神经中毒导致意识模糊或癫痫发作等)虽然在大多数CART疗法试验中都出现了,但几乎所有患者的症状都是短暂且可逆的。有科学家提出神经中毒可能与CRS有关,但这并非定论。
找到避免CART疗法副作用的方法
CART疗法好,却有严重的副作用。在一项新研究中,科学家微调了CAR分子的形状和序列,使得CART细胞能杀死癌细胞,但产生的细胞因子更少,从而让患者的身体有时间清除血液中的细胞因子。经过改进的CART细胞大量繁殖并分化进患者的记忆细胞,这样就会产生强大而持久的抗癌效果,并且没有毒性。这一方法已经过小规模临床测试并且成功。科学家希望,有朝一日CART疗法能够在门诊部开展。

新靶抗原
对CART疗法的研究正快马加鞭。虽然其中大多数疗法针对的是血癌患者,但针对实体癌的研究也越来越多。例如,随着生物制药行业越来越多涉足该领域,测试CART疗法的临床试验数量急剧上升,从5年前的屈指可数发展到了现在的180多个。
迄今为止进行的大多数试验都使用CD19靶向CART细胞,但这种情况正在迅速改变,这在一定程度上是必要的。举个例子,一些ALL患者对CD19靶向治疗无应答。即使是在治疗后得到完全缓解的患者,也有多达1/3的人会在一年内复发。其中许多复发与ALL细胞不再表达CD19有关,这种现象被称为抗原丢失。
科学家正在测试靶向CD22蛋白的CART疗法对晚期ALL患儿和年轻成人患者的效果,因为这种蛋白也经常被ALL细胞过度表达。在第一项针对CD22靶向的CART疗法的试验中,大多数接受治疗的患者病情完全缓解,其中包括最初对CD19靶向治疗产生完全缓解后仍有癌症发展的患者。研究显示,与CDl9靶向CART疗法的情况相似,CD22靶向治疗后的复发也不少见,但仍有很大空间可在现有基础上延长病情缓解的持续时间。
延长病情缓解持续时间并阻止(哪怕不能完全阻止)抗原丢失的一个可能方法,是同时攻击多个抗原。目前已经有科研团队在初期临床试验中测试同时寻靶CD19和CD22的T细胞。与此同时,他们还在测试一种同时寻靶CD19和CD123(白血病细胞上常见的另一种抗原)的CART疗法。对动物模型的早期研究表明,这种双重寻靶有可能防止抗原丢失。现已在其他血液癌症中发现CART疗法的抗原靶点,其中包括多发性骨髓瘤。科学家已经研发出寻靶BCMA蛋白(一种几乎存在于所有骨髓瘤细胞中的蛋白)的CART疗法。在针对晚期多发性骨髓瘤患者进行的寻靶BCMA蛋白的CART疗法早期临床试验中,超过半数患者的病情因接受治疗而完全缓解。现在已经启动的一项试验,在更大的患者群体中测试寻靶BCMA蛋白的T细胞。
T细胞同时寻靶CD19和CD22。
更多应用
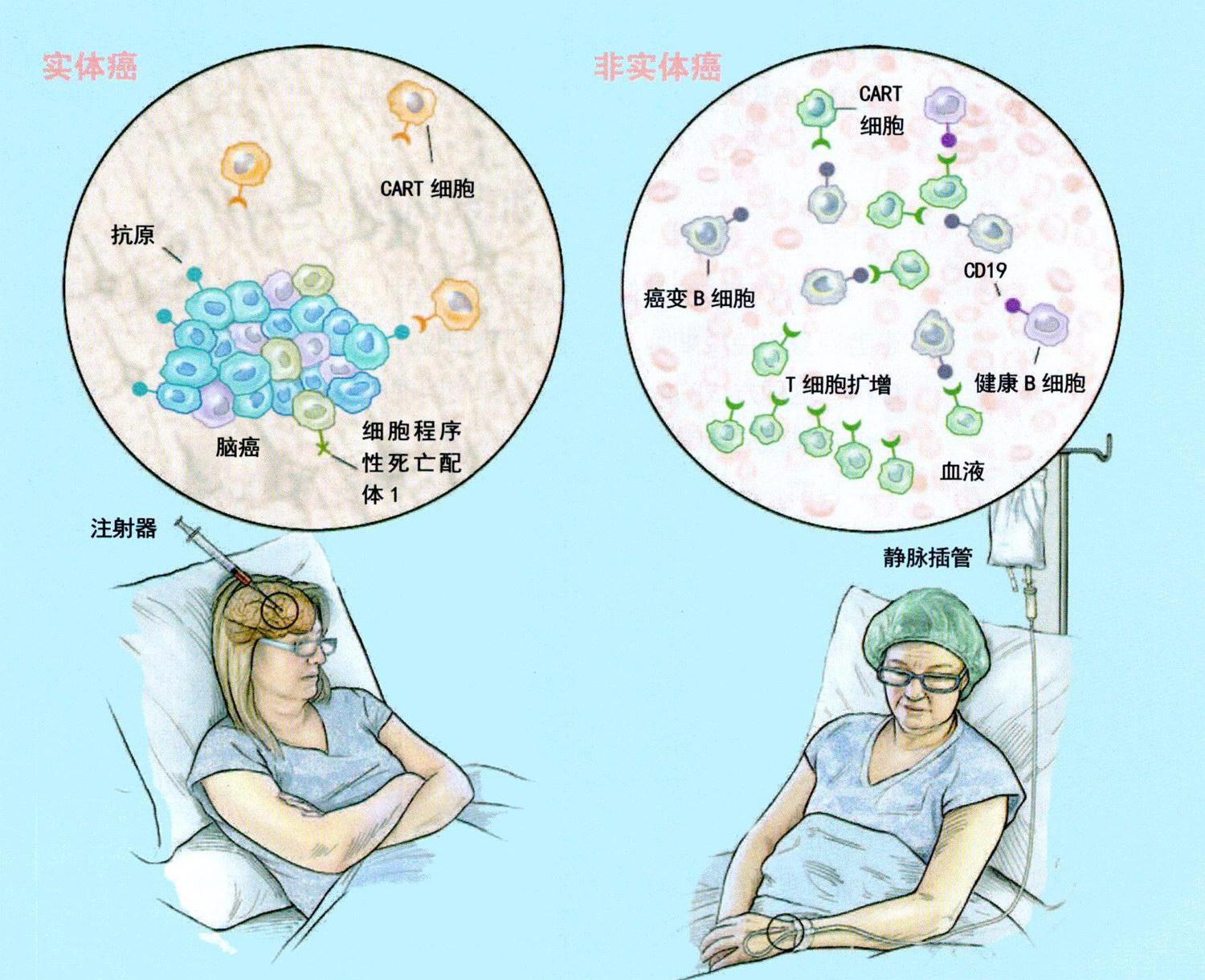
一些科学家认为,CART疗法将在治疗实体癌方面取得成功。也有人认为,要找出可寻靶的实体癌抗原非常困难,这也是要将CART治疗应用于实体癌的主要挑战。迄今试图找到实体癌表面特异性抗体的所有研究基本上均告失败。
科学家猜测,绝大多数肿瘤抗原都存在于肿瘤细胞内,而CAR只能与细胞表面抗原结合,所以无法触及这些肿瘤抗原。正如已经在黑色素瘤中显示的那样,其他形式的ACT可能更适合实体癌,但这不等于应该放弃对CART疗法应用于实体癌的研究。例如,有科学家正在进行寻靶蛋白间皮素的CART疗法试验,该蛋白在一些最致命癌症(包括胰腺癌和肺癌)的肿瘤细胞上过度表达。科学家也在尝试寻靶EGFRvⅢ蛋白(一种存在于侵袭性脑癌胶质母细胞瘤——恶性胶质瘤患者的几乎所有肿瘤细胞上的蛋白)。但这些试验的早期结果大多并没有像在血癌中那样成功,因为实体癌周围的微环境成分会钝化免疫反应。
成功对抗实体癌可能需要一种“超级T细胞”,这种T细胞经改造后能克服许多晚期实体癌的免疫抑制环境。科学家正致力于开发一种具有这些特性的CART细胞——“装甲”CART细胞。
加紧试验
CART疗法的其他改进版正在试验中。其中一种方法是使用非采集自患者自身的免疫细胞,而是使用来自健康志愿者的免疫细胞来开发CART疗法。这种方法的价值在于可立即使用现成的CART疗法,而不需要为每个患者单独定制疗法。
目前,法國一家公司已经在美国启动了现成的CD19靶向CART疗法I期试验,用于晚期急性髓系白血病患者。该公司产品此前已经在欧洲进行测试,测试对象包括2名患有ALL的婴儿,他们均得到有效治疗,而在此之前他们已经尝试过所有其他治疗方案。
与此同时,许多其他方法也正在研究中。例如,科学家正利用纳米技术在人体内制造CART细胞,并利用基因编辑技术更精确地改造T细胞,开发具有“关闭开关”的CART细胞。这种细胞可以避免或限制像CRS这样的副作用。
用CART疗法治疗实体癌
采用常规癌症药物治疗像恶性胶质瘤(最常见也最致命的脑癌)这样的实体癌很困难,原因是大多数癌症药物所含分子都太大而无法穿越血脑屏障。采用CART疗法治疗恶性胶质瘤所面临的主要挑战之一是并非所有肿瘤都表达T细胞能攻击的靶点。在最近一项研究中,科学家对准的靶点是表皮生长因子受体(简称EGFR)变体Ⅲ(简称EGFRvⅢ),它是存在于许多但并非所有恶性胶质瘤表面的突变致癌蛋白。
为了提高CART细胞的攻击性,科学家决定寻靶第二个抗原——EGFR的野生型。由于EGFR在人体的许多细胞中都存在,因此寻靶这种蛋白的药物会引起严重副作用。为了避免这种副作用,科学家创制了一种能被递送进大脑底部脑脊液的CART细胞。它进入大脑后,分泌第二种免疫治疗药物——双特异T细胞衔接器(简称BiTE)。BiTE是能够把杀癌T细胞引导至特异靶点的抗体。
虽然BiTE比基于抗体的药物分子小,但皮下注射仍然无法穿越血脑屏障,因此产生BiTE的CART细胞能通过寻靶第二抗原产生局部杀癌作用,这样就能克制肿瘤特异性,一次寻靶两种抗原。因为BiTE是在血脑屏障的另一侧产生的,数量也不多,所以不会对其他器官有毒性。
但现有的CART疗法尚需投入更多研究。对于在ALL患儿治疗过程中如何更快发挥CART疗法的潜力方面,科学家认为提升空间很大。这对于那些在初始化疗(通常需要两年半时间)后疾病复发的高危人群尤为重要。在这种情况下,如果早期指标表明这些高危患者没有对化疗产生最佳反应,就可以停止化疗,患者可以轉而使用CART疗法进行治疗。对于其中对CART疗法反应良好的患者来说,他们可以省去两年以上的化疗时间,这难道还不够振奋人心?
ACT:TIL、TCR和CAR
在ACT分类下的细胞疗法中,CART疗法受到最多关注。但其他形式的ACT在小型临床试验中也显示出光明前景,其中一些疗法将被应用到实体癌患者中。
其中一种方法是利用已经穿透肿瘤及其周围环境的免疫细胞,即肿瘤浸润淋巴细胞(简称TIL)。科学家曾使用TIL成功治疗晚期癌症患者一最初是黑色素瘤,后来又治疗了宫颈癌等其他几种癌症。最近,科学家新开发了一种识别TIL的技术,它能识别具有癌症特定突变的癌细胞。在一些病例中,这种方法导致晚期结直肠癌和肝癌患者的肿瘤消退。
ACT的另一种主要方法涉及改造患者的T细胞,以表达一种特定T细胞受体(简称TCR)。CAR使用部分人工合成的抗体,这些抗体只能识别细胞表面的特定抗原,而TCR使用自然存在的受体,能识别肿瘤细胞内部的抗原。这些抗原的小片段(MHC复合物蛋白质的一部分)被运送到细胞表面,并“呈递”给免疫系统。
迄今为止,TCR-T细胞疗法已经在多种实体癌患者中进行了测试,这类疗法在治疗黑色素瘤和肉瘤方面被寄予厚望。