Li掺杂二氧化钛抗菌材料的表征及抗菌性
2020-02-15薛向欣
时 代, 杨 合, 薛向欣, 王 梅
(1.东北大学 冶金学院, 辽宁 沈阳 110819; 2.沈阳职业技术学院 机械工程学院, 辽宁 沈阳 110004)
TiO2纳米粒子是一种非常有潜力的抗菌材料,不但具有好的光催化活性,同时具有较强的光触媒氧化分解能力[1].光触媒材料吸收光后能达到高能状态,并利用该能量与物质产生化学反应[2],其代表性的材料为纳米TiO2.TiO2本身也存在局限性:第一个不足之处是由于其禁带宽度大,电子需要从价带跃迁到达导带需要的能量大,只有在小于或等于387.5 nm的波长照射下,价带的电子才会被激发,电子到达导带形成空穴-电子对,才可表现出明显的杀菌活性[3].第二个不足之处是,光激发生成的光生电子和空穴非常容易复合,这会导致材料的光催化活性降低[1].由于TiO2的禁带宽度变小,在可见光下TiO2的光催化效果得到改善,光生电子与空穴的复合率降低.所以本实验对TiO2进行了金属离子掺杂改性[2].TiO2的改性有金属掺杂、非金属掺杂以及共掺杂三种方式.掺杂金属在TiO2光催化中主要有两个作用:一是对本征激发产生的光生载流子起到俘获陷阱的作用;二是能够产生一个杂质能级到TiO2的导带与价带之间,并参与光激活过程[4].金属离子主要有Cu2+,Fe3+等离子掺杂及Th4+,Ce3+,Er3+,Pr3+,Gd3+,Nd3+,Sm3+等稀土离子掺杂[5].非金属离子掺杂主要有C,N,S等.本文选取金属Li+离子作为掺杂离子对TiO2进行掺杂改性.
如果将抗菌剂制成纳米材料会极大增加比表面积,从而更好地吸附微生物,抗菌效果也会更好.纳米二氧化钛既具有其独特的光催化抗菌性能,同时也具有纳米粉体的体积效应、久保效应、小尺寸效应和表面效应[6].
本文采用溶胶-凝胶法进行Li掺杂TiO2抗菌剂的制备.溶胶-凝胶法[7]合成纳米 TiO2材料采用的原料一般为低级钛醇盐试剂[8](例如钛酸四丁酯等).溶胶-凝胶法和其他方法比较具有以下优点:(1)由于实验中所用原料纯度均为分析纯及以上,所以制得样品的纯度较高,溶剂在处理过程中也非常容易去除;(2)制得样品的均匀度可以达到分子或原子级别;(3)制样反应中的各反应条件相比其他反应的反应条件更易于控制,减少不必要的副反应[6].
1 实 验
1.1 粉体制备
Li单掺杂TiO2抗菌纳米材料的合成采用溶胶-凝胶法.实验步骤如下:将钛酸四丁酯通过梨型分液漏斗滴加到无水乙醇中,对溶液充分搅拌使其澄清透明,不可有白色物质出现,记为溶液A;另将锂源化合物、表面活性剂溶解在无水乙醇中,并加入一定量的去离子水和冰乙酸并混合均匀,记为溶液B[9].对配制好的B溶液充分搅拌使其充分溶解,而后将A溶液逐滴加入到B溶液中搅拌均匀,形成澄清透明的溶胶,将溶胶置于室温下静置陈化,形成凝胶后置于80 ℃烘箱中烘干得到干凝胶.将干凝胶研磨形成粉末,放入快速马弗炉中以5 ℃/min的升温速度升温至600 ℃并保温2 h,得到Li掺杂TiO2纳米材料[9].制备过程中各种物质的总体积比为V(钛酸四丁酯)∶V(水)∶V(无水乙醇)∶V(冰醋酸)=5∶5∶35∶2.
1.2 粉体表征
X射线粉末衍射仪(XRD,Shimadzu,Kα 线,Cu 靶)测定抗菌材料的物相结构; 扫描电子显微镜(SEM,JSM-5600LV,日本)对抗菌材料的基本形貌进行分析;采用 SEM 上附带的能量色散谱仪(EDS)对样品元素组成进行分析[10];采用日本岛津公司的UV-2550型UV-Vis分光光度计对吸光度进行测定[10].
1.3 实验设备及药品
实验中所需设施及试剂如表1,表2所示.
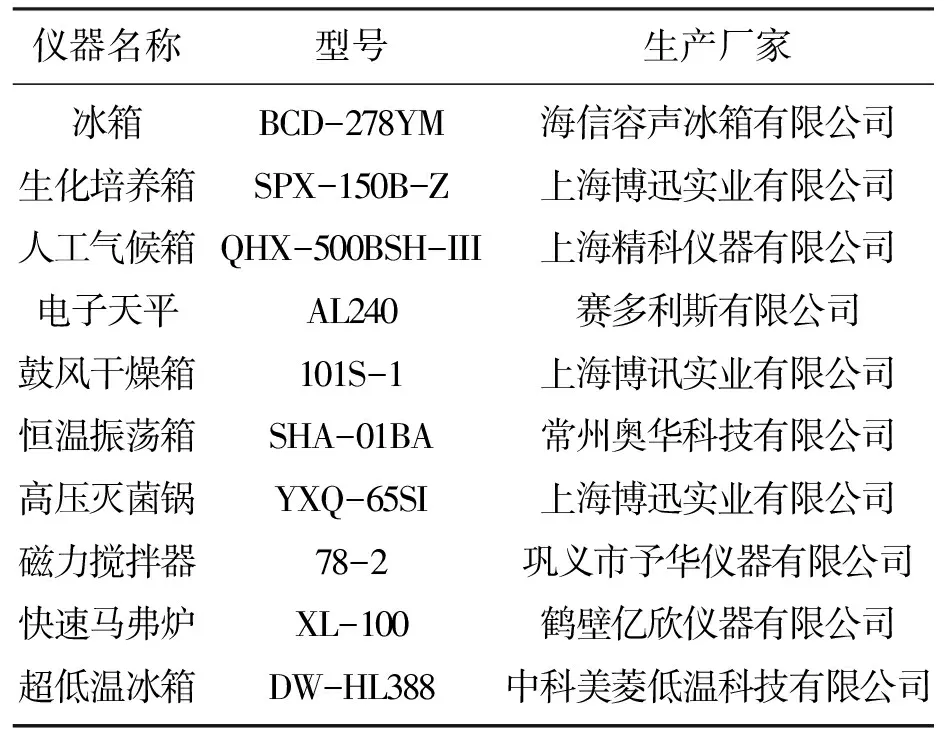
表1 实验设施
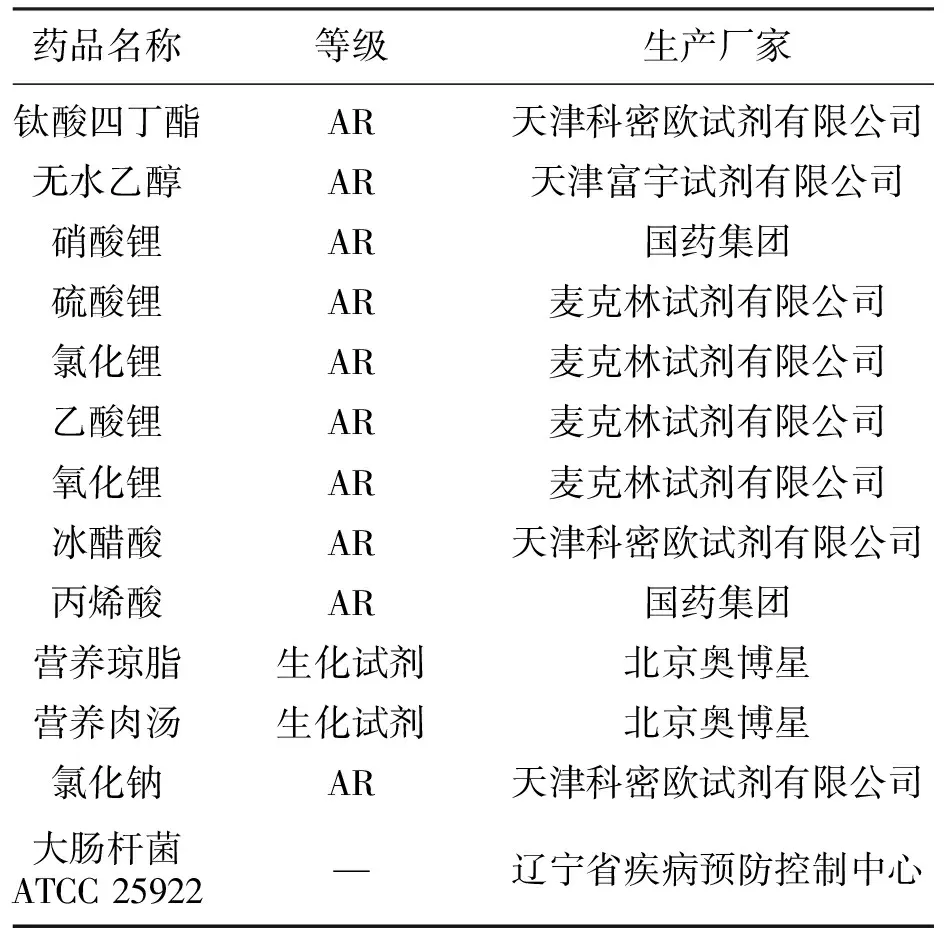
表2 实验药品
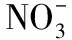
1.5 抗菌实验
按照卫生部2006年颁布的消毒技术规范[10],使用振荡烧瓶法将纳米材料加入适当浓度菌液体,通过振荡使微生物在菌液中与抗菌材料充分接触,一定时间后将菌液定量加入到含有抗菌样品的营养肉汤中,将营养肉汤置于人工气候箱中的磁力搅拌器上,于恒温37 ℃下使抗菌样品、菌液、营养肉汤充分接触,120 min后取其样液进行活菌培养计数,计算抗菌样品的抑菌率[12].其抑菌率按照式(1)计算:
(1)
式中:Co为空白样品菌落数;C是含有抗菌剂样品的菌落数;R为抑菌率.并采用抑菌环法通过测量抗菌样品的抑菌环直径,考量样品对周围菌落的抑制作用[13].
2 结果与讨论
2.1 锂源对掺杂TiO2纳米材料抗菌性能的影响以及其性能表征
分别以0.01 mol硝酸锂、乙酸锂、氯化锂、硫酸锂、氧化锂作为锂源掺杂制备TiO2纳米材料,将每种抗菌材料的1/2进行抽滤水洗至溶液pH=7后烘干样品,将水洗过的样品与原样品分别做抗菌实验,比较其抗菌效果.

2.2 锂的掺杂量对掺杂TiO2纳米材料抗菌性能的影响以及其性能表征
分别加入0.001,0.005,0.01,0.02,0.04,0.06,0.08,0.1mol(样品1#~8#)硝酸锂掺杂制备Li-TiO2纳米材料.图2为选取大肠杆菌(ATCC 25922)为实验菌种,考察不同掺杂量的LiNO3对TiO2材料的抗菌性能影响.
由图2可知,当硝酸锂的掺杂量为0.001 mol时,Li-TiO2的抗菌效果非常不明显,随着掺杂量的逐渐增多,材料的抗菌性逐渐增强.当LiNO3的掺杂量达到0.01 mol时,Li-TiO2抗菌材料对大肠杆菌抗菌性能达到最优.而后掺杂量的增加不再对抗菌性能有明显改善.故而选择掺杂量0.01 mol为最优掺杂量.
图3为不同掺杂量的LiNO3掺杂TiO2纳米材料的XRD图.由谱图显示,1#~5#的抗菌材料均出现锐钛矿型TiO2及金红石型TiO2的特征衍射峰;随着掺杂量的增加,6#~8#的Li-TiO2抗菌材料的锐钛矿型TiO2及金红石型TiO2的特征衍射峰强度降低至消失[10].在1#样品中,Li2TiO3,LiTiO2的特征峰几乎没有,可能是因为这两个样品中锂元素含量较少,且晶化程度较低.随着锂元素含量的增加,2#~8#样品Li2TiO3,LiTiO2的特征衍射峰强度逐渐增强,在2θ=27.6°处的锐钛矿型TiO2特征峰强度呈现先逐渐减小至消失的趋势,说明锂元素的掺杂可以抑制样品中晶粒的长大从而细化晶粒.
表3为不同锂源掺杂量的Li-TiO2纳米材料在抗菌实验中的释放溶液离子量,其制备测定方法见1.4节.由表中数据可知,Li-TiO2-1#~8#的Li离子、硝酸根离子的释放量随着掺杂量的增加而增加.
图4为不同掺杂量的LiNO3掺杂Li-TiO2纳米材料的UV-Vis-DRS谱图.由图可知,Li-TiO2-1#~8#纳米材料的吸收随着掺杂量的增加明显向长波方向移动,且材料吸收边的位置基本相同,但是样品4#的吸光强度明显大大高于样品5#~8#,却弱于样品1#~3#,而1#~3#的吸光强度差别不大,根据后续实验中抗菌效果的实验结果,故选择 0.01 mol 作为最优添加量.

表3 溶液的各离子释放量
2.3 表面活性剂种类对Li-TiO2纳米材料抗菌性能的影响以及其性能表征
分别选取0.5 g阴离子表面活性剂十二烷基苯磺酸钠(SDBS)、十二烷基硫酸钠(SDS)、阳离子表面活性剂十六烷基三甲基溴化铵(CTAB)、非离子型表面活性剂聚乙二醇2000(PEG2000).图5为不同种类表面活性剂Li-TiO2纳米材料对大肠杆菌抗菌性能影响.由图可知,加入阴离子表面活性剂十二烷基苯磺酸钠(SDBS)和十二烷基硫酸钠(SDS)制备的抗菌材料抗菌率最优.图6为不同表面活性剂的Li-TiO2纳米材料UV-Vis-DRS图,由图可知表面活性剂为CTAB的抗菌材料吸光强度最强,而活性剂为SDBS的抗菌材料吸光度次之.参考抗菌结果,选取SDBS作为表面活性剂制备Li掺杂TiO2抗菌材料.
2.4 焙烧温度对掺杂TiO2纳米材料抗菌性能的影响以及其性能表征
图7为焙烧温度500,600,700,800 ℃时Li-TiO2纳米材料的XRD图,由图可知,焙烧温度为500 ℃时制备的纳米材料物相组成主要存在形式是锐钛矿型TiO2、金红石型 TiO2,Li2TiO3和 LiTiO2;焙烧温度为600,700 ℃时的物相主要以锐钛矿型 TiO2,Li2TiO3和 LiTiO2的形式存在;焙烧温度为800 ℃时以锐钛矿型 TiO2,Li2TiO3的形式存在.随着焙烧温度升高,金红石型TiO2减少,而锐钛矿型TiO2和Li2TiO3含量逐渐增多.金红石型TiO2的禁带宽度为3.0 eV,而锐钛矿型TiO2的禁带宽度为 3.2 eV,锐钛矿型TiO2的禁带宽度较高[12].由图8可看出,不同焙烧温度的二氧化钛纳米材料吸收边均明显向长波方向移动.焙烧温度为 700 ℃时的吸收边位置和吸光强度明显高于 500,600,800 ℃的吸收边位置和吸光强度,但后续抗菌实验的结果印证600 ℃纳米材料的抗菌率达到最佳,而温度过高需要加热的时间过长,温度越高越难达到,并且容易造成资源浪费,所以最终选择 600 ℃为后续反应条件[14].
由图9可知,焙烧温度为600 ℃的Li-TiO2纳米材料的抗菌率最优,对大肠杆菌的抗菌率达到99.5%.焙烧温度为700 ℃时,纳米材料的抗菌性和600 ℃基本持平,基于环保节能的考量,选取600 ℃为最优焙烧温度.图10为不同焙烧温度纳米材料的抑菌环对比图,由图可知600 ℃的抑菌环直径达到2.6 cm,大于500,700,800 ℃的抑菌环,再次印证Li-TiO2-600 ℃的抑菌效果为最佳,也进一步印证了振荡烧瓶法的抗菌实验结果.图11为Li-TiO2材料的SEM及EDS图.
由图11a可知,LiNO3掺杂TiO2抗菌材料在600 ℃时TiO2粒径细小且致密,比表面积较大[15],光催化时与吸附物的接触面积增大,有利于提高光催化活性,使抗菌性能得到提升[16-18].由图11b可知抗菌材料中含有Li,Ti,O三种元素,这表明Li元素掺杂到了TiO2粉体中,分散较好.
3 结 论
1) 硝酸锂作为锂源制备的抗菌材料受pH影响较小并且抗菌率最优,故选择硝酸锂作为锂源制备Li-TiO2纳米材料.
2) 随着硝酸锂掺杂量的增加,抗菌材料的物相组成中锐钛矿型TiO2、金红石型TiO2含量逐渐减少,Li2TiO3,LiTiO2含量逐渐增加,Li-TiO2抗菌材料光吸收边向可见光区移动.当掺杂量达到0.01 mol时,抗菌材料对大肠杆菌的抗菌率可达到99.5%,故最终选择硝酸锂掺杂量为0.01 mol作为最优掺杂量.
3) Li-TiO2抗菌材料在不同焙烧温度下的抗菌性能由强到弱,依次为600 ℃=700 ℃>500 ℃>800 ℃,600 ℃抗菌材料对大肠杆菌的抗菌率达到99.5%,抑菌环直径达到2.6 cm.检测分析可知Li-TiO2抗菌材料在600 ℃焙烧保温2 h后,样品晶粒细小且结构致密,比表面积大,吸光度增加.出于抗菌性能和节约资源双重考量,故最终选择 600 ℃作为抗菌材料最优煅烧温度.
