刺参养殖池塘浮游和底栖藻类群落及水质特征*
2020-02-07李成林周红学赵洪友孙永军鞠文明
赵 斌,胡 炜,李成林**,周红学,赵洪友,孙永军,鞠文明,韩 莎
(1.山东省海洋生物研究院,山东青岛 266104;2.山东省农业农村厅,山东济南 250013;3.莱阳市海洋渔业有限公司,山东烟台 265200;4.好当家集团有限公司,山东荣成 264300)
0 引言
刺参(Apostichopusjaponicus)是经济价值极高的海洋性温带种。自20世纪90年代中期以来,随着人们经济收入的增长和保健意识的增强,刺参消费需求日益扩大,其养殖产业发展速度和生产规模也达到了前所未有的水平[1],已成为我国海水养殖的主导产业之一,并成功引领了我国第五次海水养殖产业浪潮[2]。池塘养殖是刺参产业的主要生产模式[3],在我国刺参主产区山东、辽宁等省均占主导地位,目前国内刺参池塘养殖面积已超过1.0×104hm2。
浮游与底栖藻类的变化特征与环境因子密切相关,其群落结构特征在一定程度上反映养殖水体健康程度[4]。浮游和底栖藻类在池塘养殖生态系统的物质循环和能量传递中发挥着重要作用,其现存量、种类组成和多样性能很好地反映水体的营养水平[5-7]。因此,了解刺参养殖池塘中浮游和底栖藻类群落的变化规律,可更方便掌握池塘藻类结构与刺参养殖的关系,为改善养殖池塘生态环境提供参考。本研究对位于山东威海市荣成刺参养殖池塘中的浮游和底栖藻类群落结构及其水质特征进行系统调查研究,旨在为刺参池塘生态健康养殖提供科学参考。
1 材料与方法
1.1 实验池塘
实验时间为2017年3月—2018年3月,地点是位于山东威海靖海湾海域的好当家集团有限公司刺参养殖池塘。池塘面积约2 hm2(100 m×200 m),平均水深2.0 m,以相邻的2个同面积池塘作为对照组。刺参饲养在池塘架设的4 m×2 m×1 m网箱中,规格为2.5—50.0 g/ind.。养殖池塘通过进排水道与外海连通,通过潮汐定期换水,每潮换水20%—30%。
1.2 池塘藻类采样
浮游藻类:每个池塘的东西两端各选取1个采样点,放养前1 d进行第一次水样采集,之后每隔30 d采集水样1次,每次采集水样1 L,用1.5%鲁哥氏液固定。
底栖藻类:每个池塘东西两端各选取1个采样点的附着基质,使用过滤海水洗刷附着基(每个样品采样面积为10 cm×10 cm)上的附着物,然后将样品全量移入1 L塑料广口瓶中,用5%中性甲醛溶液固定。
将采集水样静置沉降24 h,去上清后浓缩,摇匀后立即取0.1 mL样品到0.1 mL计数框中,在生物显微镜下,计数2片,每片计数50个视野,依据《藻类学》[8]、《藻类名词及名称》[9]分类鉴定到属或种。用细胞体积法推算生物量。
1.3 多样性分析
藻类种类多样性分析用香农威纳(Shannon-Wiener)多样性指数(H′)计算,计算方式为
式中,S为样品中的种类总数,Pi为第i种的个体数与全部种类总个体数的比值。
1.4 水质测定
温度(T)、盐度(Sal)、pH值等指标在池塘采样现场测定;溶氧(DO)、总氮(TN)和总磷(TD)分别采用碘量滴定法、萘乙二胺分光光度法、磷钼蓝分光光度法进行测定。各项水质指标每10 d测定一次,并取月均值作图分析。
1.5 数据分析
使用Excel和Canoco 5软件处理数据及统计。采用Canoco 5软件对刺参池塘浮游、底栖藻类优势种类和水质指标的周年变动数据进行典范对应分析(Canonical Correspondence Analysis,CCA),根据结果分析优势种类的主要驱动因子。
2 结果与分析
2.1 刺参养殖池塘浮游和底栖藻类的种类组成
实验期间周年观测分析结果中,共发现浮游藻类7门38属53种,底栖藻类4门25属42种(表1,实验观测中仅鉴定到属的按1个种算)。浮游藻类中硅藻门种类最多(28种),其次是绿藻门和甲藻门,裸藻门、隐藻门、金藻门、蓝藻门种类较少。底栖藻类中种类最多的也是硅藻门,共有37种,在种类组成中占88.1%,甲藻门、裸藻门、蓝藻门各占少量。

表1 刺参养殖池塘浮游和底栖藻类的种类
2.2 刺参养殖池塘周年水质特征
如图1所示,自3月份开始,实验刺参养殖池塘水温随气温上升而逐月升高。养殖池塘平均水温在周年变化中,8月水温最高,为28.6℃;之后随着气温下降,池塘平均水温显著下降,至1月下降至最低,为1.0℃。开春后随气温回暖,池塘平均水温逐渐升高。实验刺参养殖池塘周年盐度为28.6—30.8(图2)。平均盐度最低值出现在1月,为28.6;最高值出现在5月,为30.8。
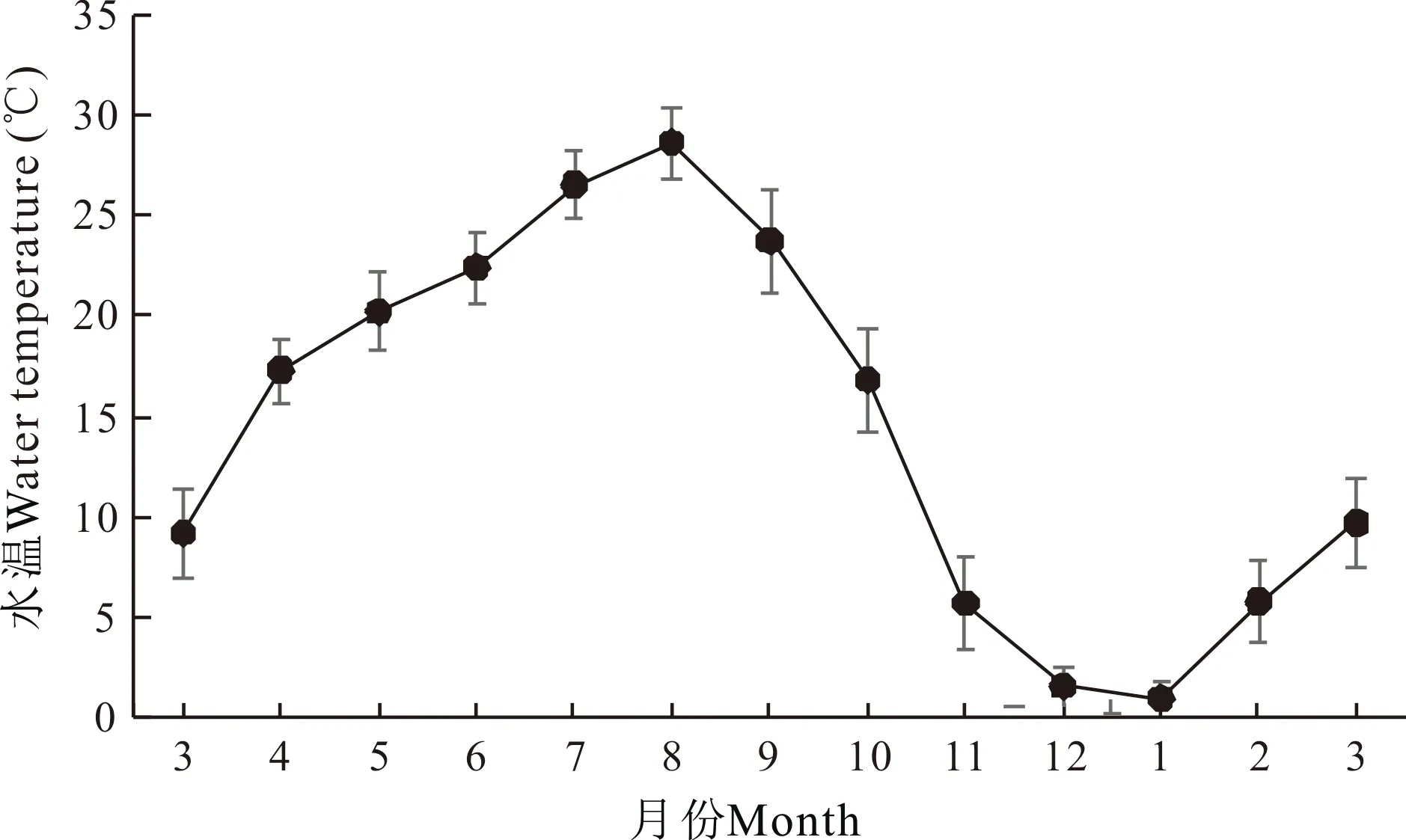
图1 刺参养殖池塘水温周年变化
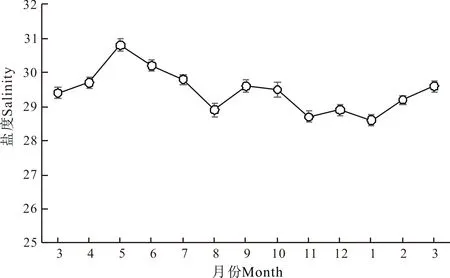
图2 刺参养殖池塘盐度周年变化
实验刺参养殖池塘pH值周年变化范围不大,最低值出现在3月,为7.9,最高值出现在11月,为8.6;溶氧周年变化为5.3至9.2,溶氧较低月份为5月和8月,5月为5.3,8月为5.4;进入12月后溶氧迅速升高,至1月达最高均值9.2,之后随冰雪融化和水温上升,溶氧逐渐降低(图3)。
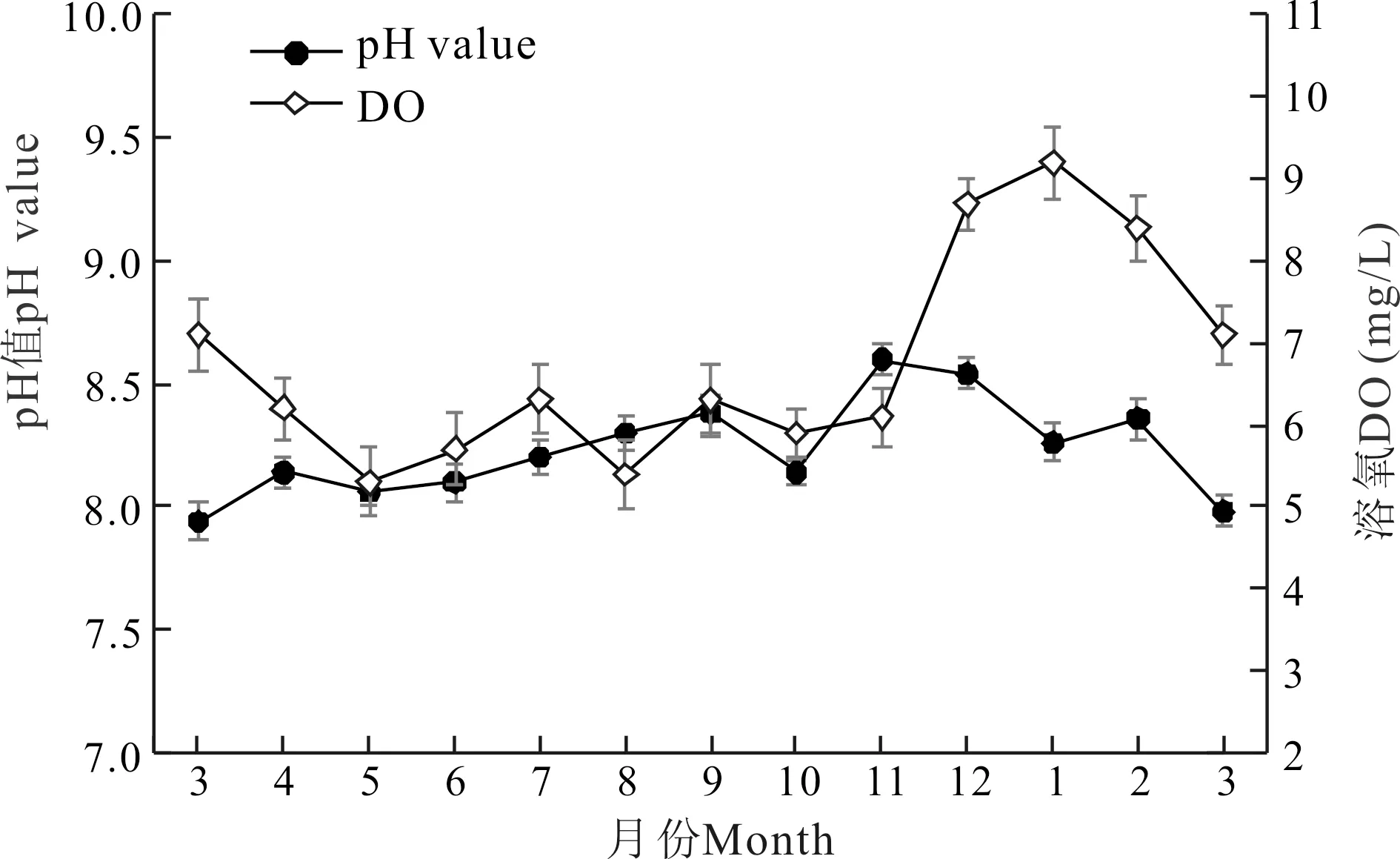
图3 刺参养殖池塘pH值和溶氧周年变化
实验刺参养殖池塘氨氮月平均最高值出现在9月,为212 μg/L,最低值出现在11月,为54 μg/L;自4月至11月期间,养殖水体氨氮呈先上升后下降趋势。磷酸盐周年变化范围稳定,为85—174 μg/L,无较大起伏(图4)。
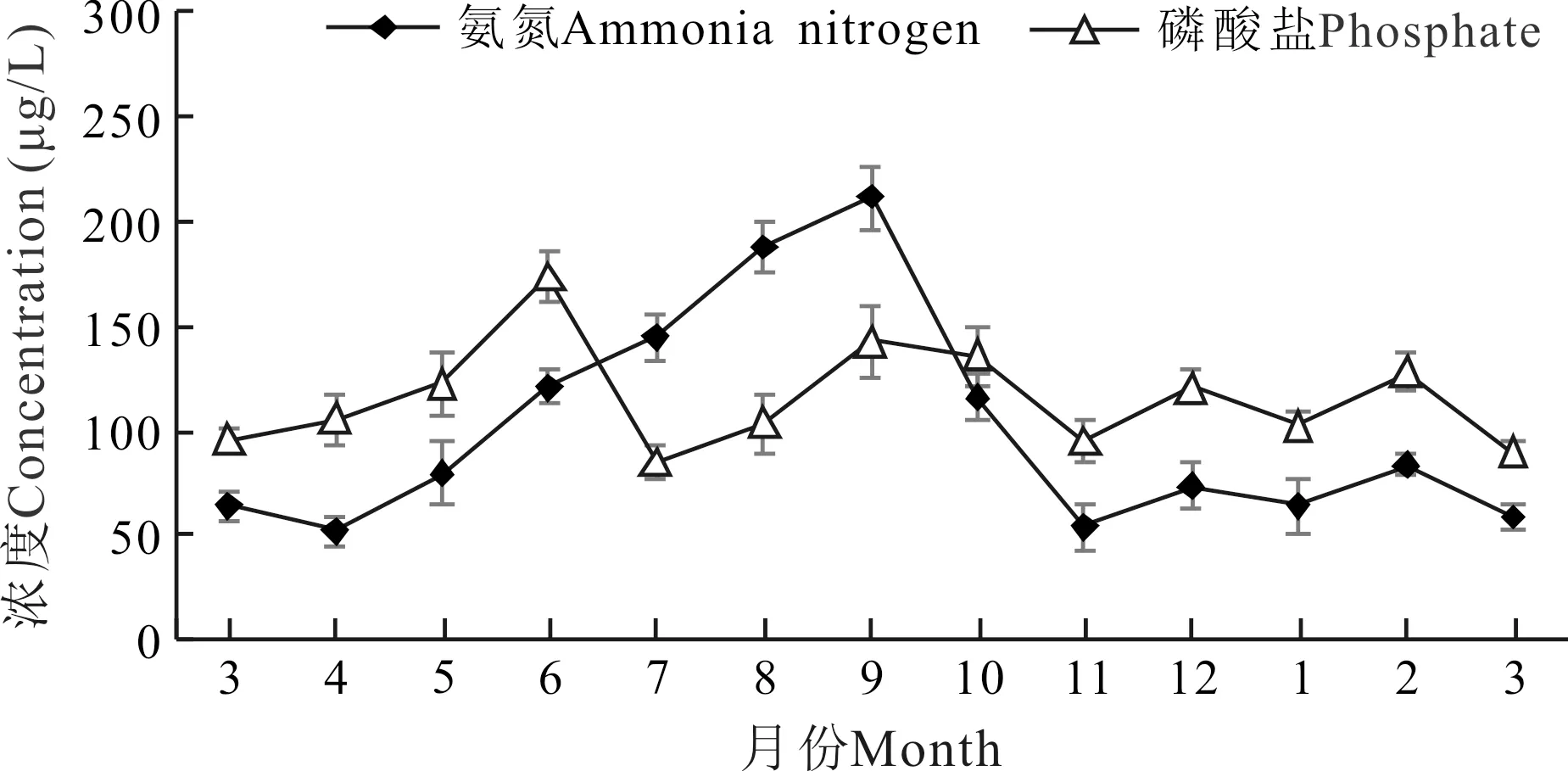
图4 刺参养殖池塘氨氮和磷酸盐周年变化
综上,刺参养殖池塘盐度、pH值、磷酸盐的变化范围较小,其他水质因子指标的变化呈显著的季节性特征。
2.3 刺参养殖池塘浮游和底栖藻类群落多样性
刺参养殖池塘浮游和底栖藻类种类生物量如图5所示。浮游藻类和底栖藻类生物量的季节变化规律相似,春季和夏季较高,秋季逐渐下降,冬季较低。浮游藻类生物量最低值出现在1月,为2.9 mg/L,最高值出现在7月,达到23.7 mg/L。底栖藻类生物量最低值出现在12月,为2.5 mg/L,最高值出现在4月,达到16.5 mg/L。
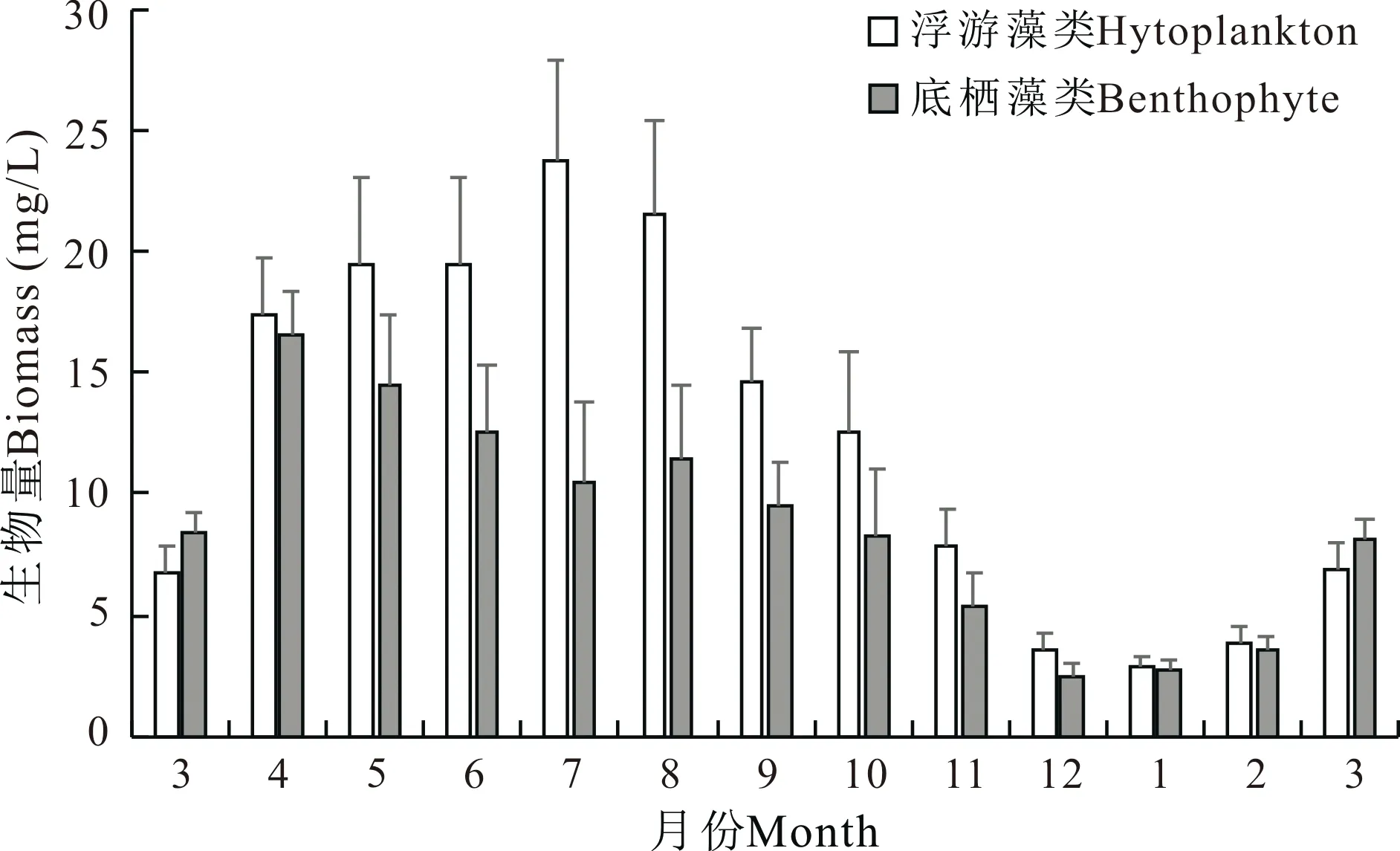
图5 刺参养殖池塘浮游和底栖藻类生物量周年变化
刺参养殖池塘浮游和底栖藻类种类生物多样性指数周年变化如图6所示。浮游藻类多样性指数最高值出现在7月,为2.98,最低值出现在12月,为1.94。底栖藻类多样性指数最高值出现在4月,为2.35,最低值出现在11月,为1.66。浮游、底栖藻类生物量和多样性指数存在一定相关关系,尤其在1—4月期间的变化趋势较为接近。
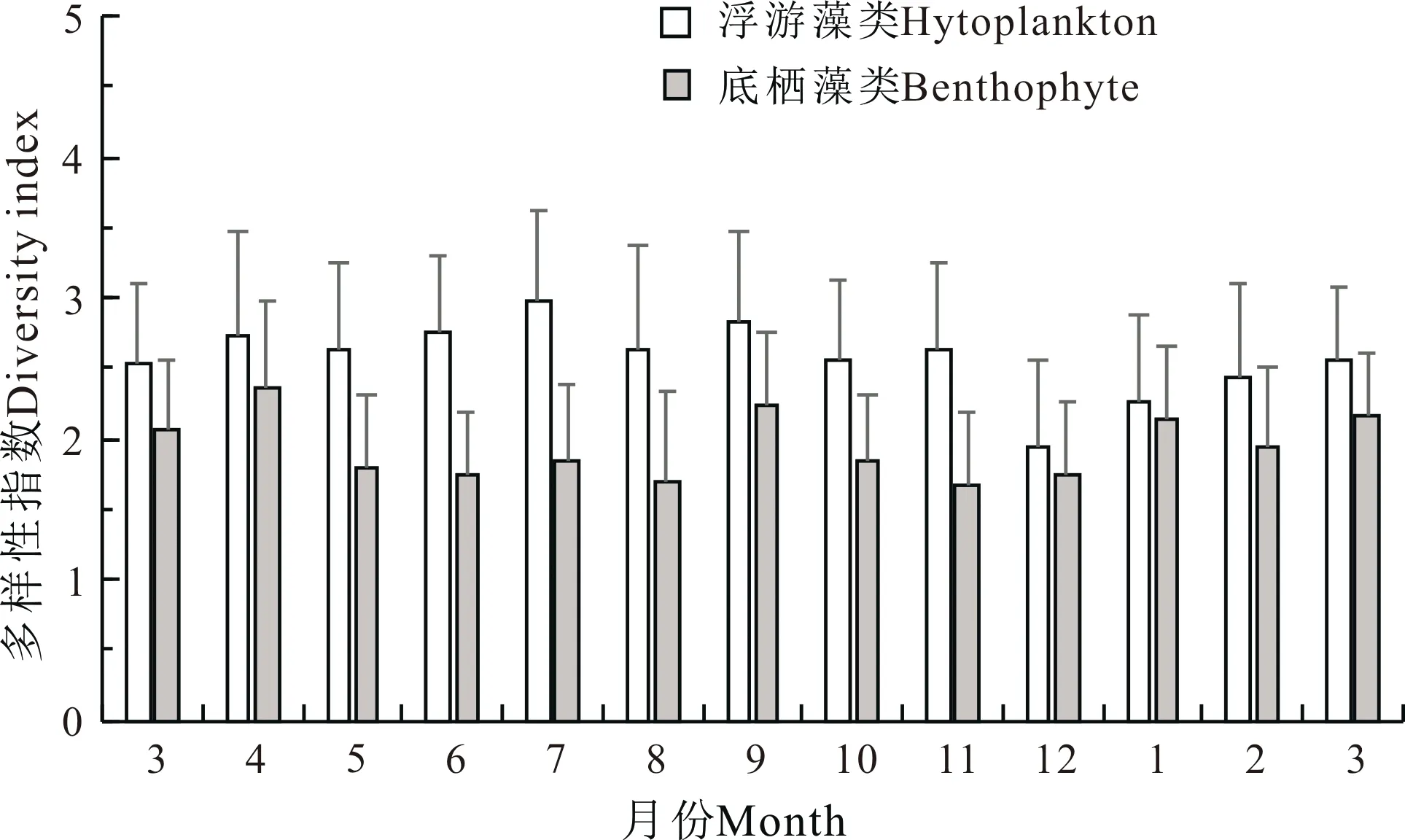
图6 刺参养殖池塘浮游和底栖藻类多样性指数周年变化
刺参养殖池塘浮游和底栖藻类优势种类与水环境指标的CCA分析分别如图7,8所示,其中A、B、C、D、E、F、G分别代表硅藻门、绿藻门、甲藻门、裸藻门、隐藻门、金藻门和蓝藻门。CCA分析结果显示,影响浮游藻类优势种类的主要驱动因子为温度(T)、溶氧(DO)和pH值,其中硅藻门种类数与温度呈显著正相关(P<0.05)。影响底栖藻类优势种类的主要驱动因子为温度(T)、溶氧(DO),其中硅藻门与温度(T)、总氮(TN)呈显著正相关(P<0.05)。
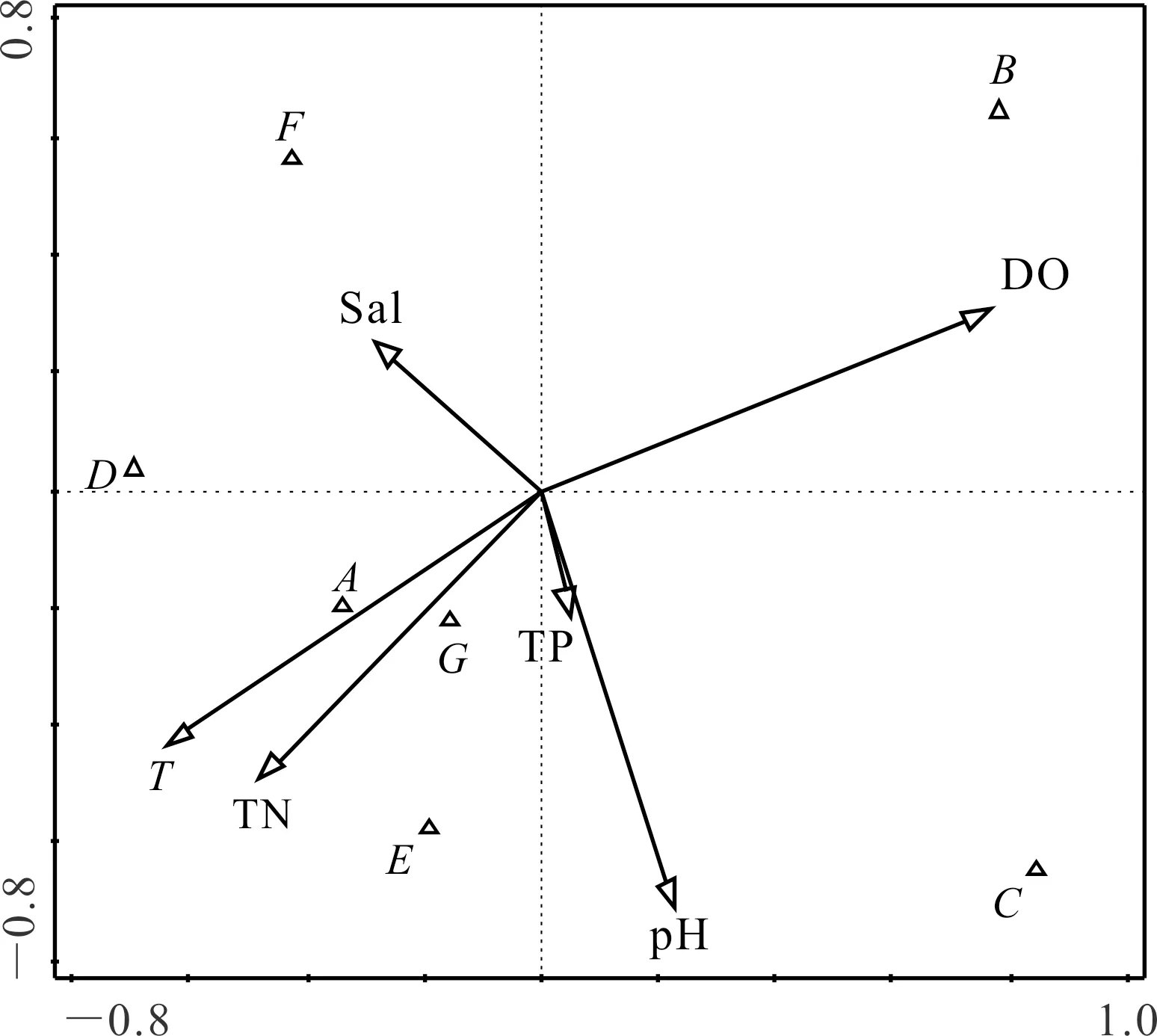
图7 刺参养殖池塘浮游藻类与水环境因子相关性分析
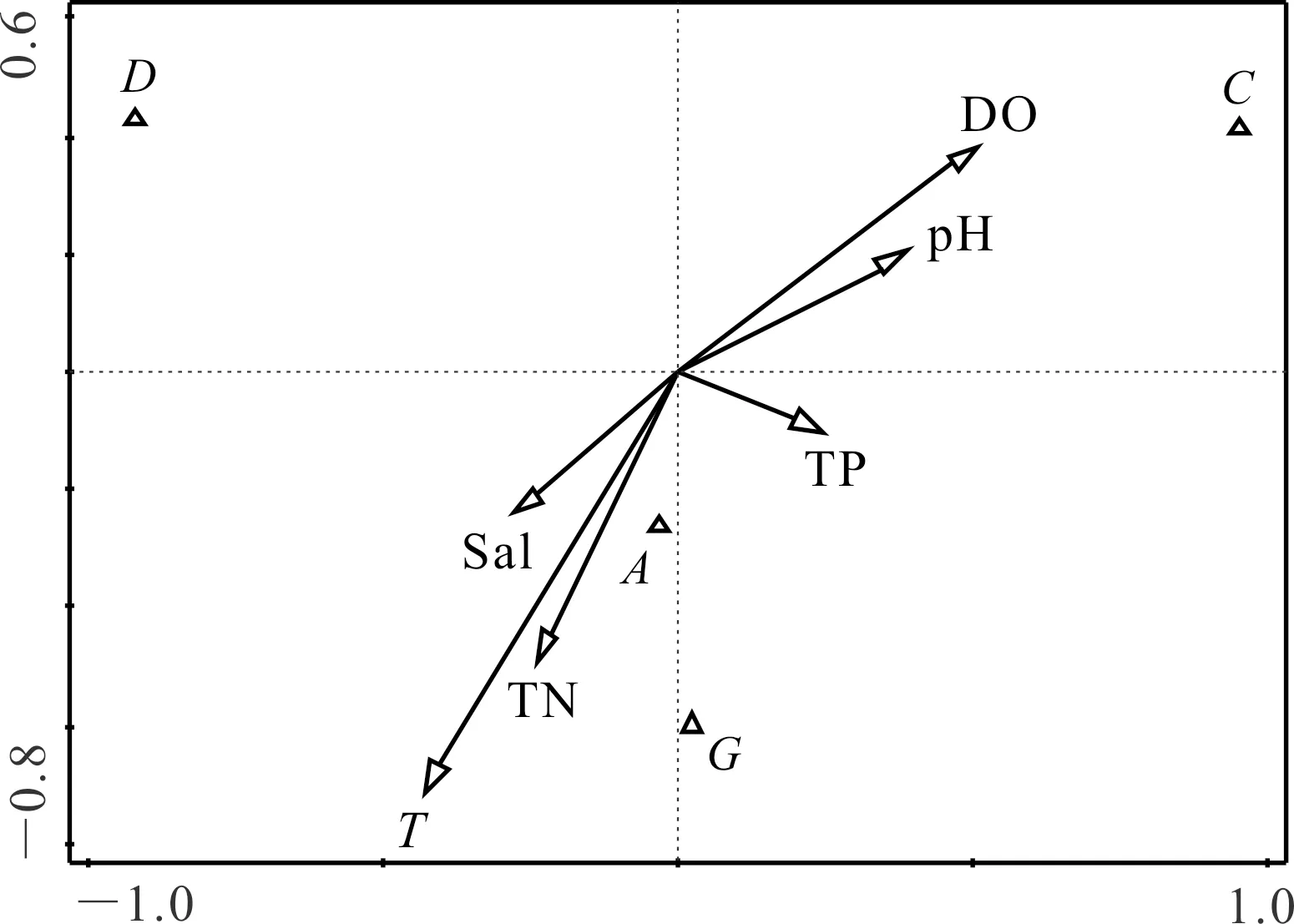
图8 刺参养殖池塘底栖藻类与水环境因子相关性分析
3 讨论
3.1 刺参养殖池塘浮游和底栖藻类群落特点
浮游和底栖藻类是养殖池塘生态系统的重要初级生产者,对维持池塘生态系统的稳定具有关键作用[10,11]。浮游植物给水环境中各类动物提供基础食物,参与生态系统中的能量供应和物质循环,在平衡生态系统中占据着重要位置[12],而底栖藻类是自然环境中刺参的主要饵料,其种类和密度可对刺参幼体生长发育产生影响[13]。本研究地点位于山东威海南部的靖海湾,沿岸分布着沙窝、沙嘴、长会口等渔港,是威海市乃至山东省的重要刺参养殖区域。本研究对刺参养殖池塘藻类的统计结果显示,浮游藻类种类和数量均以硅藻门最多,这与桑沟湾、胶州湾及黄海中南部海区浮游植物群落结构的调查结果基本一致[14-16];在底栖藻类的组成中,硅藻门同样占有绝对优势,与胶州湾红岛潮间带、山东省莱州刺参养殖区类似[17,18]。作为刺参的理想天然饵料,硅藻在池塘藻类组成中的优势地位,为刺参养殖提供了良好的营养条件。此外,本研究结果中其他浮游植物和底栖藻类在组成种类和数量上与上述前人研究存在差异,可能主要是水体所处地理环境不同所致。
生物多样性是描述生物群落结构特征的重要参数,关系生态系统的稳定[19],浮游植物群落多样性指数变化可在一定程度上反映水产养殖池塘环境的变化[20],为环境质量评估提供参考[21]。本研究结果显示,底栖藻类的群落组成和季节变化相对浮游藻类更稳定,这可能是因为池塘底部较上方水体受外界环境影响相对较小,底栖藻类没有浮游藻类反应敏感,所以更不易随外界环境变化而改变。池塘附着基上的底栖藻类对养殖刺参影响作用的主要因子是其细胞数量和生物量大小,而非其种类组成的差异[7],本研究中的刺参池塘均是当地养殖效益较好的池塘,推测其养殖效益与相对稳定的池塘底栖藻类生物量有关。
3.2 池塘藻类季节变化与水质理化因子的关系
池塘藻类优势种群的动态变化和养殖水环境中的各种理化因子具有相关性。温度是控制池塘藻类生长、繁殖和演替的重要因子,水温会直接影响浮游植物的酶促反应,特别是对暗反应的酶促反应过程,大多数藻类比较适应的温度为18—25℃[22]。本研究刺参养殖池塘位于山东威海市荣成南部海域,实验中周年水温为1.0—28.6℃,是影响池塘浮游和底栖藻类优势种类的最主要影响因子,其他重要影响因子还有溶氧和pH值。不同藻类的适应水温也不尽相同,其中浮游藻类在5月和7月出现等值高峰,底栖藻类在4月至8月繁殖较多。此外,水温会对藻类群落结构产生重要影响[23],狭冷性藻类如硅藻一般在春、秋季水温较低时出现[24]。本研究中观察到春季底栖藻类中新月菱形藻、针杆藻等藻类繁殖速度超过其他藻类,而7—9月舟形藻、新月菱形藻成为优势种,各种藻类在不同水温下呈现演替现象,符合上述变化规律。CCA分析显示,在浮游和底栖藻类中,水温均与其优势种类呈显著正相关关系。
营养盐是微藻生长繁殖所需的基础物质[25-27],多数水体生态系统中的氮或磷是限制浮游植物繁殖的主要营养元素[28],不同藻类对营养的需求不同,在相同低浓度磷的水环境中,硅藻对磷的吸收和利用不如甲藻[29,30]。本研究对池塘氨氮和磷酸盐的监测分析结果显示,藻类群落结构与其并无显著相关性,可能是氨氮、磷酸盐在自然养殖水环境中含量一直较稳定,池塘外海海域水质良好,进排水通畅,从而使氨氮、磷酸盐没有成为促进池塘藻类生长的主要驱动因子。在水温条件适宜、营养盐含量均衡情况下,硅藻的生长、繁殖比甲藻更有优势,因此在本研究中无论是浮游还是底栖藻类种类构成中,均是硅藻占据优势地位。本研究中在池塘浮游和底栖藻类中均观察到蓝藻门、甲藻门种类,在水质良好、没有富营养化的情况下,这些藻类无法占据优势地位,不会对刺参养殖产生显著影响。
4 结论
在山东威海靖海湾海区的刺参养殖池塘中,池塘藻类的构成以硅藻门种类最多,硅藻门和绿藻门作为池塘主要优势种全年均有分布。藻类生物量均呈春、夏季较高,秋、冬季较低的变化规律。影响刺参周年养殖池塘藻类优势种类的主要水环境驱动因子为水温,不同季节藻类群落中的优势种存在演替现象。在刺参池塘养殖过程中,应保持池塘水环境和营养盐结构稳定,以控制甲藻等可能大量耗氧、产生毒素的藻类过度繁殖,维系池塘环境中底栖硅藻等稳定的生物量,为刺参健康养殖营造有利的环境条件。
