Drp1在高糖诱导的大鼠心肌细胞肥大中的作用研究*
2020-02-06吴清蕊练飞鸿邝素娟吴飞龙张梦珍麦丽萍林秋雄单志新邓春玉
吴清蕊,练飞鸿,饶 芳,邝素娟,杨 慧,吴飞龙,张梦珍, 麦丽萍,林秋雄,单志新,杨 敏,邓春玉△
(1华南理工大学生物科学与工程学院, 广东 广州 510006; 2广东省心血管病研究所临床药理重点实验室,广东省人民医院医学研究部, 广东省医学科学院, 广东 广州 510080)
糖尿病(diabetes mellitus, DM)是胰岛素分泌绝对或相对不足,以高血糖和高血脂为特征的代谢紊乱综合征,糖尿病心肌病(diabetic cardiomyopathy, DCM)是其常见的心脏并发症[1],是DM引起心脏微血管病变和心肌代谢紊乱所致的心肌广泛局灶性坏死,其病理变化在细胞水平主要表现为心肌细胞肥大,而在亚细胞水平主要表现为线粒体破损、较小线粒体数量增多[2],具体的发病机制及病理过程目前尚未完全清楚。研究表明,线粒体功能异常是心肌肥厚发生的主要机制[3],但线粒体分裂(mitochon-drial fission)异常与糖尿病性心肌肥厚的关系少见报道。也有研究显示,线粒体动力学失衡与许多疾病有密切关系,发动蛋白相关蛋白(dynamin-related protein 1,Drp1)在Ser616位点磷酸化水平增加,Ser637位点磷酸化水平降低可以促进线粒体分裂[4-8]。因此,我们推测Drp1磷酸化水平变化介导的线粒体分裂增加可能参与了糖尿病心肌肥厚的发生,分别在细胞水平和分子水平进行实验研究,探讨线粒体动力学相关蛋白Drp1的磷酸化水平在高糖诱导的心肌细胞肥大模型中的表达变化及其作用机制。
材 料 和 方 法
1 实验动物
出生1~3 d的SD乳大鼠,雌雄不限,SPF级,由南方医科大学实验动物中心提供,生产许可证号为SCXK(粤)2016-0041,质量检测单位为广东省实验动物检测所。
2 主要试剂
兔抗心房钠尿肽(atrial natriuretic peptide, ANP)单克隆抗体购自Bioworld Technology;鼠抗Drp1单克隆抗体、兔抗p-Drp1(Ser616)单克隆抗体和兔抗p-Drp1(Ser637)单克隆抗体购自CST;兔抗α-微管蛋白(α-tubulin)单克隆抗体购自Proteintech;脱脂奶粉购自BD;4×SDS 上样缓冲液、线粒体分裂抑制剂1(mitochondrial division inhibitor 1, Mdivi-1)和4′,6-联脒-2-苯基吲哚(4′,6-diamidino-2-phenylindole, DAPI)购自Sigma;聚偏二氟乙烯(polyvinylidene difluoride, PVDF)膜和放射免疫沉淀实验(radio immunoprecipitation assay, RIPA)细胞裂解液购自Millipore;麦胚凝集素(wheat germ agglutinin, WGA)购自武汉谷歌生物公司;线粒体膜电位(mitochon-drial membrane potential, MMP)检测试剂盒(JC-1)和BCA 蛋白定量试剂盒购自上海碧云天公司;5-溴-2′-脱氧尿嘧啶核苷(5-bromo-2′-deoxyuridine, BrdU)购自Selleck;DMEM培养液和胎牛血清购自Gibco;磷酸缓冲盐溶液(phosphate-buffered saline,PBS)购自武汉博士德公司。
3 主要方法
3.1细胞培养和干预 用酶解分离法将1~3 d的SD乳大鼠心脏消化分离成单个细胞,根据心肌细胞与成纤维细胞的差速贴壁,分离心肌细胞和成纤维细胞,用含双抗和10%胎牛血清的DMEM(含5.5 mmol/L葡萄糖)培养液将心肌细胞悬液重悬,加入BrdU抑制成纤维细胞增殖,置于包被鼠尾胶原的6孔板中,37℃、5% CO2培养箱培养48 h(其中24 h换液一次)后,换含不同糖浓度的无BrdU的DMEM培养液继续培养至72 h。将培养的乳大鼠心肌细胞分成6组:对照(control; 5.5 mmol/L葡萄糖)组、高渗透压(hyperosmosis,HM;33 mmol/L甘露醇)组、DMSO组、高糖(high glucose, HG;33 mmol/L葡萄糖)组、Mdivi-1(10 μmol/L)组和HG+Mdivi-1组(10 μmol/L Mdivi-1预处理3 h后再换成含33 mmol/L葡萄糖的DMEM培养液继续培养72 h)。
3.2SD乳大鼠原代心肌细胞WGA染色和细胞表面积计算 1~3 d的SD乳大鼠原代心肌细胞分离培养48 h后,高糖组用含33 mmol/L葡萄糖的培养基继续培养至72 h,PBS漂洗2次,每次5min,用4%多聚甲醛(paraformaldehyde, PFA)固定细胞15 min后,用PBS漂洗2次,每次5 min,根据产品说明书加入WGA-Alexa Fluor 488,室温避光孵育10 min后,用PBS漂洗2次,每次5 min, 滴加DAPI染核及封片,激光共聚焦扫描显微镜采集图片,应用Image-Pro Plus 6.0软件测量心肌细胞的表面积。
3.3JC-1检测 MMP 将原代心肌细胞分为control组、HM组和HG组,高糖培养72 h后换液,根据产品说明书加入JC-1染料(10 mg/L)避光孵育15 min,PBS漂洗2次后在激光共聚焦显微镜下观察并记录结果。通过JC-1从红色荧光到绿色荧光的转变可以检测到细胞膜电位的下降,用ImageJ 软件对线粒体膜电位荧光强度进行半定量分析,通过测取图片中的红绿荧光的比值,记录作为线粒体膜电位的原始数据。
3.4Western blot检测相关蛋白的表达量的变化 提取心肌细胞总蛋白:细胞收板后用PBS漂洗2次,加入含有蛋白酶抑制剂的中性裂解液冰上裂解30 min,用细胞刮促进细胞充分裂解,吸取到EP管静置、12 000 r/min离心15 min,上清即为细胞总蛋白。BCA 法进行蛋白定量。用裂解液和上样缓冲液(4 ×)将各样品配至蛋白量为20 μg,100 ℃变性10 min,进行SDS-PAGE后转膜,用5%脱脂奶粉将膜浸泡常温置摇床上封闭1 h,I抗(1 ∶1 000稀释)4 ℃摇床孵育过夜。第2天用TBST洗膜3次,每次5 min,然后室温摇床孵育II抗1 h左右(II抗1 ∶5 000稀释于含5% 脱脂奶粉的TBST)。TBST洗膜3次,每次5 min。用ECL试剂盒显影蛋白条带,ImageJ图像分析软件测定蛋白条带灰度值,取目的条带的灰度值与内参照的灰度值的比值进行统计学分析。
4 统计学处理
用SPSS 22.0统计软件进行统计学分析,用GraphPad Prism 5将统计结果绘制成柱形图,计量资料以均数 ± 标准误(mean±SEM)方式表示,多组间比较采用单因素方差分析(one-way ANOVA)。以P<0.05为差异有统计学意义。
结 果
1 高糖诱导原代心肌细胞肥大
与control组及HM组相比,HG组ANP的蛋白表达水平显著升高(P<0.01),心肌细胞表面积也显著增加(P<0.01);control组和HM组之间无显著差异(P>0.05),见图1。
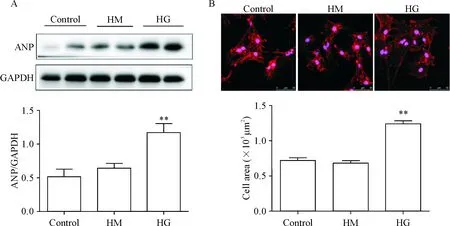
Figure 1. High glucose (HG) induced hypertrophy of neonatal rat cardiomyocytes. A: the protein expression of ANP in the neonatal rat cardiomyocytes (n=3); B: immunofluorescence staining (WGA staining) showed the size of the neonatal rat cardiomyocytes (scale bar=50 μm; 50 cells were quantified in each group). Mean±SEM.**P<0.01vsother groups.
图1 高糖诱导乳大鼠心肌细胞肥大
2 高糖诱导心肌细胞线粒体膜电位降低
与control组及HM组相比,HG组的心肌细胞MMP显著降低(P<0.01);control组和HM组之间无显著差异(P>0.05),见图2。
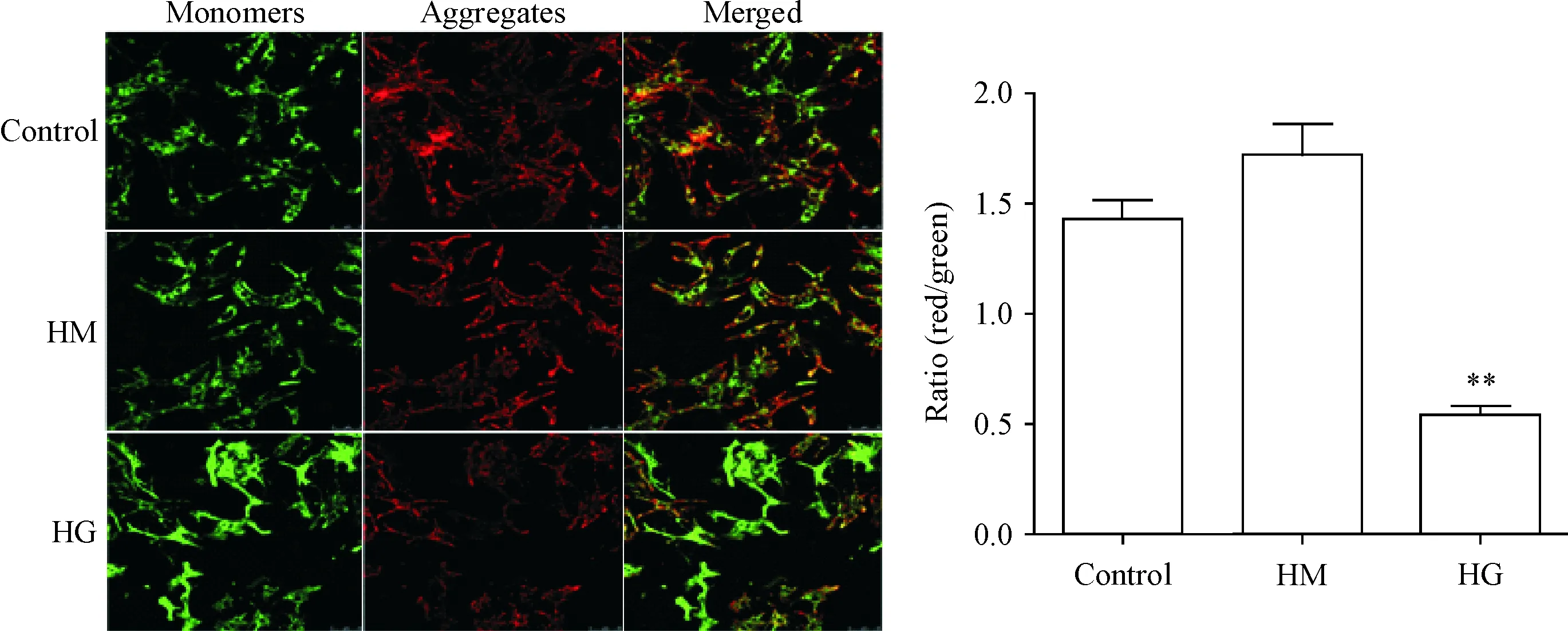
Figure 2. High glucose (HG) induced dissipation of MMP in neonatal rat cardiomyocytes. JC-1 aggregates (red) indicate intact MMP, while JC-1 monomers (green) indicate dissipation of MMP. The scale bar=50 μm. Mean±SEM.n=3.**P<0.01vsother groups.
图2 高糖诱导线粒体膜电位降低
3 高糖诱导心肌细胞线粒体分裂增加
与control组及HM组相比,HG组p-Drp1 (Ser616)水平显著升高(P<0.05),p-Drp1(Ser637)水平显著减少(P<0.05),Drp1总蛋白水平无显著变化(P>0.05);control组和HM组之间无显著差异(P>0.05),见图3。
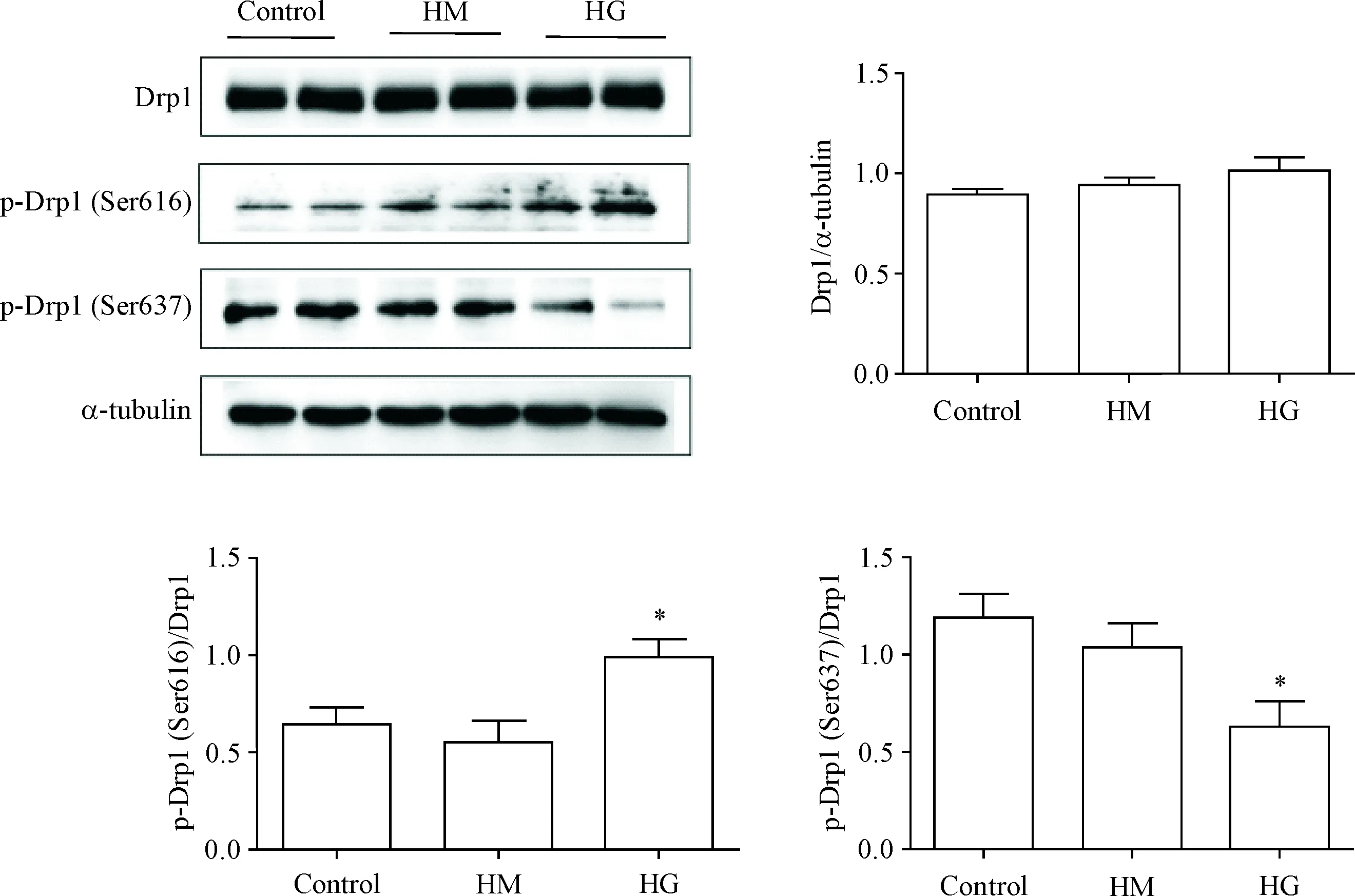
Figure 3. High glucose (HG) induced increase in mitochondrial fission. Mean±SEM.n=3.*P<0.05vsother groups.
图3 高糖诱导线粒体分裂增加
4 线粒体分裂抑制剂Mdivi-1抑制高糖诱导的心肌细胞肥大
与control组相比,HG组ANP和p-Drp1(Ser616)水平显著升高(P<0.05),而p-Drp1(Ser637)水平显著降低(P<0.05);与HG组相比,高糖+Mdivi-1组ANP和p-Drp1(Ser616)水平显著降低(P<0.05),而p-Drp1(Ser637)水平显著升高(P<0.05),Drp1总蛋白水平无显著变化(P>0.05);control组、HM组、DMSO组和Mdivic-1组之间无显著差异(P>0.05),见图4。
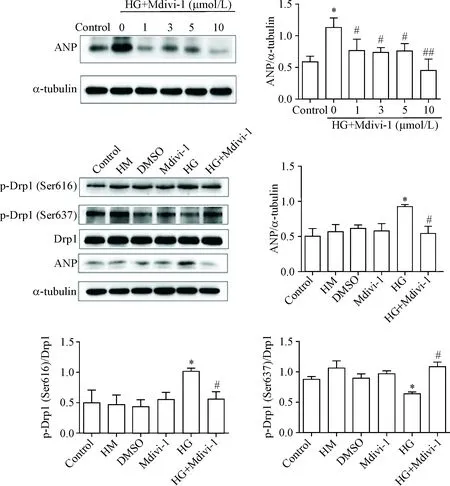
Figure 4. Mdivi-1 blocked high glucose (HG)-induced cardiomyocyte hypertrophy. Mean±SEM.n=3.*P<0.05vscontrol group;#P<0.05,##P<0.01vsHG group.
图4 Mdivi-1阻断高糖诱导的心肌细胞肥大
讨 论
本研究结果表明,乳大鼠心肌细胞Drp1蛋白Ser616位点的磷酸化增加而Ser637位点的磷酸化减少导致的线粒体分裂增加,促进了高糖诱导的心肌细胞肥大,抑制Drp1可以显著缓解高糖诱导的心肌细胞肥大,提示DM导致心肌细胞内线粒体分裂增加可能是心肌肥厚的重要因素。
高血糖是DCM的独立危险因素[9],然而,其潜在机制尚未得到充分阐明。以往研究应用高糖培养液培养心肌细胞建立DM代谢损伤细胞模型[10-11],探索高血糖导致DCM的内在机制[12],但高糖培养液的含糖浓度及干预时长不定。为了选择适当的实验浓度及干预时长,预实验显示,相比对照组,葡萄糖浓度为33 mmol/L、刺激72 h时ANP的表达水平稳定增加,细胞的表面积显著增加。因此本项工作选择该细胞模型,对高糖诱导心肌细胞肥大的内在机制进行进一步探索。
线粒体功能障碍在调节DM患者糖脂代谢和心功能障碍中担任着重要角色[13]。据此我们提出假说:高糖通过促进线粒体功能障碍诱导心肌细胞肥大,而线粒体功能可以通过检测MMP的变化来评价[14-15]。因此,我们分别检测了不同组心肌细胞的MMP,与前人研究结果[14-15]一致,高糖诱导乳大鼠原代心肌细胞MMP降低,提示高糖作用下心肌细胞出现线粒体功能障碍。
目前认为线粒体动力学异常参与多种心血管疾病的过程[16],重建线粒体融合-分裂平衡可能为心血管疾病的防治提供新的参考资料[17]。由此,我们设想线粒体分裂异常参与了高糖诱导的心肌细胞肥大的过程。线粒体分裂主要受胞浆Drp1调控,Drp1的Ser616 位点磷酸化水平升高或Ser637 位点磷酸化水平降低都能促进线粒体分裂增加[18]。本研究结果显示高糖诱导心肌细胞的p-Drp1(s616)水平升高,而p-Drp1(Ser637)水平降低,表明高糖导致心肌细胞线粒体分裂增加,提示线粒体分裂增加可能促进了高糖诱导的心肌细胞肥大,为了进一步证明该结论,我们加入线粒体分裂抑制剂Mdivi-1对原代心肌细胞进行预处理3 h,然后换高糖培养液继续培养72 h。通过量效实验显示,Mdivi-1干预浓度为1 μmol/L、3 μmol/L、5 μmol/L和10 μmol/L均可以显著逆转高糖诱导的ANP表达水平增加,据此本项工作后续研究Mdivi-1的作用机制采用的干预浓度为10 μmol/L。已有研究表明,Mdivi-1是线粒体分裂的特异性阻断剂,通过抑制Drp1的GTP酶活性抑制线粒体分裂[19],而Drp1活性增加主要与Ser616位点磷酸化增加,Ser637位点磷酸化水平降低有关[20]。因此为了验证线粒体分裂增加促进高糖诱导心肌细胞肥大这一假说,需首先明确本研究中Mdivi-1抑制线粒体分裂的内在机制,研究结果明确了Mdivi-1阻断高糖诱导的心肌细胞肥大的内在机制是通过降低Drp1在Ser616位点磷酸化水平同时促进Ser637位点的磷酸化,抑制其GTP酶活性,从而降低线粒体分裂,最终缓解高糖诱导的心肌细胞肥大,进一步证明了高糖诱导的心肌细胞肥大与线粒体分裂增加密切相关。
综上所述,本研究通过原代分离培养乳大鼠心肌细胞,建立高糖诱导的心肌细胞肥大模型,在细胞和蛋白分子水平上,证实了高糖诱导心肌细胞肥大的机制,与Drp1在Ser616位点磷酸化水平升高、Ser637位点磷酸化水平降低导致的线粒体分裂增加有关。
