PSMA-a10/TGX221纳米胶粒对人前列腺癌细胞株的靶向性研究
2020-02-03刘厚先姚立锋江文聪张栋胡嘉盛蒋军辉程跃严泽军
刘厚先 姚立锋 江文聪 张栋 胡嘉盛 蒋军辉 程跃 严泽军
肿瘤靶向性治疗是当今医学研究的热点,其基本原理是通过载体使药物选择性地在肿瘤组织聚集,增加肿瘤组织中的药物浓度,同时减少其在非靶向部位的聚集,降低药物对非靶向部位的毒副反应。前列腺癌(prostatic cancer,PCa)是男性最常见的恶性肿瘤之一,每年PCa的发病率占男性所有新发肿瘤的20%[1]。对于早期的局限性病变,可通过根治性前列腺切除术达到临床治愈;但是对于中晚期PCa,手术治疗后还要联合放疗、化疗和内分泌治疗等手段,但这些治疗方法存在用药顺应性差、组织选择性差、毒副反应大、耐药性较高等一系列问题[2]。因此,亟需找到一种能特异性地抑制PCa生长和转移且很少或几乎无毒副反应的全新疗法。笔者前期研究显示,前列腺特异性膜抗原(PSMA)适配子a10(PSMA-a10)/磷脂酰肌醇 3- 激酶(PI3K)p110β抑制剂TGX-221纳米胶粒具有良好的肿瘤靶向特异性和生物相容性[3-4]。因此,本文就该纳米胶粒对PSMA阳性及阴性人PCa细胞株生物学特性的影响以及其对PCa细胞的靶向性及相应机制作进一步探讨,为PCa靶向治疗提供实验依据。
1 材料和方法
1.1 主要试剂和仪器 RPMI1640(500 ml,180110A)、胰蛋白酶(100 g,170224)购自美国 Sigma公司;FBS(100 ml,180425)购自杭州四季青公司;细胞计数试剂盒[CCK-8,100 T(1 ml),20180315]、ECL 显色试剂盒(100 ml,180322)购自上海碧云天生物技术有限公司;Transwell小室(3422,180120)购自美国 Coring公司;聚丙烯乙二醇(PPG,10 g,171027)、TGX-221(2 mg,170907)购自美国Cayman Chemical公司;蛋白质提取试剂盒(250 ml,180311)购自美国 Pierce公司;PI3K p110β 兔抗人多克隆抗体(50 μl,171124)购自美国Abcam公司;Bcl-2兔抗人多克隆抗体(0.2 ml,20171029)购自美国Santa Cruz公司;碘化丙啶(10 mg,20170831)、甲基噻唑(MTT)溶液(5 ml,20170805)、细胞凋亡检查试剂盒(Annexin V/FITC,20 T,171014)、Bcl-2兔抗人多克隆抗体二抗(1 mg/100 mg,20170930)购自武汉谷肽生物公司;PSMA-a10/TGX-221纳米胶粒由本课题组合成,合成方法参考文献[3]。倒置相差显微镜(ckx41)购自日本Olympus公司;凝胶成像分析仪(Q550IW)购自德国LEICA公司;酶标仪(Multiskan FC)购自美国Thermo Fisher Scientific公司。
1.2 细胞株及细胞培养 PSMA阳性的人PCa细胞株LNCaP购自美国典型菌种保藏中心,PSMA阴性的人PCa细胞株PC-3购自武汉大学典型培养物保藏中心。分别培养于含10%FBS+青霉素100 U/ml+链霉素100 mg/L的RPMI1640培养液中,细胞在相对湿度为95%、37℃、5% CO2的环境中单层生长,每3 d换液传代1次,取对数生长期细胞用于实验。
1.3 细胞抑制率检测 采用CCK-8法。将LNCaP细胞、PC-3细胞分别按5×103个/孔接种至96孔板,培养24 h后弃培养基,分别加入不同浓度的PSMA-a10/TGX-221 纳米胶粒(0、0.1、1.0、2.0、4.0、8.0 和 16.0 μM)和裸露 TGX221(0、0.1、1.0、2.0、4.0、8.0 和 16.0 μM),每孔加入100 μl,每种浓度各设置3个复孔,对照组加入等体积的PPG,分别干预24 h。每孔再加入10 μl的CCK-8溶液继续培养1 h,用酶标仪检测各组细胞在450 nm处的吸光度(A450),细胞抑制率=[1-实验组A450/对照组A450]×100%,绘制细胞抑制率曲线,计算药物半数抑制浓度(IC50),以 PSMA-a10/TGX221 IC50的1/2为最合适的干预浓度用于后续实验。本实验重复3次。
1.4 细胞凋亡率检测 采用流式细胞术。取对数生长期的LNCaP细胞、PC-3细胞,细胞密度均调整为1×108个/L,接种于6孔板,待细胞贴壁。2种细胞分别设置 3个药物干预组(100 μl/孔),即 PSMA-a10/TGX221组、TGX221组、PPG组;LNCaP细胞中给药浓度为1.5 μM,而PC-3细胞中给药浓度为7.0 μM。收集悬浮细胞,4℃预冷的PBS漂洗2次,用预先稀释好的结合缓冲液制成浓度为1×106个/ml的单细胞悬液,然后取 100 μl置于 5 ml流式管中,加入 Annexin V/FITC、10 mg/L碘化丙啶各5 μl,混匀后于室温避光孵育15 min,在反应管中加入稀释后的结合缓冲液400 μl,应用流式细胞术检测1×104个细胞,再采用Cell Quest软件分析各组细胞凋亡情况。本实验重复3次。
1.5 细胞生长指数检测 采用MTT法。取对数生长期的LNCaP细胞、PC-3细胞,胰蛋白酶消化,调整为浓度1×103个/ml的单细胞悬液,按 150 μl/孔接种至 96 孔培养板,在37℃、5% CO2孵箱中培养24 h,待细胞贴壁。药物干预方式及分组同1.4所述。每天各组取3孔,采用MTT比色法进行检测(参照波长630 nm、检测波长570 nm),根据测定的吸光度(A)绘制细胞生长曲线。A值越小,表示细胞生长速度越慢。
1.6 细胞侵袭能力检测 采用Transwell小室法。药物干预方式及分组同1.4所述。2种细胞经药物处理24 h后,0.25%胰蛋白酶消化,计数并调整细胞浓度为2×105个/ml。然后以无血清RPMI 1640培养液稀释Matrigel胶,并铺到Transwell上室,37℃孵育5 h制作基底膜。上室加入各组细胞500 μl,下室加入含有5 g/ml纤维粘连蛋白的RPMI 1640培养基,37℃孵育24 h,弃上室液体,用棉签擦尽上室上层未穿过Matrigel胶的细胞,加入95%甲醇固定30 min并风干,0.1%结晶紫37℃染色30 min。在100倍光镜下随机取5个视野计数并取均值,即肿瘤细胞侵袭数,侵袭数越大表示细胞侵袭能力越强。每个标本检测3次。
1.7 PI3K p110β、Bcl-2蛋白表达检测 采用Western blot法。药物干预方式及分组同1.4所述。2种细胞经药物处理24 h后,使用M-PERTM哺乳动物蛋白提取试剂盒提取总蛋白,12 000 g离心15 min,将上清液转管,置于-80℃冻存。8% SDS-聚丙烯酰胺凝胶电泳,上样量为30 μg总蛋白。电泳完毕后,使用电转移仪将样品转至PVDF膜。用含5%脱脂奶粉室温封闭2 h,分别加入PI3K p110β 抗体和 Bcl-2抗体(均为 1∶1 000)、β-actin抗体(1∶2 000)4 ℃过夜,第 2天用 TBST清洗 5 min×3次。洗膜,加入辣根过氧化物酶标记的羊抗兔抗体(工作浓度 1∶1 000),室温下作用2 h。再次清洗5 min×3次,洗膜,ECL显影,凝胶成像系统分析条带的灰度值。使用图像分析仪测定各条带的积分吸光度(IA),IA=平均吸光度×面积。
1.8 统计学处理 采用SPSS 16.0统计软件。计量资料用±s表示,两组比较采用两独立样本t检验;多组比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 PSMA-a10/TGX-221纳米胶粒及TXG221的IC50比较 PSMA-a10/TGX221、TGX221作用于LNCaP细胞24 h 的 IC50分别为(3.1±0.7)、(4.9±1.1)μM,差异有统计学意义(P<0.05),细胞抑制率曲线见图1a;两者作用于PC-3细胞的IC50均为(13.5±2.3)μM,差异无统计学意义(P>0.05),细胞抑制率曲线见图1b。以PSMA-a10/TGX221 IC50的1/2为最合适的干预浓度,后续实验中LNCaP细胞的PSMA-a10/TGX221、TGX221给药浓度均为 1.5 μM,PC-3 细胞的 PSMA-a10/TGX221、TGX221的给药浓度均为7.0 μM。
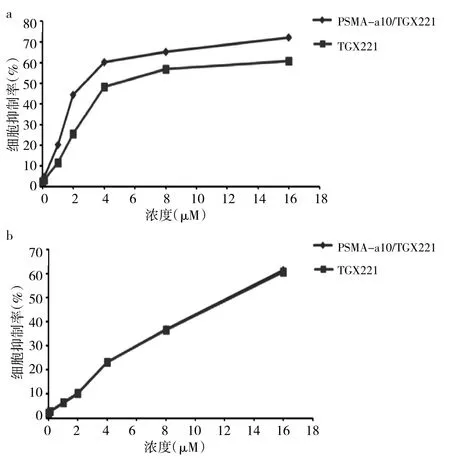
图1 不同浓度PSMA-a10/TGX221和TGX221作用于LNCaP、PC-3细胞24 h后的细胞抑制率曲线(a:LNCaP细胞;b:PC-3细胞;PSMA-a10为前列腺特异性膜抗原适配子a10)
2.2 不同药物干预组细胞凋亡率比较 LNCaP细胞中,3组细胞凋亡率比较,差异有统计学意义(P<0.05),其中TGX221组、PSMA-a10/TGX221组明显高于PPG组(均P<0.05),而PSMA-a10/TGX221组又明显高于TGX221组(P<0.05);PC-3细胞中,3组细胞凋亡率比较,差异亦有统计学意义(P<0.05),其中TGX221组、PSMA-a10/TGX221组明显高于PPG组(均P<0.05),但PSMA-a10/TGX221组与TGX221组比较差异无统计学意义(P>0.05),见表 1。
2.3 不同药物干预组细胞生长指数比较 LNCaP细胞中,常规培养第1~3天3组细胞生长指数比较,差异均无统计学意义(均P>0.05);第4~7天TGX221组、PSMA-a10/TGX221组细胞生长指数均低于PPG组(均P<0.05);第 5~7天 PSMA-a10/TGX221组细胞生长指数明显低于TGX221组(均P<0.05)。PC-3细胞中,常规培养第1~4天3组细胞生长指数比较,差异均无统计学意义(均P>0.05);第 5~7天 TGX221组、PSMA-a10/TGX221组细胞生长指数均低于PPG组(均P<0.05),而PSMA-a10/TGX221组与TGX221组比较,差异均无统计学意义(均P>0.05),见表2。
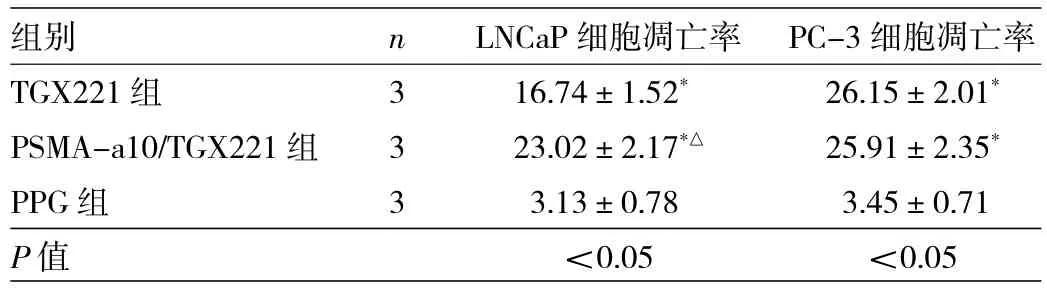
表1 不同药物干预组细胞凋亡率比较(%)
2.4 不同药物干预组细胞侵袭数比较 LNCaP细胞中,3组细胞侵袭数比较,差异有统计学意义(P<0.05),其中TGX221组、PSMA-a10/TGX221组明显低于PPG组(均P<0.05),而PSMA-a10/TGX221组又明显低于TGX221组(P<0.05);PC-3细胞中,3组细胞侵袭数比较,差异亦有统计学意义(P<0.05),其中TGX221组、PSMA-a10/TGX221组明显低于 PPG组(均P<0.05),但PSMA-a10/TGX221组与TGX221组比较差异无统计学意义(P>0.05),见表3和图2(插页)。

图2 不同药物干预后LNCaP细胞、PC-3细胞的侵袭实验结果(PPG为聚丙烯乙二醇,PSMA-a10为前列腺特异性膜抗原适配子a10;a:LNCaP 细胞;b:PC-3 细胞;×100)
2.5 不同药物干预组PI3K p110β、Bcl-2蛋白相对表达量比较 LNCaP细胞中,3组PI3K p110β、Bcl-2蛋白相对表达量比较,差异均有统计学意义(均P<0.05),其中TGX221组、PSMA-a10/TGX221组明显低于PPG组(均P<0.05),而PSMA-a10/TGX221组又明显低于TGX221组(均P<0.05);PC-3细胞中,3组 PI3K p110β、Bcl-2蛋白相对表达量比较,差异亦均有统计学意义(均P<0.05),其中 TGX221组、PSMA-a10/TGX221组明显低于PPG组(均P<0.05),但PSMA-a10/TGX221组与TGX221组比较差异均无统计学意义(均P>0.05),见表4和图3。
3 讨论
研究表明,PI3K的亚型p110β在PCa组织和细胞株中超高表达,在雄激素刺激的细胞增殖和雄激素受体介导的基因表达中发挥关键作用[4]。Bcl-2蛋白是一种“存活”蛋白,在细胞正常增殖的情况下,Bcl-2过度表达能抑制细胞凋亡,延长细胞寿命,促进细胞生存,从而引起细胞异常积累,增加细胞其他基因突变机会或使突变基因在细胞内集聚,导致细胞恶性转化。另一方面,Bcl-2通过抑制细胞凋亡,增加肿瘤细胞数,导致肿瘤的发生、发展[5]。Bcl-2在PCa中高表达,抑制Bcl-2的表达可以抑制肿瘤细胞增殖和诱导细胞凋亡,延缓肿瘤侵袭和转移[6]。有研究证实,p110β和Bcl-2在肿瘤发生、发展过程中发挥协同作用,两者的表达水平密切相关[7]。由于TGX221难溶于水,当静脉注射时需要有机溶剂PPG,而PPG有明显的心脏毒性,使TGX221在临床上的应用受到了限制[8]。本课题组合成的纳米胶粒载体能增加目标分子的水溶性,且不含潜在有害的表面活化剂及辅药如二甲基亚砜、PPG等,在安全定向运输抗癌药方面具有较高的应用价值[9]。
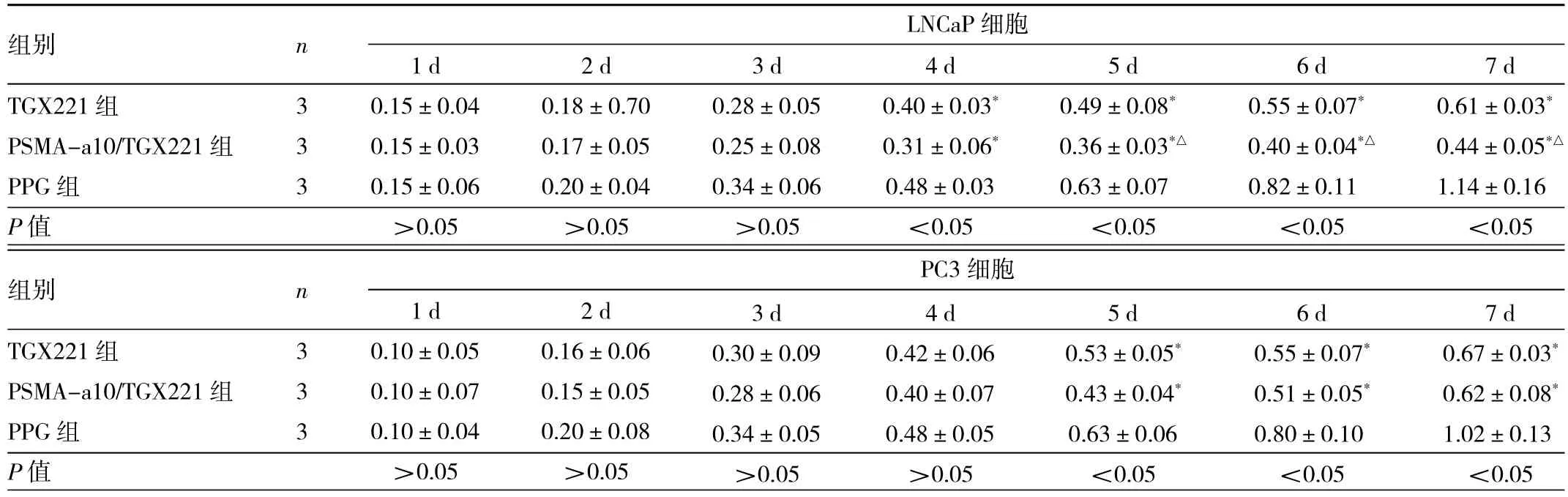
表2 不同药物干预组细胞生长指数比较
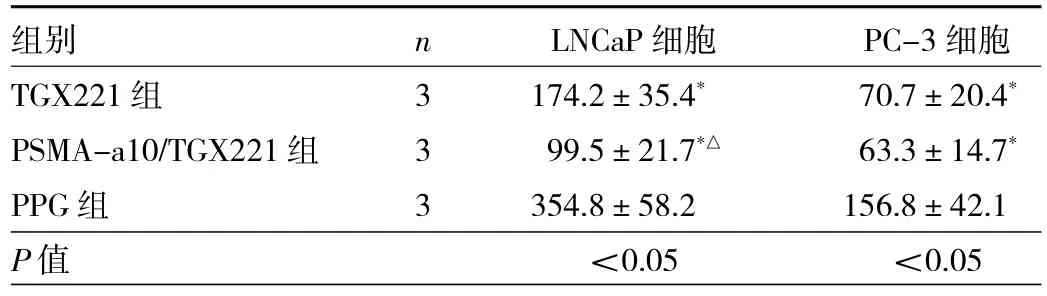
表3 不同药物干预组细胞侵袭数比较(个)
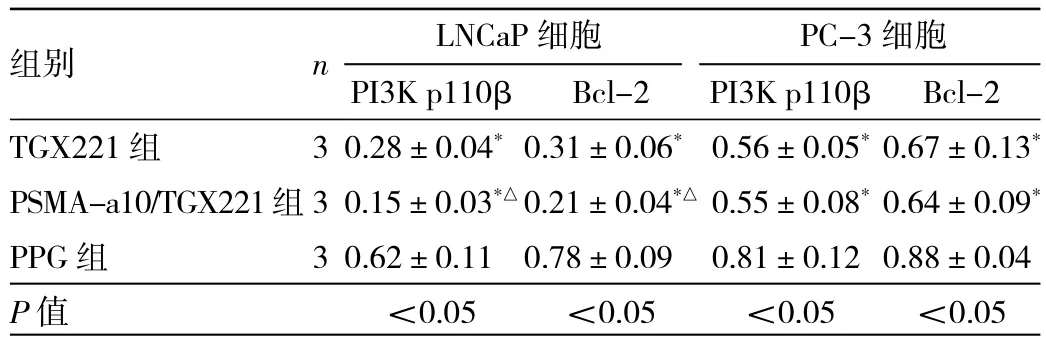
表4 不同药物干预组PI3K p110β、Bcl-2蛋白相对表达量比较
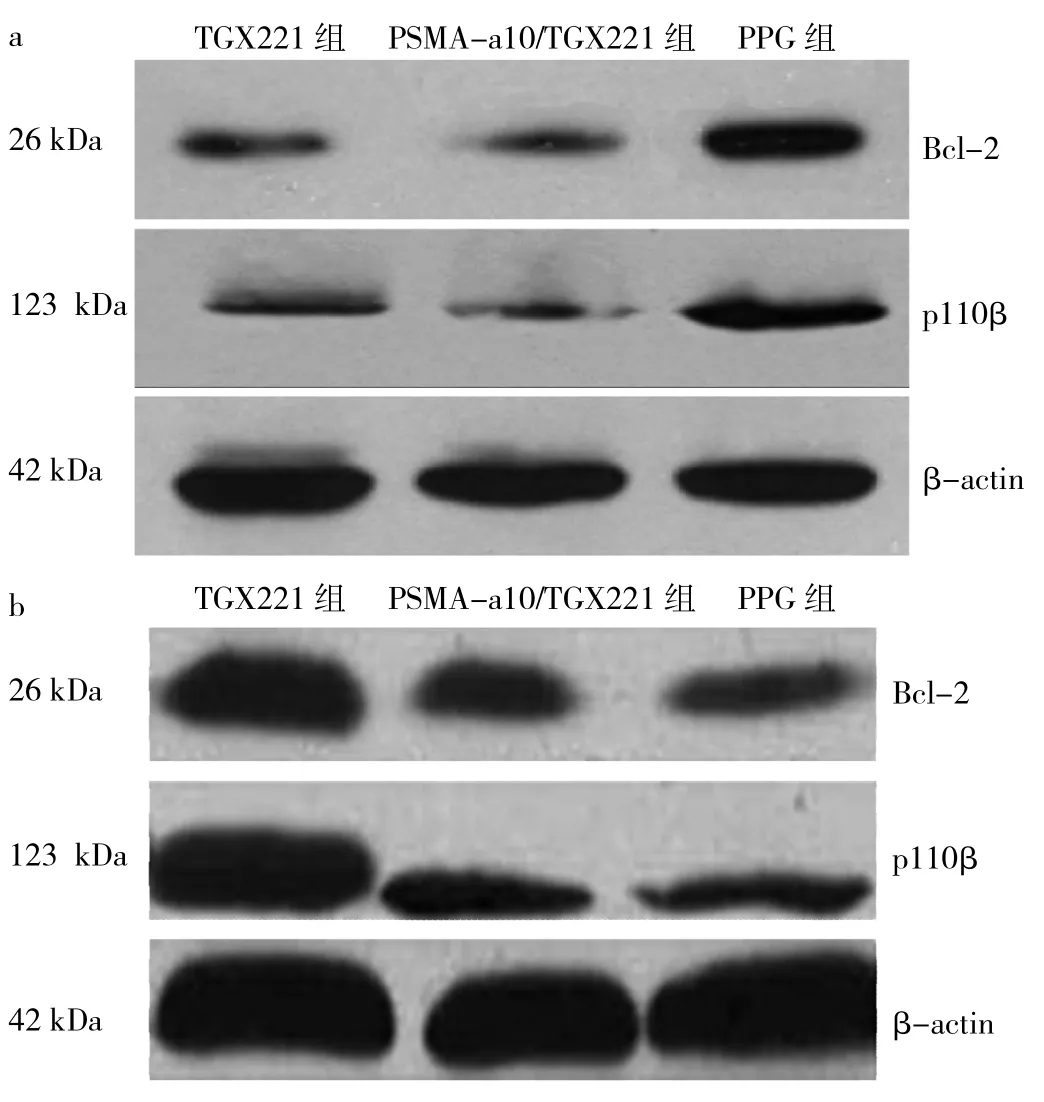
图3 不同药物干预后LNCaP细胞、PC-3细胞PI3K p110β及Bcl-2蛋白表达的电泳图(PI3K为磷脂酰肌醇3-激酶,PSMA-a10为前列腺特异性膜抗原适配子a10,PPG为聚丙烯乙二醇;a:LNCaP细胞;b:PC-3细胞)
PSMA是一种特异性地表达于前列腺上皮细胞表面(脑、唾液腺和小肠等组织中极少量表达)的抗原,且表达不受激素分泌的影响。在晚期PCa和转移性PCa中,PSMA表达升高尤为明显。目前PSMA已被用于分子显像诊断、肿瘤疫苗开发和靶向药物传递等PCa诊断和治疗的靶点[10-12]。尤其是以PSMA为靶点、RNA合成的适配子的成功开发,使得PSMA的应用前景更加广阔[13]。核酸配体或适体是一种RNA或DNA分子,此分子通过核酸碱基间的互补配对,折叠出序列特异性的独特构象,然后通过表面电荷和构象特征与特定蛋白靶点结合。适配子是短的单链寡核苷酸,没有免疫原性及毒性,一旦适配子序列确定,即能大批量合成,并可以整合到其他微粒上,使之具备靶向特异性的药物传递特征[14]。PSMA-a10的氨基末端能进行化学链接,且不影响其活性。
本研究应用PSMA-a10/TGX221纳米胶粒作用于PSMA阳性及阴性的人PCa细胞株(LNCaP细胞、PC-3细胞),并与TGX221、PPG干预结果进行比较,结果发现在PSMA阳性的LNCaP细胞株中,与TGX221相比,PSMA-a10/TGX221的IC50更低,诱导细胞凋亡的能力更强,同时也能更好地抑制癌细胞增殖和侵袭。然而,在PSMA阴性的PC-3细胞株中,虽然PSMA-a10/TGX221和TGX221都能抑制肿瘤细胞的不良生物学行为,但这种抑制效应差异不明显。Western blot检测结果显示,与PPG组、TGX221组相比,PSMA-a10/TGX221组LNCaP细胞中p110β、Bcl-2蛋白相对表达量明显降低;而在PC-3细胞中,与PPG组相比,PSMA-a10/TGX221组、TGX221组p110β、Bcl-2蛋白相对表达量明显降低,但PSMA-a10/TGX221组和TGX221组比较差异无统计学意义。因为TGX221是一种对p110β具有高度特异性的小分子抑制剂,所以细胞中p110β的表达水平可以间接反映TGX221在细胞中的浓度。以上结果提示PSMA-a10/TGX221只对PSMA阳性的PCa细胞具有靶向性。
综上所述,PSMA-a10/TGX221纳米胶粒对PSMA阳性的PCa细胞具有靶向特异性,可能通过抑制p110β的活性、降低Bcl-2表达来抑制癌细胞的不良生物学行为。
