超声引导下小剂量凝血酶注射治疗股动脉假性动脉瘤疗效分析
2020-02-01梁晓秋曹凌玲陈溢旭
梁晓秋,曹凌玲,陈溢旭,王 焱,杜 昊
(成都市第五人民医院超声医学科,四川 成都 611130)
随着临床血管介入技术的发展以及围手术期抗凝、溶栓药物的应用,医源性假性动脉瘤(Pseudoaneurysm,PSA)的发生率呈明显上升趋势[1]。小部分医源性PSA 可自愈,多数需进一步治疗,尤其是使用抗凝/抗血小板药物的患者,一旦确诊应尽快处理[2]。治疗方法有局部压迫、超声引导下精准压迫、超声引导下动脉瘤旁生理盐水注射、超声引导下凝血酶注射以及外科修补等,目前以凝血酶注射治疗为主[3-5],但凝血酶的浓度和用量均无统一标准。本研究回顾性分析在我科行超声引导下凝血酶(浓度250 U/mL)注射治疗PSA 的疗效,探讨小剂量凝血酶(用量≤500 IU)注射在PSA 中的应用价值。
1 资料与方法
1.1 研究对象
2017 年11 月—2019 年12 月,在我院行股动脉穿刺诊疗后,因出现穿刺部位疼痛、肿胀、闻及血管杂音或触及搏动性肿块等行彩超检查明确的24 例右侧股动脉PSA 患者。男10 例,女14 例,年龄39~80 岁,平均(66.7±11.0)岁。瘤体直径1.0 cm×0.8 cm~5.8 cm×3.4 cm,单纯型(1 个瘤腔)19 例,复杂型(2个及以上瘤腔)5 例。股总动脉3 例,股浅动脉17例,股深动脉4 例,均为一个破口且无动静脉瘘形成。所有患者否认过敏史,但均有抗凝和(或)抗血小板药物的使用史,术前签署手术知情同意书。
1.2 仪器与材料
本研究采用飞利浦公司的IU22 超声诊断仪,探头型号L12-5、C5-1;使用日本八光20G×150 mm PTC 穿刺针。
1.3 药品及配置
凝血酶冻干粉(湖南一格制药有限公司,500 IU/支,由牛提取),0.9%氯化钠注射液2 mL 与1 支凝血酶冻干粉配制成浓度为250 IU/mL 的凝血酶溶液,用1 mL 注射器抽取1 mL 凝血酶溶液备用,每次治疗量不超过1 000 IU。
1.4 操作方法
超声引导下凝血酶注射操作由一名高年资医师和一名护士共同完成。常规超声检查方法:患者平卧位,患侧大腿外旋、外展位,充分暴露病变处,超声检查观察瘤体的位置、大小、形态、内部回声,与载瘤动脉的关系,确定进针路径,进针点位于腹股沟韧带下方,避免穿刺入腹腔。采用血管横切扫查,同时显示瘤颈和瘤体。穿刺点确定后,常规碘伏消毒铺巾,使用2%盐酸利多卡因行皮下麻醉,采用徒手穿刺平面内进针法,穿刺针从远离瘤颈的瘤腔底部进入,拔出针芯立即接上备好的凝血酶溶液,在彩色多普勒超声的监视下避开瘤颈部缓慢注入,每次注入0.1~0.2 mL,同时按压瘤颈部,以减小分流血流。每次注入凝血酶溶液后观察瘤腔内血流情况,适时调整针尖方向,直至瘤腔内血流消失。复杂型PSA 优先封堵近端瘤体(最靠近瘤颈的瘤体),如无法穿刺近端瘤腔,则穿刺下一个最近的瘤腔,近端瘤腔封闭后远端瘤腔自然封闭。术后采用“∞”字包扎法,患肢制动12 h,记录凝血酶用量(图1~4)。
1.5 随访
术后24 h、1 周复查彩超了解瘤腔内血流及相邻血管血流情况。
1.6 统计学分析
采用SPSS 17.0 软件进行统计分析。计量资料用均数±标准差()表示。
2 结果
2.1 凝血酶用量
本组24 例PSA 患者凝血酶用量为25~500 IU,平均(180±107)IU,其中单纯型25~250 IU,平均(145±70)IU,复杂型225~500 IU,平均(315±121)IU。
2.2 治疗效果
术后2 例患者(1 例单纯型、1 例复杂型)瘤颈部仍可见少许血流信号,经压迫24 h 后,1 例单纯型PSA 瘤颈部血流消失,1 例复杂型PSA 行二次注射封堵后瘤颈部血流消失,单纯型一次成功率为100.0%(19/19),复杂型一次成功率为80.0%(4/5)。术后1 周复查彩超,24 例患者均无再通,1 次治疗成功率为95.8%,总成功率为100.0%,患者局部疼痛较前均明显缓解。
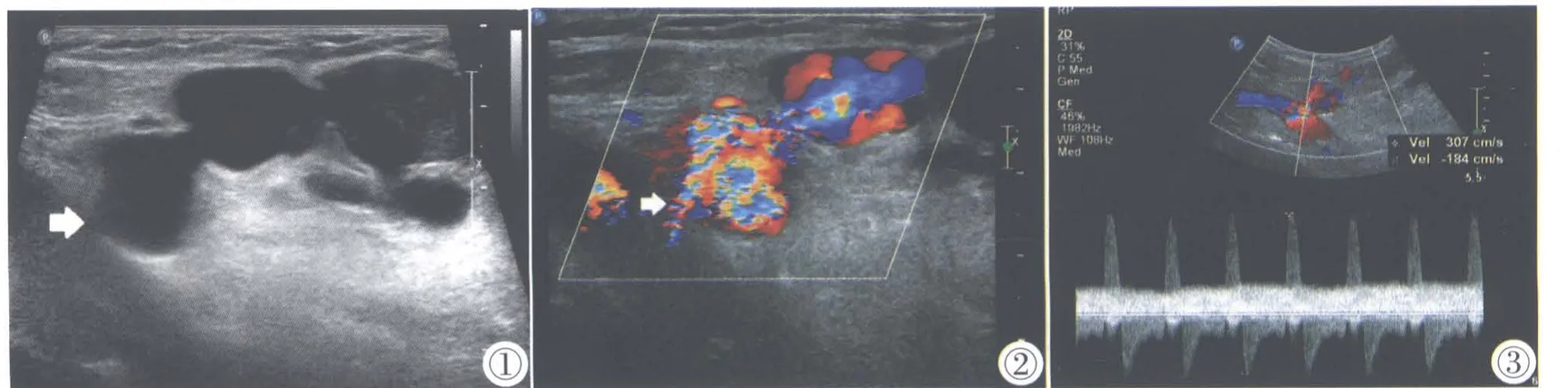

图1 灰阶超声显示多房的假性动脉瘤体。图2 CDFI 示假性动脉瘤腔内源于股总动脉的漩涡状彩色血流。图3 PW 测及往返于瘤颈部的双相(收缩期和舒张期)血流频谱。图4 UGTI 术后,瘤腔及瘤颈部未见血流信号(箭头所指为瘤颈部)。Figure 1.Gray-scale ultrasound showed several cavities of the PSA. Figure 2.CDFI showed swirling colorful blood flow from the common femoral artery in the PSA cavity. Figure 3.Biphasic(systolic and diastolic) blood flow spectrum to and from the neck of the PSA. Figure 4.No blood flow signal was found in the PSA cavity and neck after UGTI(arrow refers to tumor neck).
2.3 不良反应
本组仅2 例患者出现不良反应,1 例术中发生短暂血管迷走神经性晕厥,考虑为过度紧张所致;1例术后40 min 出现寒战、发热(39 ℃)、全身皮疹、下肢花斑、低血压,考虑凝血酶过敏反应,经静脉补液、5 mg 地塞米松静推后缓解,无严重并发症发生。
3 讨论
PSA 是因外力作用导致动脉壁缺损,血液在血管周围形成的一个瘤样结构,是血管介入术后常见的并发症,发生率约0.3%~8%[3]。PSA 形成的因素主要包括抗血小板药物的使用、肥胖、粗大的鞘管,其次是操作者的技术水平、高血压、严重的动脉硬化及血液透析等[5]。多数PSA 不能自愈,并不断增大而发生并发症,最严重的并发症是急性破裂和远端栓塞,其次是疼痛、肿胀、瘤腔感染、周围组织压迫等[1]。早期干预意义重大,局部压迫及超声引导下压迫虽然有一定疗效,但耗时长,成功率低,复发率高,患者疼痛明显[6],对于瘤体>6 cm、肥胖及使用抗凝/抗血小板药物的患者治疗成功率更低[6-7]。超声引导瘤颈旁生理盐水注射治疗有成功案例[9],但相关报道极少,应用价值不明确[10]。外科修补术主要适用于活动性出血、神经压迫症状、局部感染、远端肢体缺血或超声引导下凝血酶注射失败的患者,易并发神经、肌腱损伤[3]。
相比其它几种方法,超声引导下凝血酶注射具有快速、微创、安全、成功率高(达91%~100%)等优点,是股动脉PSA 首选的治疗方法[10]。超声引导下凝血酶注射治疗成功率与操作者的经验密切相关,与瘤腔数目、瘤体大小呈负相关[11],凝血酶用量与成功率无关,而用量的多少却是引起栓塞和过敏的关键因素[12-13]。凝血酶注射时要避开瘤颈部,从远离瘤颈的瘤腔底部缓慢注入。本组19 例单纯型PSA 均一次性封堵成功,5 例复杂型PSA 有4 例一次性封堵成功,另1 例因患者体伴,瘤腔较多,经二次注射封堵成功,总治疗成功率高,并发症少。凝血酶最大用量500 IU,明显低于以往的文献报道[14-16],说明小剂量凝血酶注射治疗PSA 有效,Kurzawski 等[17]和Shin等[18]的研究也有同样的结果。复杂型PSA 的治疗多数文献报道采用从远端瘤腔依次向近端瘤腔封堵的方法[1,9,19],本研究的方法不需反复进针,减少了凝血酶用量,因此降低了栓塞和过敏的风险。本研究结果表明,抗凝/抗血小板药物的使用并未影响超声引导下凝血酶注射结果,与文献报道的观点一致[1,2,6-7]。超声引导下凝血酶注射术后包扎及患肢的制动对防止动脉瘤再灌注非常重要[19],本组患者术后采用“∞”字包扎,患肢严格制动,未见复发病例。需要注意的是PSA 宽颈(瘤颈宽>1 cm)是凝血酶注射的禁忌[14]。
超声引导下凝血酶注射在PSA 封堵中的价值得到认可,但存在一定的并发症,主要并发症是血管栓塞和凝血酶过敏反应。动脉微栓塞是指因凝血酶渗漏导致小动脉栓塞产生的麻木、刺痛、轻微疼痛等症状[9],无需治疗,本组中未见相似症状的患者出现。如血管栓塞导致肢体缺血或发现感觉和运动功能下降,则需紧急干预。肺栓塞多发生于伴发动静脉瘘的患者,需紧急处理。凝血酶引起的严重过敏反应作为一种潜在的致命性并发症,通常被忽略,其相关报道较少,仅查阅到3 篇关于严重并发症的文献[14-16],另有少数轻型凝血酶过敏反应的报道[20-21]。几例严重过敏反应的患者凝血酶用量为500~1 000 IU(浓度500~1 000 IU/mL),主要症状有下肢发麻、呼吸急促、低血压、心跳骤停等,其中2 例死亡病例均为长期透析的慢性肾病患者。操作医生要警惕透析患者对凝血酶过敏的风险更高[14],注意术前询问凝血酶接触史,避免严重过敏反应发生。自体凝血酶或重组凝血酶是凝血酶过敏患者的理想选择,但不易获取[9,14]。
本研究存在的不足:①复杂型PSA 病例数偏少,凝血酶用量、治疗效果和并发症发生率尚有待进一步研究。②本研究为回顾性研究,未设计随机对照组,但研究结果与先前一些研究结果一致。今后将进行前瞻性对照研究,使研究结果更有说服力。
综上,超声引导下小剂量凝血酶注射治疗PSA安全、有效,值得在临床推广。
