筛选特异性抑制酿酒酵母产孢的人类基因
2020-01-19中西秀树李子杰张慧杰藤田盛久高晓冬
殷 政, 中西秀树, 李子杰, 张慧杰, 藤田盛久*, 高晓冬
(1.江南大学 生物工程学院,江苏 无锡214122;2.江南大学 糖化学与生物技术教育部重点实验室,江苏无锡214122)
酵母与哺乳动物细胞同为真核生物,二者具有很多相似的结构,将酵母作为研究人类基因的工具具有巨大的优势。 酵母细胞遗传背景清晰、培养简单、基因操作技术成熟完备,极大降低了哺乳动物细胞各种复杂的生理过程对蛋白质研究的干扰。1987 年,Lee 和Nurse[1]在裂殖酵母中表达了人类cDNA, 筛选得到能回补裂殖酵母cdc2Δ 缺陷的直系同源蛋白质,证明人类细胞中具有与真菌细胞周期基因CDC2 相同功能的基因。该实验表明,利用酵母作为筛选人类基因的工具并对基因功能进行研究具有广泛的应用前景及巨大的研究价值。 此外,实验室之前的研究[2]将酵母SSO1 的SNARE 区域替换为人源syntaxin1A, 通过突变分析得到回补产孢的突变体, 发现218 位谷氨酸残基为SSO1 产孢功能所必须,并且为筛选与syntaxin1A 作用的蛋白质或药物提供了更为简便的方法,同时表明人类的某些基因确实可以参与产孢过程中的某些环节并对其产生影响,并且可以对该基因功能研究和对酵母产孢过程的彻底研究带来新的进展和突破。
酿酒酵母二倍体细胞在缺乏氮源且存在非发酵型碳源的条件下, 为了应对营养匮乏的不利环境,营养细胞停止生长[3],进入减数分裂过程并产生4 个单倍体细胞核[4-5]。 随后细胞质膜通过高尔基体分泌囊泡(post-Golgi secretory vesicles)重新定位在纺锤体极体 (spindle pole bodies), 形成前孢子膜(prospore membrane)且不断延伸,最后前孢子膜闭合形成未成熟的孢子[6-8]。 接着在前孢子膜的表面进行孢子壁的组装,孢子壁组装完成标志着成熟孢子的形成。 孢子壁具有四层结构,从里到外分别是甘露糖层、β-葡聚糖层[9]、壳聚糖层和二酪氨酸层[10],其中二酪氨酸层作为孢子形成过程的最后一环,同时赋予孢子抵御外界环境压力的能力[11-13]。 由于二酪氨酸层的存在,孢子在10%的氨水缓冲液下使用UV 照射具有自荧光特性[12]。
酿酒酵母的产孢过程虽然并不存在于哺乳动物细胞中,但该过程中发生的很多细胞活动在真核细胞中都存在保守性。 基因组测序表明,酵母有大量的基因与人类同源[14],尤其是基本细胞代谢及分裂有关的基因存在着高度的基因保守性[15-17]。 人体中重要的蛋白质很多都是在酵母中先被发现其同源物,其中包括有关细胞周期的蛋白质、信号蛋白质和蛋白质加工酶等[18]。
本研究建立了一个筛选特异性抑制酿酒酵母产孢过程的人类基因的方法,使用实验室构建的带有人类基因的酵母表达质粒pRS426-TEFprgeneX,在二倍体酿酒酵母中表达单独的人类基因。利用二酪氨酸层具有自荧光特性,通过实验证明孢子的相对荧光强弱可以直接反映产孢率的高低,将相对野生型孢子的荧光强弱作为酿酒酵母产孢过程是否发生抑制的判断标准,筛选出不影响酵母营养细胞生长的同时能特异性抑制产孢过程的人类基因,并进行初步的研究。 筛选获得的候选基因极大可能涉及细胞营养敏感性、减数分裂以及膜运输重组这些产孢过程中发生的细胞活动,同时哺乳动物细胞中这些相关的功能和调节机制尚未完全清楚,具有极大的研究价值。
1 材料与方法
1.1 实验材料
1.1.1 菌株和质粒酿酒酵母AN120 野生型菌株、dit1Δ 缺陷型菌株、AN117-4B 野生型菌株、 大肠杆菌T1 噬菌体抗性菌株、 大肠杆菌DH5α 以及质粒相关信息见表1。
1.1.2 培养基LB 培养基:酵母提取物10 g,胰蛋白胨10 g,氯化钠10 g,纯化琼脂粉20 g(固体培养基), 用去离子水定容至1 L,121 ℃高压灭菌20 min后使用。
SD-Ura 培养基:无氨基酵母氮源(YNB) 6.7 g,纯化琼脂粉20 g(固体培养基),用去离子水定容至900 mL,121 ℃高压灭菌20 min,使用前分别加入2 g 缺少尿嘧啶(Uracil)的氨基酸混合物与100 mL 已灭菌的20%的葡萄糖溶液。
YPAD 培养基:酵母提取物10 g,蛋白胨A 20 g,腺嘌呤硫酸盐30 mg, 用去离子水定容至900 mL,121 ℃高压灭菌20 min, 使用前加入100 mL 已灭菌的20%的葡萄糖溶液。
YPACe 培养基:酵母提取物10 g,蛋白胨A 20 g,醋酸钾20 g,腺嘌呤硫酸盐30 mg,用去离子水定容至1 L,121 ℃高压灭菌20 min。
产孢培养基:醋酸钾20 g,纯化琼脂粉20 g(固体培养基),用去离子水定容至1 L,121 ℃高压灭菌20 min 后使用。
1.2 实验方法
1.2.1 pENT221 entry vector 提取在提前灭菌过的10 mL 离心管中加入2 mL 含有Kan 抗性的LB液体培养基, 将保存有人cDNA 文库的96 孔板从-80 ℃冰箱中取出, 冰上静置10 min, 每孔吸取10 μL 菌液接入含有Kan 抗性的LB 液体培养基中,37 ℃、220 r/min 过夜培养。 离心收集所有菌体,使用生工购买的SanPrep 柱式质粒DNA 小量抽提试剂盒提取质粒,并于-20 ℃下保存。
1.2.2 酵母表达质粒的构建由于作者所在实验室购买的人cDNA 文库原始克隆载体无法在酿酒酵母中表达,所以为了能在酿酒酵母中表达人类基因用于筛选,本研究构建了含有attL1/2 交换序列的pRS426-TEFpr destination vector,与含有人类cDNA和attR1/2 交换序列的原始克隆载体pENT221 entry vector 进 行LR 重 组 反 应, 在 室 温 下 将1~7 μL pENT221 entry vector (50 ~150 ng/μL) 与1 μL pRS426-TEFpr destination vector(150 ng/μL)在离心管里混合, 用pH 8.0 的TE Buffer 补齐至8 μL。 将LR Clonase II enzyme mix 从-20 ℃取出,冰上静置2 min,短暂振荡LR Clonase II enzyme mix 两次。 每个样品 (除了阴性对照) 加入2 μL LR Clonase II enzyme mix,两次短暂振荡混匀,25 ℃反应1 h。 反应结束后对每个反应加入1 μL 蛋白酶K 溶液,37 ℃反应10 min,转化1~2 μL 反应产物进入DH5α 大肠杆菌宿主,涂布在kan 抗性的LB 平板上,37 ℃过夜培养。
1.2.3 重组质粒的验证挑取转化得到的单个转化子,接入2 mL Kan 抗性的LB 液体培养基中,37 ℃、220 r/min 过夜培养。 离心收集所有菌体,使用生工购买的SanPrep 柱式质粒DNA 小量抽提试剂盒提取质粒,根据购买cDNA 文库所附带的对应人类基因序列, 找出每个重组质粒内具有的BamH I 和EcoR I 限制性酶切位点的位置和数量。 用10 μL 酶切体系 (1 μL 重组质粒,1 μL 10×K Buffer,0.1 μL BamH I,0.1 μL EcoR I,7.8 μL ddH20)在37 ℃反应2 h,核酸电泳(120 V,20 min,1 000 maker)验证重组质粒是否正确。

表1 本研究使用的菌株与质粒Table 1 Strains and plasmids used in this study
1.2.4 检测不同产孢率的酿酒酵母在UV 下的荧光强度为了检测产孢率与UV 照射下荧光强度的关系,利用单倍体酵母无法产孢的特性,将双倍体酿酒酵母AN120 与单倍体酿酒酵母AN117-4B 按照不同比例混合,经过产孢培养从而形成高低不同的产孢率。 将双倍体和单倍体野生型酿酒酵母分别接种到5 mL YPAD 液体培养基中,过夜培养,通过测定OD660调整AN120 与AN117-4B 的菌液至相同浓度,按照2∶8,5∶5,8∶2 的比例混合两种菌液,分别取20 μL 点在YPAD 固体培养基上,置于30 ℃恒温培养箱中培养16 h。 将已灭菌的中速定性滤纸贴合在新的YPAD 固体培养基上,影印之前点板培养得到的菌落,使得酵母菌株影印到滤纸上,置于30 ℃恒温培养箱中培养8 h。 将滤纸以及滤纸上的酿酒酵母菌落一并转移到产孢固体培养基上, 置于30 ℃恒温培养箱中培养24 h。 取出滤纸浸润在10%的氨水缓冲液中并置于干净透明的塑料器皿中,使用凝胶成像仪拍摄UV 下的荧光照片,使用Image J 软件处理图片并测定荧光强度。 同时挑取菌落重悬在无菌水中,显微镜下统计酿酒酵母营养细胞和孢子球的数量,计算产孢率。
1.2.5 重组质粒转化到酿酒酵母接种酿酒酵母AN120 到5 mL YPAD 培养基(试管)中,30 ℃、220 r/min培养10 h, 转接1 mL 菌液到80 mL 液体YPAD 培养基(250 mL 三角瓶)中,30 ℃、220 r/min 过夜培养至OD660在1.2~1.6 之间,使用50 mL 离心管离心收集菌体,无菌水洗一遍,重悬于20 mL 酵母一步转化液 (2 mL、2 mol/L LiAc,2 mL、1 mol/L 二硫苏糖醇,16 mL 50% PEG)中,振荡混匀,于96 孔板每孔加入100 μL 菌液和1 μL 重组质粒(0.1 ng/μL),45℃孵育30 min。每孔取两次10 μL 菌液点在SD-Ura固体培养基上,30 ℃培养3 d。
1.2.6 筛选导致产孢缺陷的人类基因挑取转化得到的表达了人类cDNA 的酿酒酵母单菌落,重悬于10 μL 无菌水,点在SD-Ura 固体培养基上,置于30 ℃恒温培养箱中培养16 h。将已灭菌的中速定性滤纸贴合在新的SD-Ura 固体培养基上, 影印之前点板培养得到的菌落,使得表达了人类基因的酵母影印到滤纸上,置于30 ℃恒温培养箱中培养12 h。将滤纸以及滤纸上的酿酒酵母菌落一并转移到产孢固体培养基上, 置于30 ℃恒温培养箱中培养24 h。分析方法同1.2.4,通过与表达了空质粒pRS426-TEFpr 的野生型酿酒酵母AN120 对比荧光强度,筛选出在酿酒酵母中表达导致荧光强度明显降低的候选人类基因,筛选过程见图1。
1.2.7 复筛得到的候选基因将筛选到的人类基因重新转化酿酒酵母AN120,转化过程同1.2.5。 为了检测初筛得到的候选人类基因在酿酒酵母中表达是否会影响营养细胞的生长,挑取转化得到的表达了人类基因的酿酒酵母单菌落在SD-Ura 固体平板划线培养, 将表达了空质粒pRS426-TEFpr 的野生型酿酒酵母AN120 作为对照,30 ℃恒温培养箱中培养36 h 后进行对比。同时为了检测在酿酒酵母表达候选人类基因是否稳定抑制产孢过程,将转化得到的单菌落接入5 mL SD-Ura 液体培养基中,30 ℃、220 r/min 培养16 h, 将100 μL 菌液转接到5 mL YPACe 培养基种,30 ℃、220 r/min 培养20 h, 离心收集菌体,用无菌水洗涤两次,测量OD660并以此调整接入产孢液体培养基中的菌液浓度约为3×107个/mL,30 ℃、220 r/min 培养24 h 进行产孢过程。取10 μL 菌液点在血球计数板上, 光学显微镜下观察统计酿酒酵母营养细胞和孢子球的数量,分别统计三次取平均值计算产孢率。
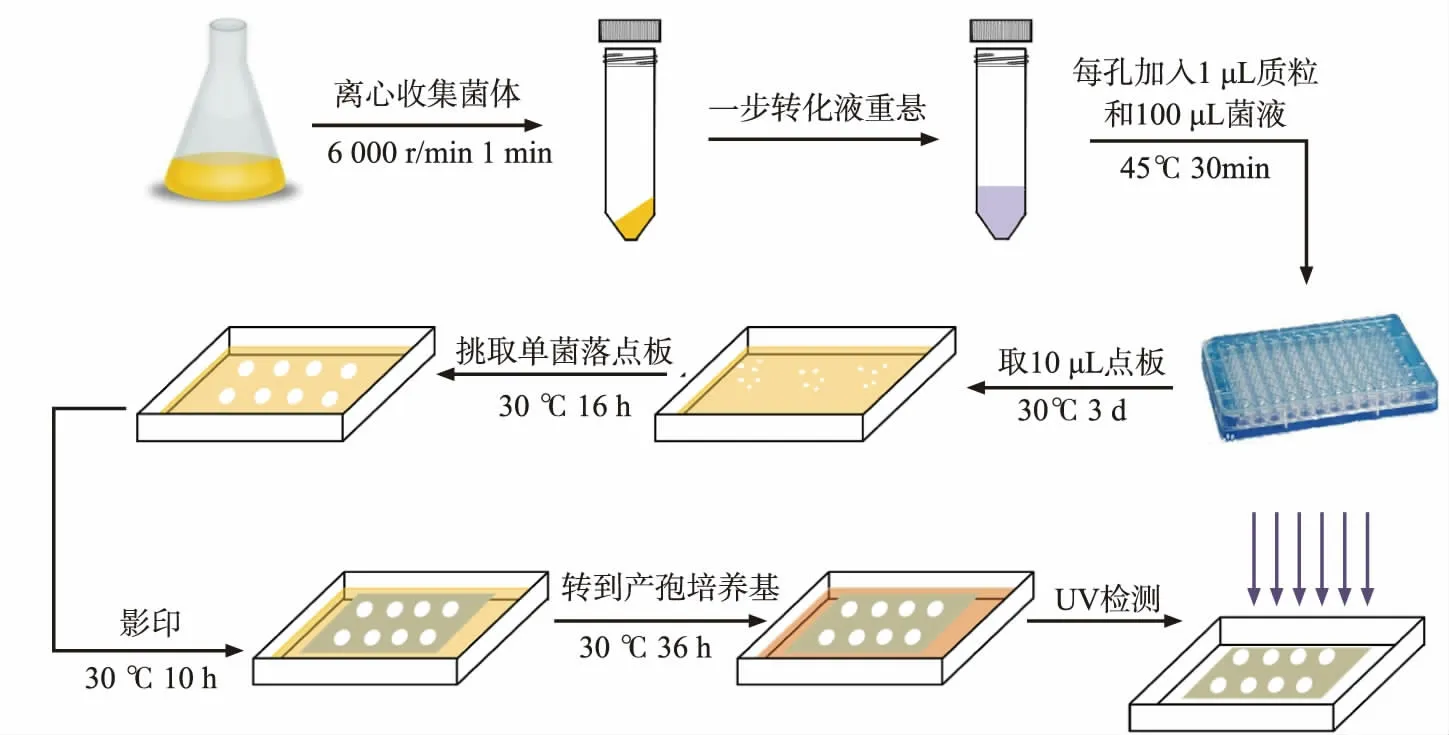
图1 抑制酿酒酵母产孢的人类基因筛选过程Fig. 1 Screening of human genes specifically inhibits sporulation
1.2.8 DPAI 染色酿酒酵母表达了候选基因导致的产孢过程缺陷,可能是因为减数分裂过程受到抑制或发生了孢子壁形成缺陷。 为了判断产孢过程缺陷的酿酒酵母是否进入减数分裂过程,将筛选得到的候选人类基因转入酿酒酵母中进行产孢培养,产孢方法同1.2.7。离心收集孢子,用无菌水洗涤2 次,重悬于70%乙醇,30 ℃、30 min 对孢子进行固定。用无菌水洗涤两次, 重悬在500 μL 无菌水中并加入0.5 μL、1 mg/mL DAPI 母液,室温下避光放置20 min进行染色。 用无菌水洗涤两次,重悬于适量无菌水中, 使用荧光显微镜观察DAPI 染色结果并统计进入减数分裂过程的酿酒酵母比例。
2 结果与讨论
2.1 筛选方法的确立
2.1.1 酵母表达质粒的构建作者所在实验室前期购买的人类cDNA 文库的克隆载体无法在酵母中表达, 因此作者在实验室保藏的酵母表达质粒pRS426-TEFpr 中加入attR1/2 位点和ccdB 筛选标记,构建得到pRS426-TEFpr destination vector,利用cDNA 文库中原质粒载体pENTR221 中含有的attL1/2 交换位点, 通过LR 重组反应, 将原质粒载体pENTR221 中的人类基因重组至酵母表达质粒pRS426-TEFpr 中。转化DH5α 大肠杆菌菌株,涂布在LB-Amp 固体培养基上, 通过Amp 抗性筛选去除原pENTR221 质粒载体, 通过ccdB 基因筛选去除未能完成重组的pRS426-TEFpr destination vector,最后通过酶切验证,得到可以在酿酒酵母内表达人类基因的质粒载体pRS426-TEFpr-geneX,并用于之后的筛选。
2.1.2 酿酒酵母产孢率与荧光强度的关系为了验证酿酒酵母产孢率与二酪氨酸层荧光强度之间的关系,将相同浓度的双倍体酿酒酵母AN120 和单倍体酿酒酵母AN117-4B 菌液按照2∶8,5∶5,8∶2 的比例混合并点板,随后进行产孢培养,以得到不同的产孢率, 同时单独使用酿酒酵母菌株AN120、AN117-4B、dit1Δ 作为对照, 产孢培养结束后测定荧光强度并且统计产孢率。 如图2 所示,双倍体酿酒酵母AN120 有着最高的产孢率和荧光强度,无法产孢的单倍体酿酒酵母AN117-4B 与二酪氨酸缺陷型酿酒酵母dit1Δ 有着最低的荧光强度, 混合菌液点板得到的不同产孢率的酿酒酵母荧光强度随着产孢率的提高荧光强度也随之增强。
实验结果证明,酿酒酵母在产孢培养后荧光强度的强弱可以作为判断酿酒酵母产孢过程中是否发生缺陷的判断标准。 作者分析产孢培养后酿酒酵母的荧光强度,通过与野生型酿酒酵母孢子的荧光强度进行对比,筛选导致产孢过程发生缺陷的人类基因作为候选基因,该基因有极大可能抑制酿酒酵母的减数分裂过程或导致孢子壁缺陷。
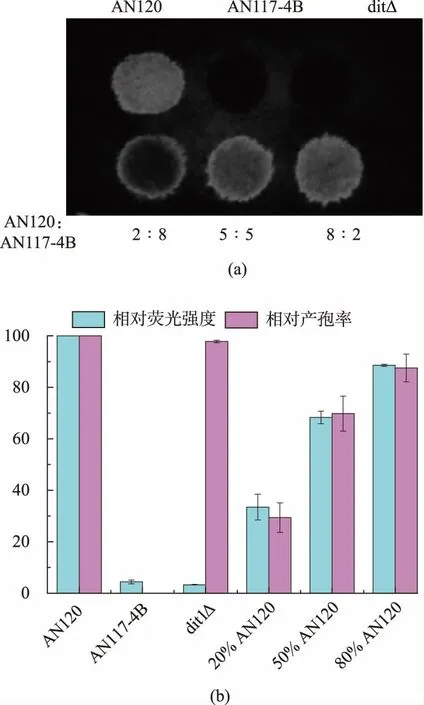
图2 酿酒酵母产孢率与荧光强度关系Fig. 2 Relate of sporulation rate and fluorescence intensity
2.2 筛选抑制产孢过程的人类基因
本研究将含有人类基因的酵母表达质粒pRS426-TEFpr-geneX 转入酿酒酵母中, 挑选表达了人类基因的单个转化子重悬在无菌水中,在SDUra 固体平板上点板培养, 以转入pRS426-TEFpr空质粒的酿酒酵母AN120、AN117-4B、dit1Δ 作为对照。 用带有滤纸的新的SD-Ura 固体平板进行影印,等滤纸上长出菌落后将滤纸转到产孢培养基上培养,取出带有菌落的滤纸,浸润在10%氨水缓冲液中,使用凝胶成像仪拍摄UV 照射下的荧光照片。
使用Image J 软件分析荧光强度, 筛选出荧光强度显著低于AN120 野生型菌株的转化子,将其表达的人类基因作为筛选得到的候选基因。 如图3 所示, 表达了CXCL10,CDC14A,ACP6 这3 个基因的酿酒酵母荧光强度明显低于野生型酿酒酵母AN120。 如图4(a)所示,同时挑取表达了这3 个基因的菌落用无菌水重悬,显微镜下统计产孢率。 如图4(b)所示,统计得到的产孢率高低顺序与荧光强弱顺序结果一致, 其中表达了ACP6 基因的酿酒酵母同时具有最低的荧光强度和产孢率,因此这3 个基因可以作为候选基因。
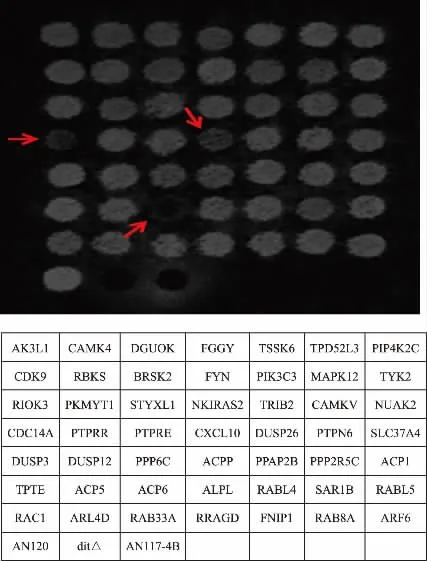
图3 UV 照射下的荧光筛选照片Fig. 3 Fluorescence intensity detect by UV
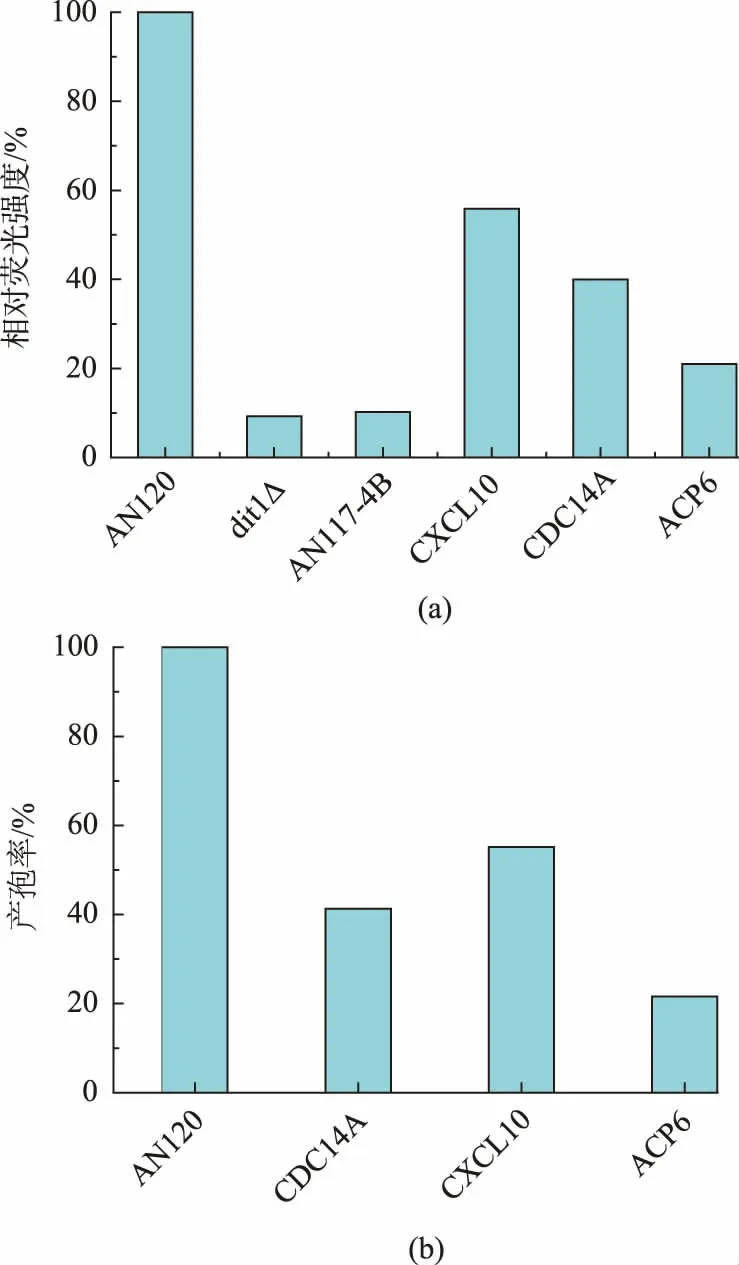
图4 酿酒酵母表达候选基因后的相对荧光强度与产孢率Fig. 4 Relative fluorescence intensity and sporulation rate of the candidate gene expressed yeast
2.3 验证候选基因并初步分析
2.3.1 表达候选基因对酿酒酵母营养生长的影响研究希望筛选得到的候选基因在酿酒酵母中表达只会特异性的抑制酿酒酵母的产孢过程,对酿酒酵母的营养生长不会造成抑制,为此将带有候选基因的质粒的重新转化酿酒酵母,挑取转化子在SD-Ura固体平板上划线培养36 h。 如图5 所示,表达了候选基因CXCL10,ACP6 的酿酒酵母与野生型生长状况相同,对酿酒酵母细胞的生长没有抑制作用。 表达了候选基因CDC14A 的酿酒酵母生长情况相对于野生型受到较弱的抑制, 可能是因为CDC14A(cell division cycle gene14 homolog A) 作为细胞分裂周期蛋白质基因,在酿酒酵母中表达影响了出芽生殖,从而抑制了酿酒酵母细胞的生长。
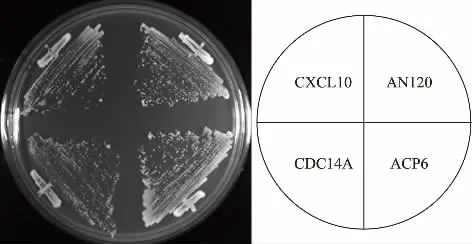
图5 表达候选基因对酿酒酵母细胞生长的影响Fig. 5 Express the candidate gene in yeast cells and detect the effect on yeast growth
2.3.2 检测酿酒酵母产孢率为了确认筛选得到的候选基因对酿酒酵母的产孢过程具有抑制作用,挑选表达了候选基因的转化子并使用液体培养基进行产孢,产孢结束后吸取菌液,显微镜下统计产孢率。 如图6 所示,表达得到的三个候选基因对酿酒酵母产孢过程具有抑制作用,产孢率由高到低分别是表达了CXCL10、CDC14A、ACP6 的酿酒酵母菌株,与之前筛选结果一致,同时也证明该方法筛选得到的结果较为可靠。
2.3.3 DAPI 染色对减数分裂进行检测二倍体酿酒酵母在缺乏氮源且存在非发酵型碳源的条件下,营养细胞会停止生长并进入产孢过程,通过减数分裂产生孢子。 为了研究表达了候选基因导致产孢缺陷的酿酒酵母在产孢过程中是否进入减数分裂过程,我们将表达了候选基因的酿酒酵母进行产孢培养后使用核酸染料DAPI 染色, 统计进入减数分裂过程的酿酒酵母比率,并与产孢率进行对比。如图6所示,表达了CXCL10、CDC14A 基因的酿酒酵母进入减数分裂的比率与产孢率大致相同, 说明表达CXCL10、CDC14A 基因可能导致酿酒酵母无法进入减数分裂过程。 CXCL10(CXC chemokine ligand 10)干扰素诱导蛋白质10 作为趋化因子配体定位于细胞膜上,其在酿酒酵母中表达会抑制产孢过程的原因尚无合理解释。 表达了ACP6(Lysophosphatidic acid phosphatase type6)溶血磷脂酸磷酸酶基因的酿酒酵母进入减数分裂比率明显高于产孢率,证明减数分裂过程已经开始, 之前的研究结果证明,ACP6定位于线粒体上,通过调节线粒体脂类代谢功能从而影响线粒体的功能,表达该基因可能导致减数分裂过程中受到抑制或孢子壁形成过程发生缺陷。

图6 酿酒酵母表达候选基因后的产孢率及产孢过程中进入减数分裂的比例Fig. 6 Sporulation rate and meiosis rate of yeast expressed candidate gene
3 结 语
酵母与同为真核生物的哺乳动物细胞细胞具有很多相似的结构同时具有大量的同源基因,酵母产孢过程中发生的营养敏感性、减数分裂、囊泡重组等细胞活动同样会发生在哺乳动物细胞中。 将酵母作为人类基因的筛选工具,以及研究同源基因功能的模式生物具有巨大的研究价值。 本研究建立的筛选方法利用酿酒酵母对人类cDNA 文库进行筛选,获得在不影响酿酒酵母营养细胞生长的同时特异性抑制酵母产孢过程的人类基因,并通过实验证明了筛选方法的可靠性。 本研究初次筛选的49 个人类基因中发现了3 个对产孢过程造成抑制的人类基因,并且抑制发生在不同的产孢阶段,据此推测应该有相当数量的人类基因会对产孢过程造成影响,因此筛选特异性抑制产孢过程的人类基因具有广阔的研究前景。 本研究对人类新功能基因的发现以及将酿酒酵母作为模式生物研究人类基因提供了新的方法和思路,同时为之后的筛选与研究奠定了基础。
