烟酰胺对PM2.5诱导人永生化角质形成细胞损伤的保护作用研究
2020-01-18樊锦涛
田 军,常 瑛,樊锦涛,杨 励
近年来,大气颗粒物(airborne particulate matter,PM)污染在我国越来越受到重视,直径在2.5 μm 的颗粒PM2.5 是大气颗粒物中污染危害最大的部分,也是构成雾霾的主要成分。2012 年我国新修订的《空气质量标准》增加了PM2.5 的空气监测标准,环境保护部的数据显示,大多数城市秋冬季PM2.5 的24 h 平均浓度明显升高。多年来,关于PM2.5 的基础及流行病学调查主要集中在呼吸及心血管系统,近年PM2.5 与皮肤的相关研究也逐渐多了起来[1,2]。近期,新的研究发现PM2.5 空气污染可以诱发或者加重儿童变态反应性皮肤疾病[3,4]。暴露于高浓度PM2.5 情况下还可以诱发及加重色素沉着与皱纹,引起皮肤老化[5]。此外,研究还发现PM2.5可以明显升高皮肤的氧化应激水平,同时会造成皮肤免疫功能的紊乱[6,7]。烟酰胺是一种维生素B3 的衍生物,也是美容皮肤科学领域公认的皮肤抗老化成分,以往研究发现其抗衰老的机制与其强大的抗氧化功能相关[8,9]。本文以体外培养的人角质形成细胞为研究对象,以PM2.5 诱导细胞损伤,观察烟酰胺对人永生化角质形成细胞(HaCaT)的氧化损伤是否具有保护作用。
1 材料与方法
1.1 材料
1.1.1 实验材料 人永生化角质形成细胞系(HaCaT)(第四军医大学馈赠),烟酰胺(上海信谊药厂有限公司),1640 培养基(Hyclon 生物公司),胎牛血清(Fetal Bovine Serum, FBS)、0.25%胰蛋白酶消化液(含EDTA)(美国Thermo Fisher Scientific 公司GIBCO 品牌),CCK-8 细胞活性检测试剂盒(上海七海复泰生物科技有限公司),活性氧簇(ROS)检测试剂盒、总抗氧化酶超氧化物歧化酶(SOD)检测试剂盒、谷胱甘肽还原酶(GR)检测试剂盒(碧云天公司),Annexin V-FITC / PI 细胞凋亡试剂盒(美国Biolegend 公司)。倒置显微镜(上海光学仪器厂),酶标仪(美国BIORAD),流式细胞仪FACS Calibur(美国BD 公司),空气总悬浮颗粒物采样器(安徽蓝盾光电子股份有限公司)。
1.1.2 细胞培养及处理 HaCaT 用10%胎牛血清的1640 培养基(含100 U/ml 青霉素,100 U/ml 链霉素)37℃,5%CO2恒温培养箱中培养,当细胞达到80%融合时,用0.25%胰蛋白酶、0.05%EDTA 37℃ 5 min消化传代,在显微镜下看见细胞变圆回缩,用10%胎牛血清的1640 培养基终止消化然后以1:3 进行传代。将细胞分为空白对照组、烟酰胺组、50 μg/ml PM2.5 组、100 μg/ml PM2.5 组、200 μg/ml PM2.5 组、50 μg/ml PM2.5+烟酰胺组、100 μg/ml PM2.5+烟酰胺组和200 μg/ml PM2.5+烟酰胺组,烟酰胺溶液于PM2.5 处理前12 h 加入。
1.2 方法
1.2.1 溶液制备 PM2.5 悬液制备:采用空气总悬浮颗粒物采样器采集PM2.5 样品,并将收集好的PM2.5 用生理盐水配制成溶液后置于超声波清洗仪(200 W,40 kHz)中超声振荡15 min,混匀灭菌,高压灭菌后-20℃保存,使用时用完全培养基配制成相应的浓度。烟酰胺溶液:称取PP 纯品4.88 mg,溶于100 ml 1640 培养基中,充分溶解,过滤后-20℃保存备用。使用时稀释成所需的终浓度。
1.2.2 细胞形态观察 倒置显微镜观察处理后各组细胞的形态学变化。
1.2.3 细胞活性检测 向已处理好的 96 孔培养板每孔加10 μl CCK-8 试剂,置于37℃,5% CO2孵箱中孵育 1 h 后,酶标仪测定 490 nm 处各孔A 值(所测得的数据均减去空白对照组的A值 )。按公式计算细胞活性,细胞活性=A490(处理组)/A490(对照组)×100%。
1.2.4 流式细胞仪检测细胞凋亡 处理好的各孔细胞 (1×106)加 入50 μl Binding Buffer 和FITC 标 记的Annexin V(20 μg/ml)5 μl,室温避光30 min,再加入PI(50 μg/ml)2.5 μl,避光反应5 min 后,加入200 μl Binding Buffer,立即用流式细胞仪检测细胞凋亡率。实验重复3 次。
1.2.5 细胞内ROS 水平检测 去除已处理好各孔细胞 (1×106)的培养基,用PBS 洗1 次,加入500 μl DCFH-DA 工作液,37℃细胞培养箱避光孵育20 min,弃上清后用PBS 洗涤2 次,1 000 r/min 离心3 min,加入500 μl PBS 重悬细胞,流式上机检测。以平均荧光强度代表细胞内ROS 水平进行分析。
1.2.6 总SOD 活性检测 收集正常及处理组的HaCaT 细胞,加入100 μl 的样品制备液4℃,1 000 r/min 离心3 min,取上清液作为待测样本。测定BCA 蛋白浓度,根据蛋白浓度和预计的蛋白使用量,缓冲液适当稀释样品,低温配制样本检测体系。检测微孔板置于37℃恒温箱中孵育30 min,酶标仪测定450 nm 波长处的A值。计算样本中总SOD 活力,待测样本中SOD 酶活力单位=抑制百分率/(1-抑制百分率)U, 根据BCA 蛋白定量结果,将SOD 活力单位转化换算为U/mgprot。
1.2.7 GR 检测 同前处理,取上清液待用,配制各孔反应体系,室温静置5 min,酶标仪测定405 nm波长处各孔的A值。按公式计算细胞中GSH 含量(μmol/gprot)=(A测定孔-A空白孔)/(A标准孔-A空白孔)×20 μmol/L×2÷匀浆蛋白浓度(gprot/L)。
1.3 统计学方法
不同浓度损伤组与未处理对照组采用单因素方差分析(one-way ANOVA),加药组与损伤组组间差异比较采用双因素方差分析(two-way ANOVA),当P<0.05 时认为差异有统计学意义。
2 结果
2.1 不同浓度PM2.5 处理组及药物干预组细胞形态学变化
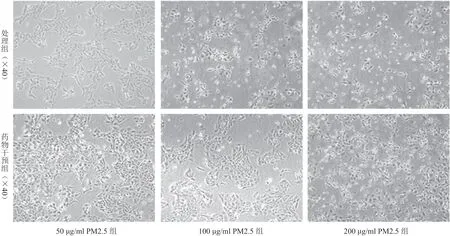
图1 不同浓度PM2.5处理组及药物干预组细胞密度变化
倒置显微镜下观察正常的HaCaT 细胞形态呈树突状,经PM2.5 处理后HaCaT 细胞密度降低,细胞形态发生改变,细胞形态皱缩、细胞树突数量减少或消失,变圆变亮。当处理浓度>100 μg/ml 后,细胞结构明显破坏。加入烟酰胺药物后,漂浮的细胞数量减少,较同浓度PM2.5 处理组细胞树突完整性好,破坏减少,见图1。
2.2 不同浓度PM2.5 对HaCaT 细胞活性的影响及烟酰胺处理后变化
PM2.5 对 HaCaT 细胞活性的影响存在浓度依赖关系,随着PM2.5 浓度增加,HaCaT 细胞的生长活性逐渐降低(对照组vs 50 μg/ml PM2.5 组,P<0.0001;对照组vs 100 μg/ml PM2.5 组,P<0.0001;对照组vs 200 μg/ml PM2.5 组,P<0.0001)。药物干预组仍可观察到细胞活性的下降,但下降的程度明显低于PM2.5 处理组(50 μg/ml PM2.5 组vs 50 μg/ml PM2.5+ 烟 酰 胺 组,P=0.0064;100 μg/ml PM2.5组vs 100 μg/ml PM2.5+ 烟 酰 胺 组,P=0.0301;200 μg/ml PM2.5 组vs 200 μg/ml PM2.5+ 烟 酰 胺 组,P<0.0001)。烟酰胺的加入在一定程度上抑制了细胞活性的下降(图2)。
2.3 不同浓度PM2.5 对HaCaT 细胞凋亡的影响及烟酰胺处理后变化
PM2.5 对 HaCaT 细胞凋亡的影响存在浓度依赖关系,相对于对照组细胞,50 μg/ml PM2.5 处理对HaCaT 细胞凋亡即有显著性改变(P<0.0001),100 μg/ml PM2.5 处理可引起凋亡细胞比例的升高(P<0.0001),200 μg/ml PM2.5 处理对细胞凋亡的改变更加显著(P<0.0001)。加入烟酰胺的药物干预组相较于不同浓度PM2.5 处理组,凋亡细胞比例降低(50 μg/ml PM2.5 组vs 50 μg/ml PM2.5+烟酰胺组,P=0.0459;100 μg/ml PM2.5 组vs 100 μg/ml PM2.5+烟酰胺组,P=0.0265;200 μg/ml PM2.5 组vs 200 μg/ml PM2.5+烟酰胺组,P=0.0075)(图3)。
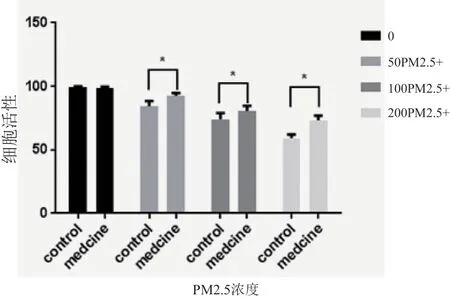
图2 不同浓度PM2.5对HaCaT细胞活性的影响及烟酰胺处理后变化
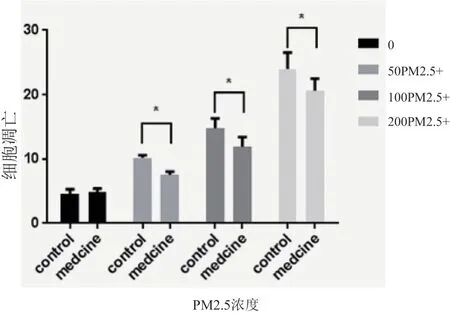
注:* P<0.05
2.4 不同浓度PM2.5 对HaCaT 细胞ROS 水平的影响及烟酰胺处理后变化
PM2.5 可明显升高 HaCaT 细胞ROS 水平,呈浓 度 依 赖 关 系( 对 照 组vs 50 μg/ml PM2.5 组,P=0.0193;对照组vs 100 μg/ml PM2.5 组,P<0.0001;对照组vs 200 μg/ml PM2.5 组,P<0.0001)。加入烟酰胺后,虽不能完全抑制细胞内ROS 水平的升高,但可以在一定程度上降低细胞内ROS 的水平,与同浓度PM2.5 处理组的对比差异具有统计学意义(50 μg/ml PM2.5 组vs 50 μg/ml PM2.5+烟 酰 胺 组,P=0.0359;100 μg/ml PM2.5 组vs 100 μg/ml PM2.5+烟酰胺组,P=0.0338;200 μg/ml PM2.5 组vs 200 μg/ml PM2.5+烟酰胺组,P=0.0149),见图4。
2.5 不同浓度PM2.5 对HaCaT 细胞SOD 水平的影响及烟酰胺处理后变化
实验发现PM2.5 对 HaCaT 细胞SOD 水平的影响存在浓度依赖关系,与对照组相比,PM2.5 处理后细胞SOD 水平降低(对照组vs 50 μg/ml PM2.5组,P<0.0001;对照组vs 100 μg/ml PM2.5 组,P<0.0001;对照组vs 200 μg/ml PM2.5 组,P<0.0001)。给予药物干预后,SOD 值在PM2.5 50 mmol/L 低浓度组上升最明显,药物干预组细胞SOD 水平明显高于同浓度PM2.5 处理组(50 μg/ml PM2.5 组vs 50 μg/ml PM2.5+烟酰胺组,P<0.0001;100 μg/ml PM2.5 组vs 100 μg/ml PM2.5+烟酰胺组,P=0.0003;200 μg/ml PM2.5 组vs 200 μg/ml PM2.5+烟酰胺组,P=0.0010),见图5。
2.6 不同浓度PM2.5 对HaCaT 细胞GR 水平的影响及烟酰胺处理后变化
实验发现PM2.5 对 HaCaT 细胞GR 水平的影响存在浓度依赖关系,随着PM2.5 浓度的增加,细胞GR 水平逐渐降低(对照组vs 50 μg/ml PM2.5 组,P<0.0001;对照组vs 100 μg/mlPM2.5 组,P<0.0001;对 照 组vs 200 μg/ml PM2.5 组,P<0.0001)。 药物干预组细胞在50 mmol/L、100 mmol/L PM2.5 处理浓度下GR 水平明显高于同浓度PM2.5 处理组(50 μg/ml PM2.5 组vs 50 μg/ml PM2.5+烟 酰 胺 组,P=0.0220;100 μg/ml PM2.5 组vs 100 μg/ml PM2.5+烟酰胺组,P=0.0106。),但在200 mmol/L PM2.5 损伤浓度下加药组与同浓度处理组GR 水平未见明显差异(P=0.8442),见图6。
3 讨论
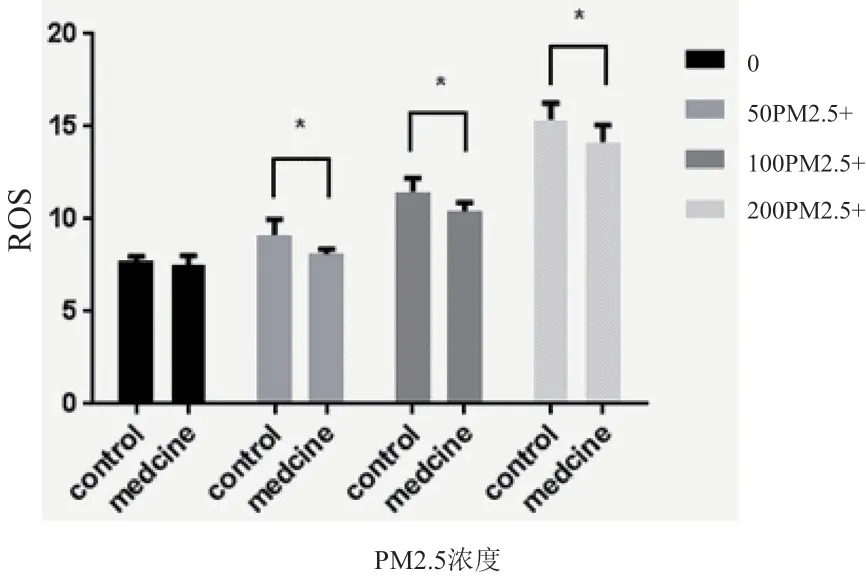
图4 不同浓度PM2.5对HaCaT细胞ROS水平的影响及烟酰胺处理后变化
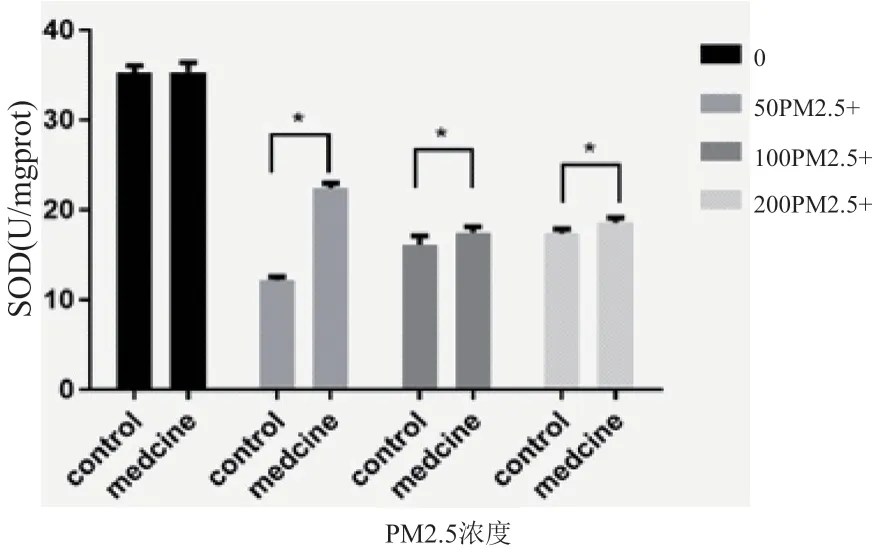
图5 不同浓度PM2.5对HaCaT细胞SOD水平的影响及烟酰胺处理后变化
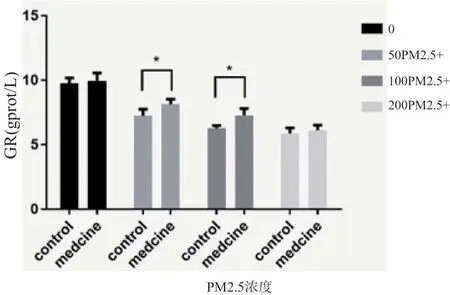
图6 不同浓度PM2.5对HaCaT细胞GR水平的影响及烟酰胺处理后变化
角质形成细胞是暴露在外部环境中皮肤的第一层保护屏障,角质形成细胞也是多种皮肤模型的主要组成部分。前期研究发现PM2.5 表面的有机化合物可以直接渗透至皮肤,影响包含角质形成细胞在内的多种细胞活性。近期的流行病学调查及临床研究表明升高的PM2.5 浓度及皮肤疾病具有一定的相关性,并可以诱发和加重特应性皮炎及湿疹,然而具体机制尚不清楚[10]。人体皮肤中表皮角质形成细胞由基底层逐渐向上移行,逐渐角化,形成表皮的渗透屏障。大气污染物中的PM2.5 可以上调前炎症递质,进一步激活AhR 信号通路,使细胞内的ROS 水平升高[11]。所以,本研究利用角质形成细胞系HaCaT细胞,在体外研究了PM2.5 对人角质形成细胞的活性及凋亡的影响,并进一步观察了氧化应激相关的ROS 水平,抗氧化物酶SOD 及GR 的水平。研究表明PM2.5 可以降低细胞活性呈剂量依赖模式,这与之前在人支气管上皮细胞、脐静脉内皮细胞和肺上皮细胞的研究结果一致[12]。此外,证据表明ROS 升高导致的氧化应激在PM2.5 导致的皮肤疾病中发挥着重要的作用,但具体机制并不明确[13,14]。笔者的研究发现PM2.5 损伤组ROS 明显升高,呈剂量依赖模式。这可能与高浓度的ROS 破坏细胞的抗氧化抵御功能,产生了直接的氧化损伤有关。SOD 是一种抗氧化酶,是氧自由基的清除者。在笔者的研究中PM2.5 损伤组SOD 水平呈现剂量依赖的升高。这与之前的PM作用于A594 细胞的研究结果不完全一致,该项研究发现暴露于PM 中的细胞SOD 水平在较小的浓度刺激下升高,在高浓度刺激下才明显下降[15]。这可能与研究所用PM 大小、浓度及来源不一致有关。前期研究表明高浓度的ROS 可以破坏细胞的氧化-抗氧化平衡,导致氧化应激,进一步激活线粒体凋亡途径,导致细胞的凋亡[16]。本研究发现HaCaT 细胞凋亡率与PM2.5 浓度呈剂量依赖,这与之前呼吸系统PM2.5 作用于相关细胞的实验结果一致[17]。前期研究发现GR 的下调或者缺失可以明显升高机体或细胞的氧化应激敏感性,ROS 的升高也可以明显抑制GR水平[18]。笔者的研究发现GR 水平与PM2.5 浓度呈剂量依赖,可能与PM2.5 的氧化损伤有关。以上结果表明氧化应激可能在PM2.5 诱导的HeCaT 细胞损伤机制中发挥着重要的作用。
烟酰胺作为皮肤科常用药物,在抗衰老方面应用广泛[19,20]。氧化应激与衰老关系密切,既往其他系统研究表明烟酰胺可以降低细胞氧化应激水平,但具体调控机制并不明确,可能与β-烟酰胺腺嘌呤二核苷酸及烟酰胺代谢相关[21]。还有研究表明烟酰胺可以明显降低衰老细胞的ROS 水平,并降低衰老表型的表达,推测其可能机制是烟酰胺激活了线粒体自噬,但研究发现烟酰胺降低ROS 水平是在线粒体减少之前,所以烟酰胺通过线粒体自噬途径降低ROS 也有争议,而且目前也没有证据证明烟酰胺可以直接清除细胞内ROS[8]。本研究从现象入手,通过观察氧化应激、抗氧化酶及活性与凋亡指标,研究烟酰胺对于PM2.5 诱导的HeCaT 细胞氧化损伤的影响。研究表明,在相同浓度PM2.5 暴露下,烟酰胺药物干预组细胞活性、抗氧化酶SOD 及GR 水平均高于处理组,氧化应激指标ROS 水平与凋亡比例低于处理组。其中200 mmol/L PM2.5 损伤浓度下药物干预组与同浓度处理组GR 水平未见明显差异,这可能与PM2.5浓度过高,细胞内抗氧化物质消耗,不能及时清除氧自由基,引起了脂质过氧化,导致合成GR 关键细胞器损伤有关。以上研究结果提示烟酰胺具有保护HaCaT 细胞,降低PM2.5 损害的作用,但具体机制仍需进一步研究。
