再植枸杞根际真菌群落对长期连作的响应研究*
2020-01-15马少兰马彩霞徐鹏鑫郑国琦纳小凡
马少兰 马彩霞 徐鹏鑫 郑国琦 纳小凡
(宁夏大学生命科学学院,银川 750021)
宁夏枸杞(Lycium barbarumL.)是茄科枸杞属多年生落叶灌木,广泛分布于中国、韩国、日本、欧洲、北美和地中海等地区的干旱和半干旱区域[1]。由于近期研究证实宁夏枸杞果实(枸杞子)具有抗衰老、保护神经、消炎、促进代谢、控制血糖、免疫调节及抗肿瘤等多种生物学活性[1-2],枸杞子已作为食品和营养保健品在亚洲及欧美等多国零售市场中销售[3-5]。受国际市场追捧,枸杞种植业已成为我国西北省份,尤其是宁夏出口创汇的优势富民产业之一,为地区经济发展做出巨大贡献[6]。
然而,受枸杞自身生长特点及传统种植模式影响,枸杞连作障碍现象已成为限制枸杞产业可持续发展的主要因素之一,严重影响了枸杞园土地生产力和枸杞生产效益,导致农民收入下降。通过多年的田间调查和实验,纳小凡等[6]研究发现种植超过十年的枸杞园开始出现枸杞子产量和品质降低、病虫害加重等现象。对连作地再植枸杞生长的分析也表明,连作能够显著抑制再植枸杞生长,证实了枸杞连作障碍现象的存在[7]。张俊华和郑国琦[8]对不同种植年限枸杞园土壤线虫群落的分析发现,树龄超过9年后枸杞园土壤线虫群落的多样性下降,且植物寄生性线虫的相对比例明显增加。通过对连作地再植枸杞根际土壤细菌群落的分析也表明,连作显著抑制再植枸杞根际土壤细菌群落多样性并导致细菌群落结构发生显著变化[7]。这些研究均表明长期传统种植模式下,枸杞园土壤理化性质及土壤生物环境的变化可能是导致枸杞连作障碍的主要原因,但其作用机制目前仍不清楚。
作为土壤微生物区系的重要成员,土壤真菌与其他微生物一起参与土壤生态系统中物质循环和能量流动[9-10]。研究发现,真菌群落能够通过互惠共生、病害及营养物质吸收和循环等方式影响陆生植物群落的多样性和组成[11]。除此以外,土壤真菌还能够通过固氮、植物激素分泌、病原菌防护和提高植物抗旱等生物学过程影响植物生理状况[12-14]。因此研究土壤真菌群落多样性及其演替规律,对于探索土壤可持续利用措施及保持土壤健康至关重要[14-15]。本研究基于前期对连作地再植枸杞根际土壤细菌群落的研究,进一步利用实时荧光定量PCR 和高通量测序技术,分析连作对再植枸杞根际/非根际土壤真菌群落丰度及多样性的影响,为深入理解枸杞连作障碍机制提供新的理论信息。
1 材料与方法
1.1 研究区概况
试验地位于银川市北郊20 km 的南梁农场,该地区主要气候类型为中温带干旱气候,年均气温在7.9~8.6℃之间,昼夜温差大,年均降雨量约为145.5 mm,无霜期在129~177 d 之间。样地土壤类型为砂壤土。
1.2 试验设计
在实验区域内选取连续种植10年的枸杞田和无枸杞种植史的设施农业用地,分别将其设置为连作及对照样地。连作及对照枸杞园土壤基础理化性质如下:pH 分别为5.2 和6.4;电导率199.7 和1006 μS·cm-1;有机碳9.7 和12.9 g·kg-1;全氮0.9和0.8 g·kg-1;碱解氮46.7 和30.1 mg·kg-1;铵态氮13.9 和13.7 mg·kg-1;硝态氮30.3 和20.6 mg·kg-1;全磷0.9 和0.8 g·kg-1;有效磷48.9 和12.3 mg·kg-1;速效钾260.7 和309.1 mg·kg-1。
挖去连作样地枸杞,连作及对照样地经整理后于2012年4月种植一年生枸杞苗(宁杞1 号),行距3 m、株距1 m,样方面积666 m2,枸杞田间管理与前期研究一致[6]。2016年8月采集宁夏枸杞根际、非根际土壤样本(最后一茬枸杞果实采摘后)。实验田内随机设置3 个样方(10 m×10 m),每个样方内随机选取10 株枸杞,利用土钻在距离枸杞茎20 cm 处采集0~20 cm 深度土壤;同时挖取枸杞根(直径小于2 mm),抖去浮土后放入无菌离心管。合并同一样方内的根际土及非根际土,置于冰盒保存。非根际土过2 mm 筛去杂物并充分混匀,留取1 g鲜土于-20℃保存用于提取DNA;剩余土样经风干后用于土壤理化性质分析[6]。根际土壤采用纳小凡等[6]的方法获得。土壤DNA 按照Power SoilTMDNA提取试剂盒说明提取。所提DNA 经琼脂糖凝胶电泳检测合格后分为三份,一份用于前序研究对 16S rDNA V4 区段的测序[6],一份用于本研究中真菌ITS2 区段的测序,一份保留至-20℃用于qRT-PCR测定16S rDNA 和18S rDNA 基因丰度。
1.3 真菌ITS2 区段高通量测序及数据分析
采用两步扩增法对真菌的ITS2 区段进行扩增,第一步扩增法引物序列分别为 5′-TCCGTAGGTGA ACCTGCGC-3′和 5′-TCCTCCGCTTATTGATATGC- 3′。扩增产物经稀释后用于第二步扩增反应的模板,引物序列分别为 5′-GCATCGATGAAGAACGCAG C-3′和5′-TCCTCCGCTTATTGATATGC-3′。扩增条件为:98℃,预变性1 min;98℃,变性10 s;50℃,退火30 s;72℃,延伸1 min;30 个循环。72℃,延伸5 min。PCR 扩增完成后,应用 Illumina HiSeq 2500 基因组分析平台对真菌基因ITS2 区段进行测序。
1.4 实时荧光定量PCR
所提土壤基因组DNA 中16S rDNA(细菌)和18S rDNA(真菌)基因丰度利用QuantStudio™5实时定量荧光PCR 系统(Thermo Fisher Scientific,USA)进行。所用细菌引物为Eub338(ACTCCTAC GGGAGGCAG CAG)和Eub518(ATTACCGCGGCT GG),真菌引物为Fu18s1(GGAAACTCAGGTCCA GA)和Nu-SSU-1536(ATTGCAATGCYCTATCCC CA)。PCR 反应体系体积为20 μL,其中包括SYBRPremix Ex Taq(Takara,大连,中国)10 μL、上下游引物各1 μL(10μmol·L-1)、DNA 模板2 μL、ROX 0.4 μL、无菌去离子水5.6 μL。细菌用两步法进行扩增,扩增程序为:95℃预变性30 s,在95℃变性5 s, 60℃退火和延伸34 s。真菌用三步法进行扩增,扩增程序如下:95℃预变性30 s,95℃变性5 s,50℃退火30 s,72℃延伸30 s,循环40 次。细菌和真菌溶解曲线按照QuantStudio 5 实时荧光定量检测系统默认程序分析:95℃变性15 s,60℃复性60 s,95℃复性15 s。将含16S rDNA 和18S rDNA 基因片段的重组质粒DNA 梯度稀释,并分别以此为模板制备16S rDNA 和18S rDNA 基因扩增标准曲线,计算土壤DNA 样本中相应基因的绝对含量。
1.5 统计分析
不同样品间数据的显著性分析由SPSS(22.0)中的单因素方差分析完成(Turkey test,n=3)。真菌营养型预测利用FUNGuild数据库进行对比检索[16]。土壤理化因子与土壤真菌群落结构变化的关系利用Canoco(5.0)中基于距离的冗余分析(db-RDA) 完成。作图使用Origin 9.0 软件。
2 结 果
2.1 宁夏枸杞根际/非根际细菌和真菌丰度对连作的响应
实时荧光定量PCR 结果表明,连作样地根际及非根际土壤细菌和真菌丰度分别显著高于对照样地根际及非根际土壤(P<0.05,表1)。其中,连作样地再植枸杞根际细菌和真菌丰度分别为对照样地再植枸杞根际的4.8 倍和7.3 倍,而非根际土壤则分别为对照的2.1 倍和5.9 倍(表1)。进一步分析发现,对照样地根际及非根际土壤的细菌/真菌比均高于连作样地,其比例分别为对照样地的1.5 倍(P>0.05)和2.7 倍(P<0.05,表1)。

表1 实时荧光定量PCR 法分析枸杞根际/非根际细菌和真菌丰度变化 Table1 Abundances of soil bacteria and fungi in the bulk soil and rhizosphere of L.barbarum detected by real-time PCR
2.2 长期连作对再植宁夏枸杞根际真菌群落α 多样性及群落结构的影响
对真菌ITS2 区段的高通量测序结果表明,虽然非根际土壤真菌群落的丰度和均一度指数均高于枸杞根际土壤,但与对照样地相比,连作并不影响再植枸杞根际及非根际土壤真菌群落的α多样性指数(P>0.05,图1a、图1b)。多维尺度分析(NMDS)表明,连作样地与对照样地再植宁夏枸杞根际及非根际土壤的真菌群落均存在明显差异。但与对照样地相比,连作样地再植宁夏枸杞根际真菌群落结构与非根际土壤间的差异明显降低(图1c)。
2.3 长期连作对再植枸杞根际/非根际优势真菌丰度的影响
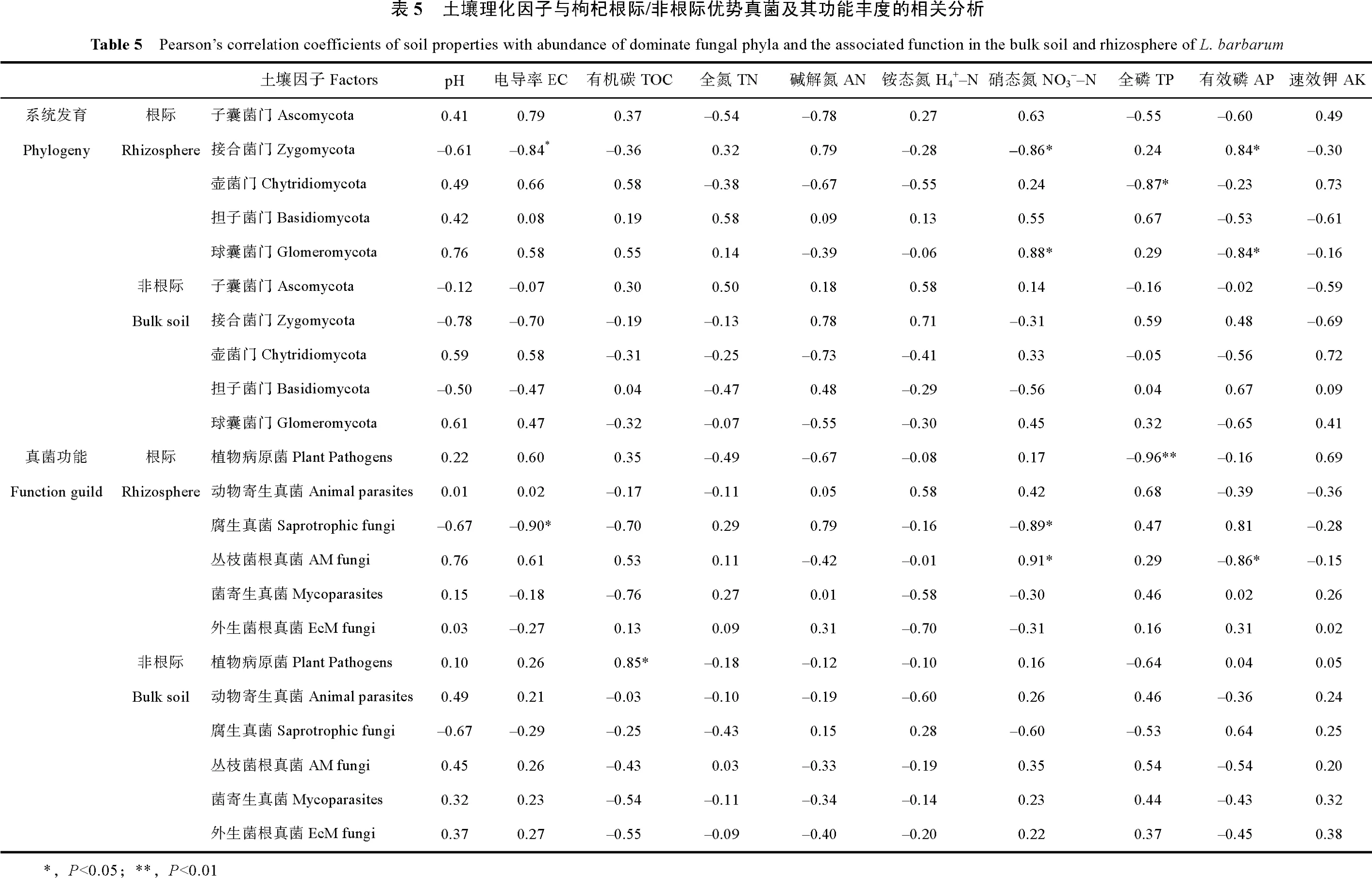
测序结果表明,所测定土壤样品中的优势真菌门分别为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、接合菌门(Zygomycota)、壶菌门(Chytridiomycota)、球囊菌门(Glomeromycota),这些真菌占各样品总序列数的99.1%~99.9%(表2)。统计分析发现,接合菌门在连作地枸杞根际土壤中的相对丰度较对照样地显著增加(P<0.05,表2),但球囊菌门的相对丰度则显著降低(P<0.05,表2)。

图1 再植枸杞根际/非根际土壤真菌群落多样性分析 Fig.1 Diversity of the soil fungal communities in the bulk soil and rhizosphere of replanted L.barbarum
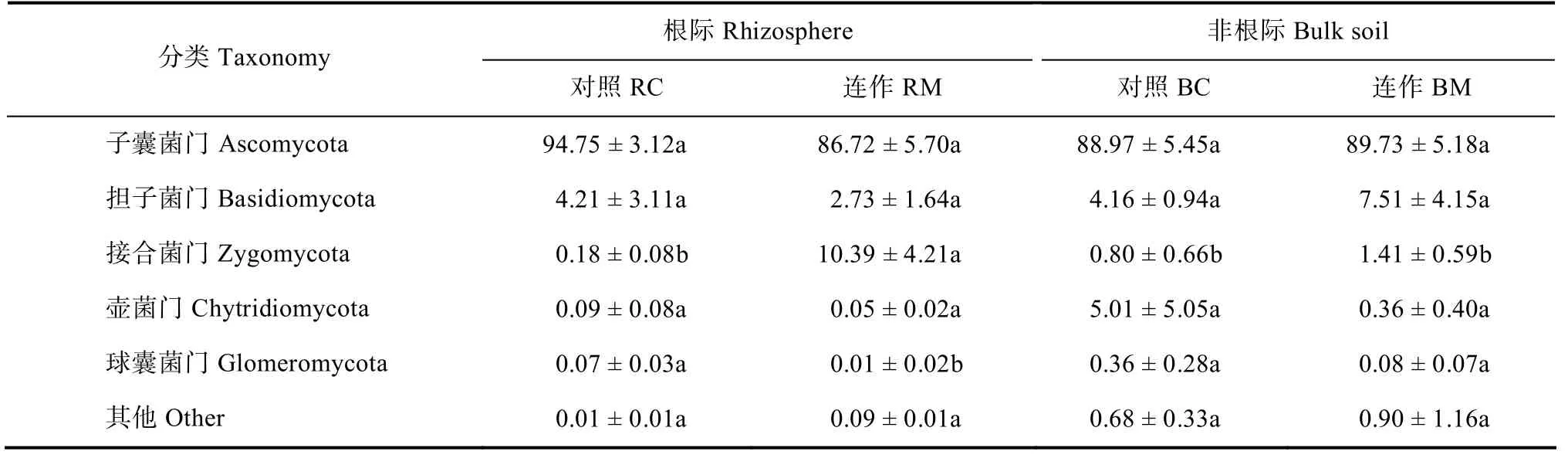
表2 再植枸杞根际/非根际优势真菌群落相对丰度变化 Table2 Relative abundances of the dominant fungal phyla in bulk soils and rhizosphere of replanted L.barbarum
进一步对相对丰度排名前30 的真菌属分析发现,连作显著促进了再植枸杞根际土壤中毛霉属和Gibellulopsis的相对丰度(P<0.05,表3)。此外,连作样地再植枸杞根际和/或非根际土壤中镰刀菌属、葡柄霉属和粉红螺旋聚孢霉属的相对丰度均高于对照样地,但结果不显著(P>0.05,表3)。
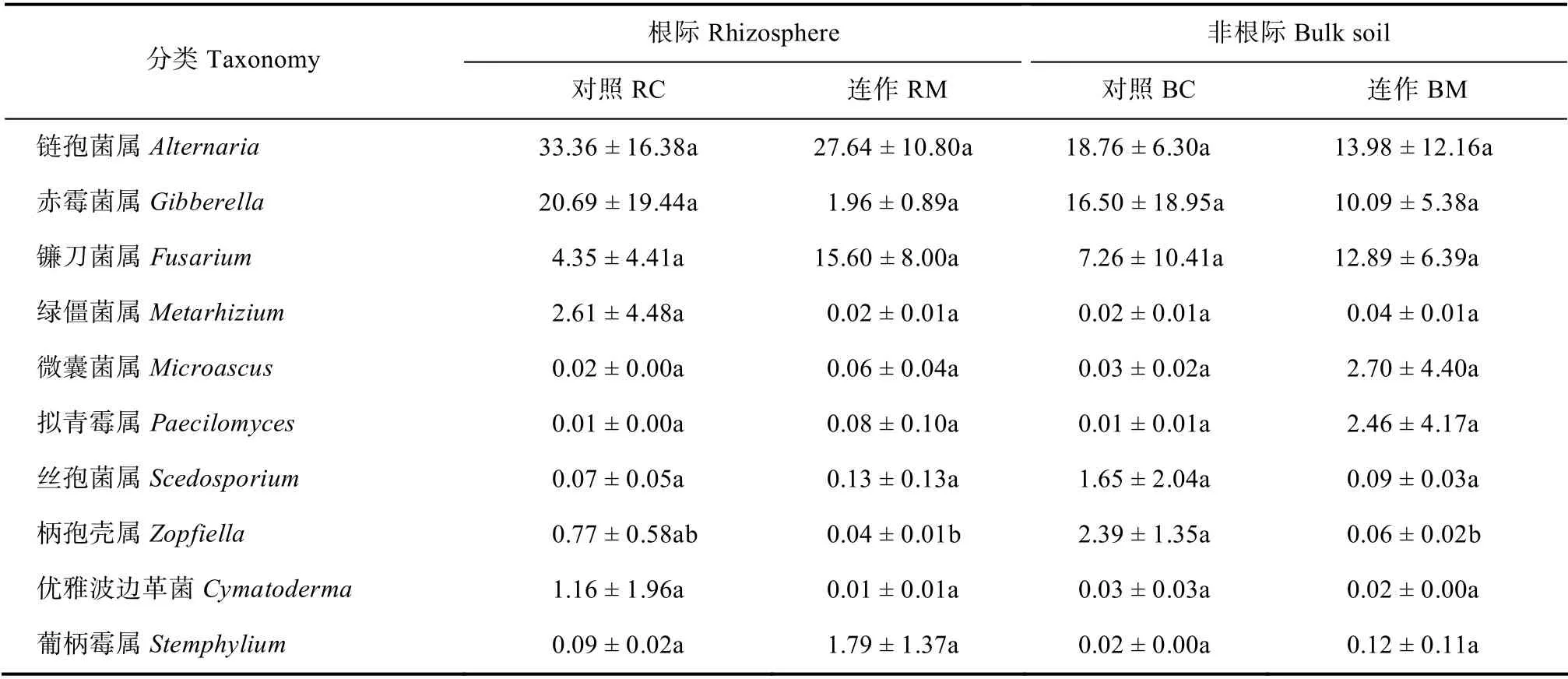
表3 再植枸杞根际/非根际优势真菌属丰度变化 Table3 Relative abundance of dominant fungal genera in the bulk and rhizosphere of replanted L.barbarum
续表
2.4 连作对再植枸杞根际不同功能真菌相对丰度的影响
将测序结果与FUNGuild 的真菌数据库进行比对,在测定的所有土壤样本中主要发现六种功能真菌(表4)。统计分析表明,连作地再植枸杞根际土壤中丛枝菌根真菌的丰度较对照样地再植枸杞根际土壤显著降低(P<0.05),其他五种功能真菌的相对丰度则无显著变化(表4)。
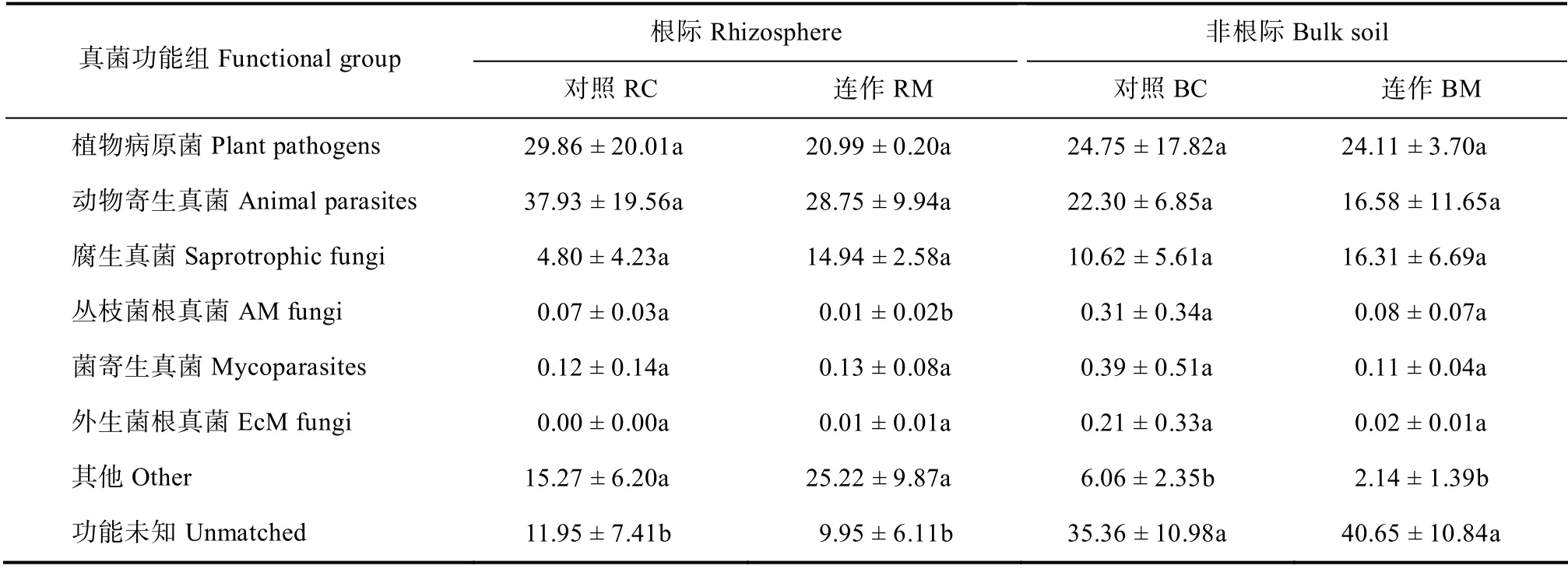
表4 连作及对照条件下再植枸杞根际/非根际不同功能真菌的相对丰度变化 Table4 Relative abundances of soil fungi in the bulk soils and rhizosphere of replanted L.barbarum relative to functional group and treatment
2.5 连作样地土壤理化性质对枸杞根际/非根际土壤真菌群落的影响
相关性分析表明,枸杞根际土壤中接合菌门的相对丰度与土壤电导率和硝态氮显著负相关,而与有效磷含量显著正相关;壶菌门的相对丰度与土壤全磷含量显著负相关;球囊菌门的相对丰度与硝态氮含量显著正相关,而与有效磷含量显著负相关(P<0.05,表5)。非根际土壤中优势真菌门的相对丰度与土壤因子间均无显著相关关系(P>0.05,表5)。从真菌功能分类看,枸杞根际土壤中植物病原菌的相对丰度与土壤全磷含量显著负相关;腐生真菌的相对丰度与土壤电导率及硝态氮含量显著负相关;丛枝菌根真菌的相对丰度与硝态氮含量显著正相关,而与有效磷含量显著负相关。而在非根际土壤中,植物病原菌的相对丰度与土壤有机碳含量显著正相关(P<0.05,表5)。
进一步利用基于距离的冗余分析(db-RDA)发现,土壤有效磷含量、电导率、速效氮含量及pH分别解释了宁夏枸杞根际土壤真菌群落变化的33.7%、30.0%、27.1%和26.7%(P<0.05,表6)。土壤有效磷和硝态氮含量分别解释了宁夏枸杞非根际土壤真菌群落变化的34.1%和29.3%(P<0.05),其他土壤因子均无显著影响(表6)。
3 讨 论
3.1 连作扰乱再植枸杞根际和非根际土壤细菌群落与真菌群落间的平衡关系
实时荧光定量PCR 的结果证实,连作地再植枸杞根际和非根际土壤中细菌和真菌的丰度均显著高于对照样地(表1),这一结果说明传统模式下长期种植枸杞能够显著促进土壤微生物种群的繁殖。导致这一结果的原因可能有以下三点:首先,长期施用肥料及枸杞落叶返还土壤能够通过提供营养和碳源、调整土壤C/N 比及改变土壤微环境等方式促进土壤微生物群落的生长和繁殖[17]。其次,Bouskill等[18]研究发现,前期预处理能够增强土壤微生物群落对后期相同类型环境胁迫的耐受性。经过长期的定向选择,枸杞连作地土壤微生物已适应枸杞根际环境,进而在再植枸杞根际土壤大量定植。此外,连作地土壤可能通过影响再植枸杞生长及其生理状态[6],调整枸杞根系与土壤微生物间的互作关系,导致枸杞根系对根际土壤微生物的控制力降低而使根际微生物过度繁殖。对再植枸杞根际/非根际真菌群落结构的分析发现,连作地再植枸杞根际真菌群落与非根际真菌群落结构较为相似(图1C),证实连作可能弱化了再植枸杞根系对土壤真菌的选择作用。然而就连作如何影响枸杞与土壤微生物间的相互作用仍需深入研究。
由于土壤细菌和真菌群落在底物利用、功能等方面的差异,决定了这两种微生物群落在应对环境变化时表现出不同的响应机制[19]。本研究结果也表明,连作对再植枸杞根际/非根际土壤真菌群落的促进作用高于细菌,导致连作地再植枸杞根际和非根际土壤中细菌/真菌的比例均明显低于对照样地(表1),使再植枸杞根际土壤微生物环境偏向于真菌型。近期,Grosso 等[20]研究发现土壤pH 和植物凋落物的C/N 是影响土壤细菌和真菌群落平衡的主要因素。其中,低pH 和高C/N 均有利于真菌生长。因此,长期施用氮肥导致的土壤pH 降低[6],可能是连作影响再植枸杞根际和非根际土壤细菌/真菌比例平衡的主要原因之一。
3.2 连作抑制再植枸杞根际土壤丛枝菌根真菌(球囊菌门)的相对丰度
丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)是土壤中分布极其广泛的一类真菌,它能够与约75%的陆生植物形成互利共生的联合体[21],因其具有帮助植物吸收氮、磷等元素、提高植物对土传病害和干旱等生物及非生物胁迫的耐受性等功能而受到广泛关注[22-23]。目前研究发现,丛枝菌根真菌主要以球囊菌门为主,因此有研究直接将球囊菌门视为丛枝菌根真菌[21,24]。本研究的测序及真菌功能预测结果表明,球囊菌门和丛枝菌根真菌的相对丰度在不同土壤样本中均保持一致(表2和表4)。进一步分析发现,连作地再植枸杞根际土壤中丛枝菌根真菌的相对丰度较对照样地显著降低(表4),且其丰度与硝态氮含量显著正相关,而与有效磷含量则显著负相关(表5)。这些结果说明,长期施肥可能影响了丛枝菌根真菌与再植枸杞根系间的共生关系。由此推测,丛枝菌根真菌丰度的减少可能进一步影响了再植枸杞对生物及非生物胁迫的抗性,从而导致再植枸杞生长减缓。
3.3 连作对再植枸杞根际土壤植物病原菌丰度的影响
?
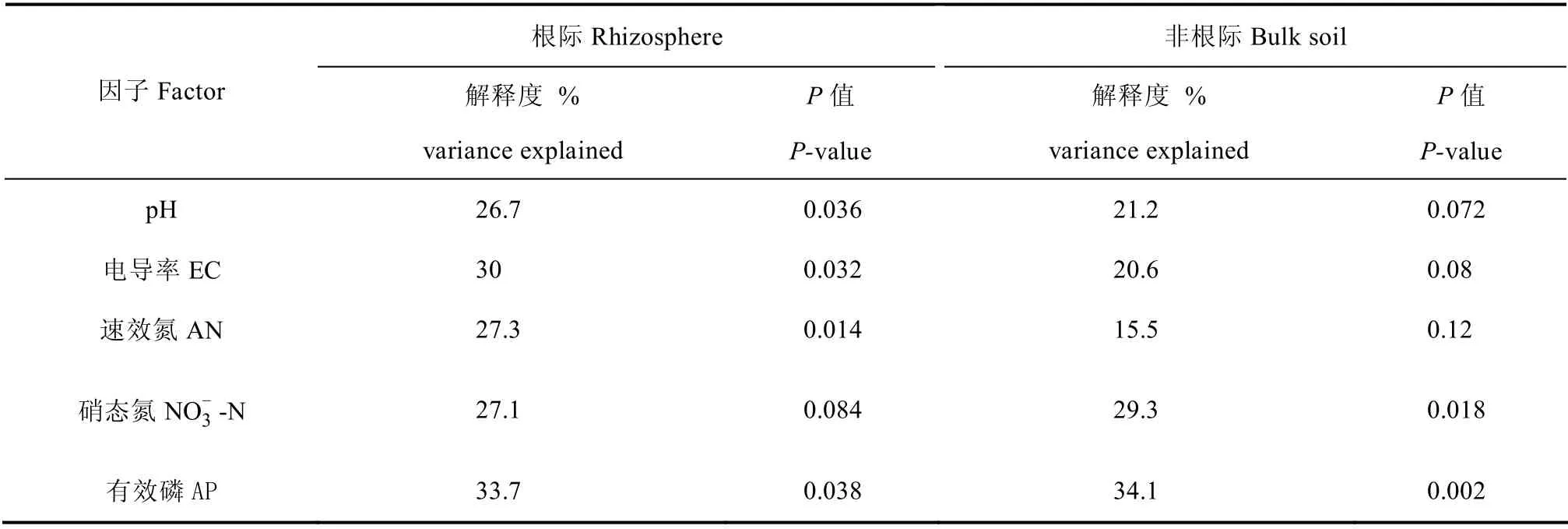
表6 土壤理化因子对宁夏枸杞根际/非根际真菌群落结构的影响 Table6 Effects of soil properties on composition of the soil fungal communities in the bulk soil and rhizosphere of L.barbarum
前期对不同种植年限枸杞根际土壤微生物群落 的分析发现,镰刀菌属、李维菌属及枝孢属等已知植物病原菌的相对丰度在不同树龄枸杞间均发生显著变化[7]。在本研究中,FUNGuild 数据库检索结果显示植物致病菌的总体相对丰度在不同样品中无显著差异(表4)。然而,就单一植物病原菌而言,连作地再植枸杞根际土壤中已知植物病原菌镰刀菌属、拟青霉属、葡柄霉属和粉红螺旋聚孢霉属的相对丰度均高于对照样地(表3)。虽然目前就这些植物病原菌是否导致枸杞产生病害尚不清楚,但这些病原真菌相对丰度的增加说明连作地再植枸杞根际土壤微生物环境较对照样地更差。此外,这一结果也间接证明连作可能干扰了再植枸杞根系对植物病原菌的抑制作用。
3.4 长期施肥是驱动再植枸杞根际土壤真菌群落演替的主要因子
前人研究表明长期施用化肥所导致的土壤酸化、土壤次生盐碱化等效应均能够直接或间接影响土壤微生物群落的结构和组成[21,25]。前序基于相同条件下对细菌群落的研究发现,土壤pH 和有效磷含量是驱动枸杞非根际细菌群落结构变化的主要因素[6]。本研究进一步表明,土壤pH、电导率、硝态氮和有效磷含量是解释再植枸杞根际真菌群落的主要因素,其中硝态氮和有效磷含量也是驱动非根际土壤真菌群落的主要土壤因子(表6)。这些结果与前人研究结果一致[21]。在实际生产中,长期施用氮肥是导致枸杞园土壤酸化的主要原因,并且氮肥和磷肥的长期使用又能够导致氮、磷元素过量。因此在传统种植模式下,大量、长期使用化肥所导致的土壤理化性质改变是驱动枸杞园土壤细菌/真菌群落及再植枸杞根际真菌群落结构演替的主要因子。鉴于土壤细菌和真菌群落在多数土壤生态过程中具有重要作用,由此可以推测,长期使用化肥对土壤微生物群落的影响可能是导致枸杞连作障碍产生的主要原因之一。
此外,在长期种植过程中枸杞凋落物及根系分泌物的不断输入也可能导致枸杞园土壤微生物群落结构发生改变。本研究也观察到TOC 含量与植物病原真菌的相对丰度存在显著正相关关系(表5),但对枸杞凋落物如何驱动枸杞园土壤微生物群落演替以及长期施肥如何影响土壤微生物群落对枸杞凋落物的利用和降解等重要过程仍不清楚。探索这些土壤生物学过程对于理解枸杞连作障碍形成机制及改进枸杞种植技术具有重要理论价值。
4 结 论
长期连作显著促进再植枸杞根际及非根际土壤细菌和真菌的群落丰度;且连作对真菌的促进作用强于细菌,导致枸杞根际及非根际土壤微生物环境偏向于真菌型。测序结果表明,再植枸杞根际土壤的优势真菌分别为子囊菌门、担子菌门、接合菌门、壶菌门和球囊菌门,其中连作地再植枸杞根际土壤中球囊菌门(丛枝菌根真菌)的相对丰度较对照样地显著降低,而接合菌门的相对丰度则显著增加。db-RDA 分析发现,土壤pH、电导率、硝态氮和有效磷是驱动再植枸杞根际土壤真菌群落结构变化的主要因素,而硝态氮和有效磷含量是影响非根际土壤真菌群落结构变化的主要因子。
