犬尿氨酸酶在乳腺浸润性导管癌中的作用及其与突变型P53的关系
2020-01-15肖永志刘英哲冯雪萍易文君
肖永志,刘英哲,冯雪萍,易文君
(中南大学湘雅二医院 1.超声科 4.乳腺外科,湖南 长沙 410011;中南大学湘雅医院 2.国际医疗部/国家老年疾病临床医学研究中心 3.医学实验中心,湖南 长沙 410008)
乳腺癌是女性最常见的恶性肿瘤之一。严重威胁到了女性的健康和生活。在2012年,全球大约有170万人患病,其中有521 900人死亡[1]。在中国,乳腺癌是女性第五大致死性癌症[2]。乳腺浸润性导管癌(IDC)是乳腺癌中最常见的病理类型[3]。IDC的发生主要考虑与基因调控异常及性激素水平的紊乱有关,生物学因素的改变,可以影响到肿瘤相关信号通路的激活,导致早期细胞发生病变[4]。现阶段IDC患者的早期诊断的水平仍然较为局限,影像学筛查虽然能够提高诊断准确率,但漏诊率或者误诊率仍然较高[5];临床上通过手术及综合性的放疗方式辅助治疗IDC,但其治疗后患者的生存时间的改善并不理想,治疗后的3年生存率并无明显的提高[6]。虽然手术、放疗、化疗是肿瘤治疗的传统手段[7],但免疫治疗目前已经成为治疗肿瘤的新的方法,如PD-1/PD-L1抑制剂[8]等,备受人们关注。
犬尿氨酸酶(kynureninase,KYNU)或L-犬尿氨酸水解酶属于犬尿氨酸酶家族,基因组位置在2q22.2[9]。KYNU在肝脏、胎盘、肺、心脏、脑等多种组织器官中均有表达[10],能水解L-犬尿氨酸和3-羟基L-犬尿氨酸为邻氨基苯甲酸,通过色氨酸代谢通路参与NAD辅因子的生物合成[11-12]。色氨酸在肿瘤细胞中主要通过吲哚胺-2-3双加氧酶1(IDO-1)降解,其降解产物之一为犬尿氨酸。
人类许多肿瘤的发生、发展都与p53基因的突变有关。P53蛋白也是多种癌症进展与预后的一项重要指标[13]。因此,本研究应用免疫组织化学方法检测IDC标本中KYNU和突变型P53的表达情况,分析它们与IDC临床病理特征的相关性,进而探讨它们之间的相互关系。
1 材料与方法
1.1 材料
1.1.1 标本来源从2012年9月—2015年在湘雅二医院接受外科介入和病理检查的IDC患者石蜡包埋标本。从患者的记录中回顾性地获得这些患者的临床和病理数据。
1.1.2 抗体KYNU抗体购自GeneTex公司(兔多克隆抗体,GTX33291),适用的稀释浓度为1:1 000;使用UltraViewTMUniversal DAB检测试剂盒(Ventana Medical Systems)常规染色针对P53的单克隆抗体。
1.2 实验方法
1.2.1 免疫组化肿瘤组织放入10%福尔马林中固定,并包埋在石蜡块中,蜡块作厚度约4 μm的多张切片,其中1张行切片HE常规染色,另2张切片分别行KYNU、P53免疫组化检测,且HE常规染色均由湘雅二医院病理科高年资医生病理检查证实。采用SP法检测KYNU的表达,检测方法按试剂盒说明书进行。以磷酸盐缓冲液代替一抗作为阴性对照。P53使用自动Benchmark平台(Ventana Medical Systems,Tucson,USA)进行免疫组化实验(37 ℃孵育60 min)。使用Benchmark平台对所有标本使用细胞调节溶液(CC1,Ventana Medical Systems)的抗原修复,并用苏木精进行复染。
1.2.2 结果判断根据美国临床肿瘤学会(ASCO)和美国病理学家学会(CAP)指南对P53染色进行评分。P53阳性定义为超过10%的肿瘤细胞染色。KYNU蛋白主要在肿瘤细胞的细胞质中表达。细胞质染色分数(CF)的得分为0(0~5%),1(5%~25%),2(26%~50%),3(51%~75%)或4(>75%),细胞质染色强度(CI)记为0(阴性)、1(弱)、2(中等)、3(强)。随后,通过将CF和CI(范围0~12)相乘来计算组合的细胞质评分(CS)。为了合理进行统计分析,减少异质性,使用对数秩和检验选择KYNU表达的临界范围值。最佳临界范围值被确定为低表达(分数≤4)或高表达(分数>4)KYNU表达。
1.3 统计学处理
使用Windows版的SPSS 19.0版进行统计分析。使用χ2检验评估KYNU表达与临床病理学特征之间的关系。使用单因素方差分析计算KYNU在IDC的肿瘤分级和TNM分期中的表达数据。
2 结果
2.1 KYNU在IDC中的表达
在131例IDC组织中进行KYNU的免疫组化分析,63个样本(48.1%)KYNU高表达(IHC得分>4),68个样本(51.9%)为KYNU低表达(IHC得分≤4)。在102例IDC组织中,46个样本P53表达阳性,阳性率为45.1%,56个样本P53表达阴性(图1)。
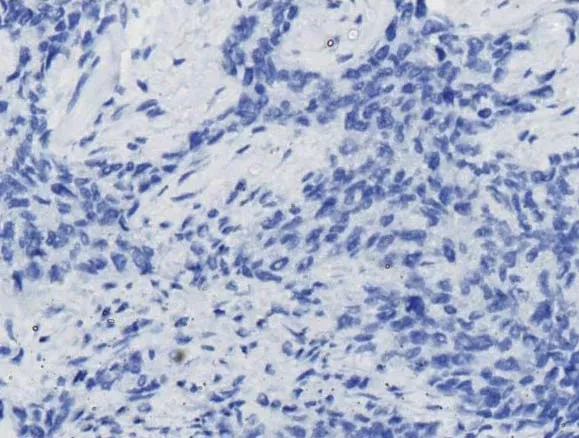
图1 免疫组化检测KYNU与P53蛋白表达(×400) A:乳腺癌组织中KYNU高表达;B:乳腺癌组织中KYNU低表达;C:乳腺癌组织中P53阳性表达;D:乳腺癌组织中P53阴性表
2.2 KYNU在IDC中的表达及与临床病理指标的关系
单因素分析结果显示,KYNU的表达T分期(P<0.001),组织学分级(P=0.01),内在亚型(P=0.032),突变型P53(P=0.02)有关,而与年龄及N分期无关(均P>0.05)(表1)。
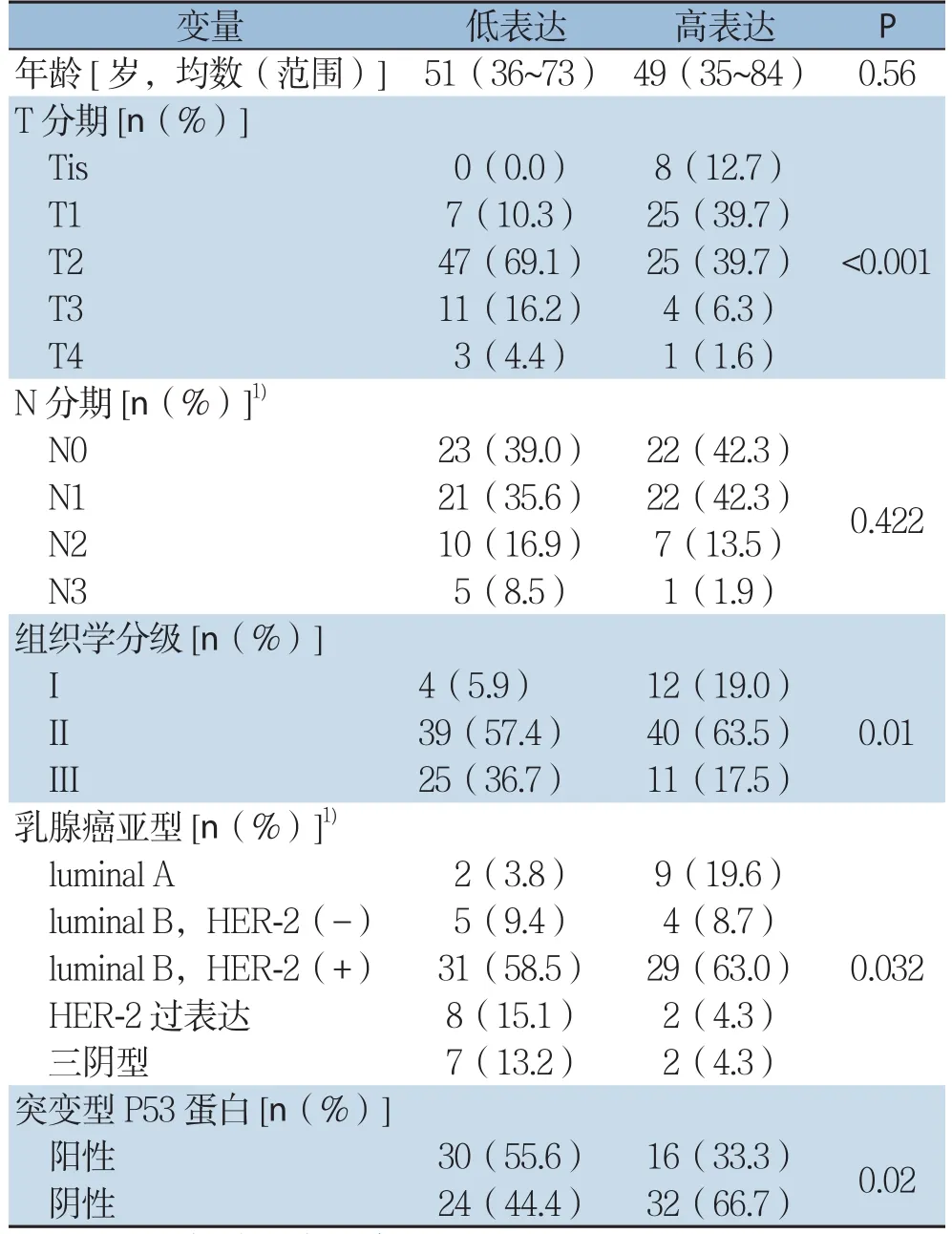
表1 KYNU表达与IDC临床病理特征的相关性
3 讨论
在本研究中,通过免疫组化的方法探讨了KYNU在IDC的表达及其对预后评估的价值。KYNU主要在细胞胞浆中表达,它的表达与乳腺癌病理分型相关,在不同分级中表达强弱有差异,组织学分级I级表达最强,组织学分级II级其次,组织学分级III级表达最弱。KYNU的表达在不同分期中表达强弱也有差异,T0表达最强,T3表达最弱。
而在乳腺癌的亚型中表达可见,高KYNU表达多存在于luminal A型,而不是三阴型;而低KYNU表达则多存在于三阴型,而三阴型乳腺癌是一种特殊类型的乳腺癌亚型,具有发病年龄小、家族史、有淋巴结转移等特点,其较早发生局部复发和远处转移[14],故从肿瘤的分期、分级及不同亚型的分析来看,KYNU的表达与肿瘤的侵袭性负相关。
笔者推测KYNU作为色氨酸代谢途径中另一关键酶在IDC发生与发展中起重要的作用。KYNU与色氨酸的利用和疾病的代谢有关,而色氨酸代谢中的重要酶,吲哚胺2,3-双加氧酶(IDO)与恶性肿瘤的免疫耐受密切相关[15]。一项髓质乳腺癌患者的研究表明,IDO-1的高表达与肿瘤良好的预后相关[16]。犬尿氨酸酶在癌症发展中的作用尚不十分清楚,其与癌症的关联仅有少量报道,如肺癌[17]。也有研究表明它与乳腺癌细胞的增殖和分化密切相关[18]。
人体内野生型p53基因作为抑癌基因,主要生物学功能为引起细胞周期阻滞,诱导凋亡和促进分化[19],但因其含量少,半衰期短而不能用免疫组化法测出。突变型P53蛋白失去抑癌作用,反而有促进细胞恶变的活性,由于其半衰期延长,且在细胞核内聚积,通过免疫组化方法可直接检测[20]。人类恶性肿瘤中多数存在p53基因突变[21],p53基因突变可导致缺陷DNA大量复制,甚至导致恶变[22]。
临床上乳腺恶性肿瘤的发生,导致患者生活质量和生存时间显著下降[23]。在探讨IDC的发病机制的过程中发现,P53蛋白能够通过影响到癌细胞的周期调控,导致上皮细胞的持续性增殖,提高了癌细胞对于导管基底部的浸润作用[24]。在浸润性导管癌患者病灶组织中,P53的表达阳性率显著的上升,高于正常对照乳腺组织,差异较为明显,提示了P53可能影响到了乳腺癌发生[25]。
在KYNU与肿瘤相关指标P53的关系分析中可见,KYNU高表达与P53(突变型)呈反向变化关系。还有报道也认为,在乳腺癌患者病灶组织中,P53的表达阳性率可平均上升30%以上,同时在临床分期较晚或者远期病死率较高的导管癌患者中,P53的表达阳性率可进一步的上升[26]。
恶性肿瘤是一个多因素、多步骤作用的结果,其发生要经过一系列基因表达变化的共同作用。基于笔者的上述数据,KYNU可能对乳腺癌起到了抑制作用,它的高表达可被认为是具有良好预后的IDC的标志物。因此KYNU是很有前途的乳腺癌治疗靶点,但需要对KYNU进行更深入的研究。未来将对影响乳腺癌发展的KYNU分子机制进行更进一步的研究。
