SNAI1对内胚层分化命运和细胞迁移能力的影响
2020-01-13李秋鸿黄清松毛建文
李秋鸿,黄清松,毛建文
(广东药科大学生命科学与生物制药学院/广东省生物活性药物研究重点实验室,广东 广州 510006)
人胚胎干细胞(hESCs)来源于人囊胚内细胞团,在体外培养时具有自我更新和多向分化的潜能,其体外分化的过程可再现早期胚胎发育的各个阶段[1-3]。定型内胚层细胞是包括甲状腺、肺、胰腺、肝脏和肠道在内等器官的胚胎前体[4]。不管是脊椎动物的体内胚胎发育还是人多能干细胞的体外定向分化,定型内胚层的产生都必须依赖于TGF-β/nodal/activin信号通路的激活[5]。该信号通路的激活往往伴随着细胞迁移运动的发生,细胞运动是一个非常复杂的过程,表现为细胞形态、黏附和迁移能力等方面的变化[6-9]。在体外,将人胚胎干细胞定向分化为定型内胚层[10]或中胚层[11]的过程中都可以检测出与细胞运动有关的表面蛋白表达发生变化,例如E-cadherin、N-cadherin等。在胚胎发育过程中,锌指蛋白SNAIL家族的激活能够促进细胞发生迁移运动[12],体外定型内胚层细胞运动能力的获得与SNAIL家族之间的关系目前报道较少。为了研究SNAIL家族在定型内胚层分化过程中的作用,本实验通过干扰SNAI1基因的表达,探讨SNAI1与定型内胚层命运及与细胞运动之间的关系。
1 材料
1.1 细胞
人胚胎干细胞细胞株H1购于威斯康星州WiCell研究所(Wicell,Madison,WI)。
1.2 主要试剂
mTeSR1培养基(Stemcell Technologies);Matrigel基底胶(BD Biosciences);Accutase细胞消化液(Sigma);RPMI/B27培养基(Gibco);激活素A(Peprotech); FBS (HyClone);DAPI(Sigma);FOXA2抗体(R&D system);小鼠来源的SNAI1单克隆抗体(Cell Signaling Technology);HRP标记的羊抗兔二抗、Alexa Fluor®488 标记的驴抗羊二抗(Invitrogen);Trizol试剂(MRC);ReverTra Ace qPCR RT Kit (TOYOBO);SYBR Premix Ex Taq Kit(TAKARA);western化学显色试剂盒(MILLIPORE);siSNAI1-1#(锐博生物);siSNAI1-2#(锐博生物);转染试剂Lipofectamine RNAiMAX(Thermo scientific)。
1.3 主要仪器
Zeiss LSM 710共聚焦显微镜(德国Carl Zeiss);CFX96 Touch实时荧光定量PCR仪 (美国Bio-Rad公司);倒置荧光显微镜(德国Carl Zeiss)。
2 方法
2.1 细胞培养
将人胚胎干细胞系H1接种于铺有Matrigel基底胶的6孔板上,加入mTeSR1培养基在37 ℃、5%(φ)CO2的条件下培养,每天换液。当培养板中细胞密度较大时,按照1∶4~1∶6的比例用Accutase细胞消化液进行传代。
2.2 定型内胚层分化
在24孔板中提前半小时预先铺好Matrigel基底胶,将6孔板中密度达50%左右的H1细胞用Accutase消化液进行消化,细胞密度以第2天细胞接近铺满整个培养孔为宜。细胞贴壁成功并铺满整个培养孔后加入含有50 ng/mL Activin A重组蛋白的RPMI/B27培养基,在37 ℃、5% CO2的条件下培养3 d,每天更换新鲜的分化培养基[13]。
2.3 siRNA转染
严格按照转染试剂 Lipofectamine RNAiMAX 说明书的操作步骤进行。
2.4 Western blot检测siRNA对SNAI1蛋白的干扰效果
收集细胞并裂解蛋白进行SDS-PAGE电泳,将蛋白转移至PVDF膜上,用脱脂奶粉室温封闭2 h,加入兔抗人SNAI1多克隆抗体,4 ℃条件下孵育过夜,TBS /T清洗3次,加入相对应的HRP标记的山羊抗兔二抗,室温孵育1 h,TBS/T清洗3次,滴加显影液和定影液于暗室中显影成像。
2.5 qRT-PCR检测FOXA2、GATA4/6、KLF8、TGFβ1、SNAI1等基因的表达
将在24孔板中培养的H1细胞向内胚层定向诱导3 d后,吸弃培养基上清液,用PBS缓冲液清洗3次,每孔中加入约1 mL Trizol试剂,反复吹打直至细胞完全溶解。加入氯仿分层,取水相至预冷的异丙醇中获得总RNA沉淀,洗涤晾干,将RNA沉淀重新溶于蒸馏水,测定浓度。根据ReverTra Ace qPCR RT Kit说明书操作,取2 μg总RNA将其反转为cDNA并适度稀释,用作PCR模板。采用SYBR Premix Ex Taq Kit进行qPCR反应,内参为GAPDH。所用引物的序列如下:FOXA2,5′-ACTACCCCGGCTACGGTTC-3′(正向),5′-AGGCCCGTTTTGTTCGTGA-3′(反向);GATA4,5′-CGACACCCCAATCTCGATATG-3′(正向),5′-GTTGCACAGATAGTGACCCGT-3′(反向);GATA6,5′-CTCAGTTCCTACGCTTCGCAT-3′ (正向),5′-GTC GAGGTCAGTGAACAGCA-3′(反向);KLF8,5′-CCCAAGTGGAACCAGTTGACC-3′(正向),5′-GAC GTGGACACCACAAGGG-3′(反向);TGFβ1,5′-CTAATGGTGGAAACCCACAACG-3′(正向),5′-TATCGC CAGGAATTGTTGCTG-3′(反向);SNAI1,5′-ACTGCA ACAAGGAATACCTCAG-3′(正向),5′-GCACTG GTACTTCTTGACATCTG-3′(反向);GAPDH,5′-AGG GCTGCTTTTAACTCTGGT-3′(正向),5′-CCCCACTTG ATTTTGGAGGGA-3′ (反向)。
2.6 免疫荧光检测FOXA2蛋白的表达
4%多聚甲醛固定细胞,处理30 min后用PBS清洗3次,然后加入0.3% Triton X-100/PBS溶液通透30 min,PBS清洗3次,加入10% FBS/PBS溶液室温孵育1 h。加入羊抗人BFOXA2一抗于4 ℃冰箱中孵育过夜,PBS清洗3次,加入相对应的Alexa Fluor®488 标记的驴抗羊免疫荧光二抗,避光孵育2 h,PBS清洗3次,加入DAPI避光孵育5 min,PBS清洗3次,封片。使用Zeiss LSM 710共聚焦显微镜进行观察和拍照。
2.7 细胞迁移运动能力检测
采用划痕法测定内胚层定向分化第3天的细胞迁移运动能力:用无菌针头快速划过单层培养的细胞表面,形成无细胞区,该区域附近的细胞可以向无细胞区迁移运动,拍照、测量起始的无细胞区的边界距离,然后将细胞放置回培养箱中继续培养24 h后再取出拍照、测量无细胞区边界距离,由此可计算出细胞24 h内的迁移距离。
2.8 统计学方法

3 结果
3.1 验证siSNAI1的干扰效果
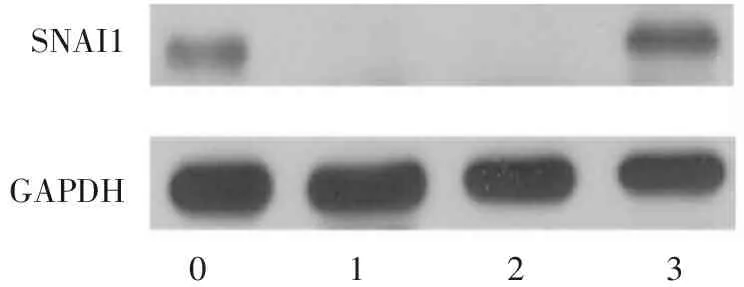
将hESCs诱导为内胚层细胞的过程中加入干扰SNAI1表达的siRNA,与正常对照相比,分化第3天细胞内SNAI1基因的mRNA含量显著下降(P<0.01),见图1。通过蛋白免疫印迹法也证实分化第3天内胚层细胞中SNAI1蛋白的表达受到明显抑制,见图2。

0123t/d0.00200.00150.00100.00050.0000相对表达量NCsiSNAI1-1siSNAI1-2SNAI1**
与siSNAI1-1组、siSNAI1-2组比较:**P<0.01。
图1分化过程中经siSNAI1处理后细胞内SNAI1基因的mRNA含量
Figure1Gene expression ofSNAI1 after siSNAI1 treatment in endoderm differentiation
3.2 干扰SNAI1基因的表达对FOXA2表达的影响
在内胚层细胞分化过程中,FOXA2在分化第2天左右就会发生上调,分化第3天在细胞中高表达。阻碍SNAI1基因的表达导致FOXA2在第2天左右上调失败(P<0.05),直接影响分化第3天FOXA2在细胞中的表达量(P<0.05),结果见图3。细胞免疫荧光检测分化第3天细胞内FOXA2蛋白的表达发现,siRNA处理的细胞几乎不表达FOXA2,说明细胞的内胚层分化命运受到抑制,见图4。
0123SNAI1GAPDH
1. hESCs; 2. siSNAI1-1 D3; 3. siSNAI1-2 D3; 4. NC D3。
图2经siSNAI1处理后细胞内SNAI1蛋白含量
Figure2IntracellularSNAI1 protein content after siSNAI1 treatment

0123t/dNCsiSNAI1-1siSNAI1-2FOXA20.0160.0120.0080.0040.000相对表达量**
与siSNAI1-1组、siSNAI1-2组比较:*P<0.05。
图3分化过程中经siSNAI1处理后细胞表达FOXA2的情况
Figure3Expression ofFOXA2 mRNA in siSNAI1-treated cells during endodermal differentiation

图4经siSNAI1处理3 d后细胞表达FOXA2蛋白的情况
Figure4Expression of FOXA2 protein in siSNAI1-treated cells at 3 days
3.3 干扰SNAI1基因的表达对GATA4、GATA6、TGFβ1、KLF8 mRNA表达的影响
为了进一步验证SNAI1基因的表达受阻对内胚层细胞命运的影响,利用实时荧光定量PCR检测细胞中GATA4、GATA6的mRNA表达情况发现,与正常对照相比,siRNA处理的细胞中内胚层标记基因GATA4、GATA6的表达非常低(P<0.01)。同时qRT-PCR结果还表明与细胞运动相关的基因TGFβ1、KLF8的表达也受到影响(P<0.01),见图5。

0.00040.00030.00020.000100.0040.0030.0020.0010相对表达量0.0120.0100.0080.0060.0040.0020相对表达量0.000250.000200.000150.000100.000050GATA4GATA6TGFβ1KLF8NCD3siSNAI1-1siSNAI1-2****************
与NC组比较:**P<0.01。
图5经siSNAI1处理3 d后细胞表达GATA4、GATA6、TGFβ1、KLF8的情况
Figure1Expression ofGATA4、GATA6、TGFβ1 andKLF8 mRNA in siSNAI1-treated cells at 3 days
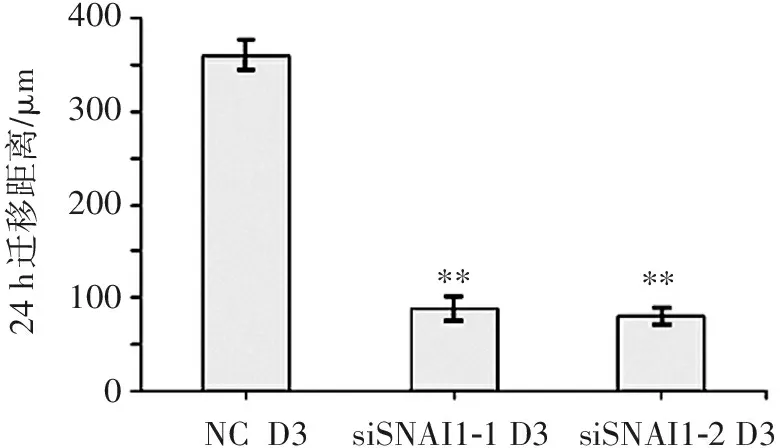
3.4 干扰SNAI1基因的表达对细胞迁移运动能力的影响
如图6所示,将hESCs诱导为内胚层细胞的过程中,细胞会获得迁移运动能力,细胞由上皮状态转变为间充质状态。加入干扰SNAI1表达的siRNA后,细胞的迁移运动能力受到明显限制(P<0.01)。
****siSNAI1-2D3siSNAI1-1D3NCD3400300200100024h迁移距离/?m
与NC组比较:**P<0.01。
图6经siSNAI1处理3 d后细胞迁移运动能力的变化
Figure6Cell migration assay after siSNAI1 treatment at 3 days
4 讨论
原肠胚期是动物胚胎发育过程中的一个重要阶段,此时外、中、内3个胚层开始出现,尽管内胚层细胞的数量在胚胎总细胞数中占比不高[14],但是却能够产生机体中的大部分内脏器官。尽管这些内脏器官在形态和功能上存在差异,但它们的形成都与细胞的迁移运动密不可分[15]。SNAI1对于细胞的运动至关重要,干扰SNAI1的表达会导致细胞形态、功能发生改变,甚至是迁移运动能力的丧失[16- 17]。研究发现SNAI1敲除的小鼠胚胎无法正常出生,推测可能与原肠胚期细胞迁移运动过程受阻有关[18],而在小鼠的胚胎干细胞(mESCs)中异位过表达SNAI1则会促进细胞发生迁移运动[19]。
胚胎干细胞是由囊胚内细胞团衍生而来,能够分化为内、中、外原始三胚层来源的多种类型的细胞,是未来细胞治疗的重要资源。然而干细胞真正的临床研究进展缓慢,其应用还存在不少安全问题,这主要是由于人们对分化过程的本质及机制的认识还非常有限[20]。以内胚层分化为例,研究发现将人胚胎干细胞定向分化为内胚层细胞的过程中可以观察到细胞的形态发生了明显改变,这些细胞还具有与体内分化细胞相似的迁移运动能力,尽管细胞运动与其命运之间有何联系尚不清楚。
本实验利用RNA干扰技术,通过抑制SNAI1的表达,探讨SNAI1对定型内胚层分化过程的影响及其在细胞迁移运动中所起的作用。实验结果发现干扰SNAI1的表达会阻碍内胚层的定向分化过程,定型内胚层谱系命运转变过程严重受阻,分化的细胞几乎不表达定型内胚层的标志蛋白,同时与细胞运动有关的基因表达明显下调,细胞的迁移运动能力有限。由此说明SNAI1不仅在定型内胚层分化过程中起着决定细胞命运的作用,还能够阻止细胞获得相应的迁移运动能力。推测细胞获得迁移运动能力可能是人胚胎干细胞成功分化为定型内胚层细胞的前提。
