混菌固态发酵菜籽粕工艺优化
2020-01-13吴正可刘国华李阳郑爱娟常文环陈志敏蔡辉益
吴正可,刘国华,李阳,郑爱娟,常文环,陈志敏,蔡辉益
混菌固态发酵菜籽粕工艺优化
吴正可,刘国华,李阳,郑爱娟,常文环,陈志敏,蔡辉益
(中国农业科学院饲料研究所/生物饲料开发国家工程研究中心/农业农村部生物饲料重点实验室,北京 100081)
【目的】通过优化菜籽粕混菌固态发酵工艺以提高菜籽粕营养价值,为发酵菜籽粕在我国畜牧养殖上的应用提供理论参考。【方法】以普通菜籽粕为原料,采用嗜酸乳杆菌、枯草芽孢杆菌、酿酒酵母3种菌株,以硫甙降解率(X%)、总酸增加率(Y%)、多肽增加率(Z%)为评价指标,并采用加权法以M为综合评价指标(其中M = 0.7×X + 0.15×Y + 0.15×Z)评价发酵效果。其中,试验一以3株菌的不同添加量为试验因素,设计L9(34)三因素三水平正交试验,探究各菌株添加量及不同的菌株组合方式对发酵效果的影响;在试验一的基础上配置混菌发酵液,以发酵温度、料水比、发酵时间、接种量为试验因素,设计L16(45)四因素四水平正交试验,探究混菌固态发酵菜籽粕的最佳工艺,并结合最佳工艺进行中试验证。【结果】(1) 试验一对以总变化率M为指标的正交试验结果进行极差分析,结果显示混菌固态发酵菜籽粕最佳混菌组合为嗜酸乳杆菌:酿酒酵母:枯草芽孢杆菌为=1﹕3﹕2,在该条件下,硫甙降解率为23.5%,总酸增加率为179.2%,多肽增加率为375.0%。(2) 在试验一的基础上设计试验二并对结果进行极差分析,结果表明混菌固态发酵菜籽粕的最佳工艺条件为温度:33℃、料水比:1﹕1、时间:84h、接种量:6%,在该工艺条件下进行中试验证测得硫甙降解率为48.8%,总酸增加率为499.7%,多肽增加率为148.4%,总变化率为131.4%,符合试验预期;对各单因素的方差分析结果显示1水平温度(31℃)总变化率显著低于其他水平(< 0.05),2水平温度(33℃)总变化率高于3水平(35℃)和4水平(37℃),但差异不显著(> 0.05);2水平(1﹕1)的料水比总变化率高于其他水平,差异未达到显著水平(>0.05);3水平(84 h)的发酵时间总变化率高于其他水平,但差异未达到显著水平(>0.05);接种量各水平之间对总变化率的影响差异不显著(> 0.05)。(3)在该最佳工艺条件下,微生物固态发酵增加了菜籽粕粗蛋白含量(从37.05%到40.90%)并降低了粗纤维浓度(从17.47%到16.72%);发酵菜籽粕氨基酸组成分析表明发酵增加了菜籽粕中各种氨基酸的含量,尤其是Asp,Thr,Ser,Glu,Pro,Ala和Lys;发酵后菜籽粕硫甙含量从36.08 μmol·g-1降至18.48 μmol·g-1;发酵增加了菜籽粕中多肽含量(从0.84%到2.09%)和总酸含量(从1.01%到6.05%);菜籽粕发酵前后粗脂肪含量相似(4.31%和4.39%)。【结论】通过本发酵工艺对菜籽粕进行混菌固态发酵可有效降解菜籽粕中的硫甙,并提高菜籽粕中多肽和总酸的含量,菜籽粕营养价值得到有效改善。
菜籽粕;混菌;固态发酵;正交设计
0 引言
【研究意义】蛋白质是动物饲粮中的重要组成部分,一般由豆粕提供。近年来,随着中国畜牧养殖业的快速发展及养殖体量的进一步扩大,常规饲料原料尤其是蛋白原料供应紧缺,限制着中国畜牧养殖业的健康发展。据统计,2018年中国豆粕使用量为7 230万t,其中95%来自于美国、巴西等国家的进口。在当前蛋白饲料原料竞争日趋激烈的国际背景下,中国传统玉米-豆粕型动物饲粮结构将会发生变化,新型蛋白饲料资源的开发迫在眉睫,引入菜籽粕等杂粕的多元化饲粮配方将会成为中国畜牧养殖业的新常态[1]。【前人研究进展】菜籽粕是油菜籽在榨油过程中产生的副产物,其粗蛋白质含量在35%—45%,但由于菜籽粕中含有硫甙、单宁、植酸等抗营养因子,且粗纤维含量较高(11%—14%),限制了其在动物饲粮中的饲用价值[2-3]。硫甙是菜籽粕中毒性最强的抗营养因子,能够直接影响动物甲状腺发育,降低动物生产性能,影响动物免疫力[4]。近年来,研究人员发现微生物固态发酵能有效的降低菜籽粕中抗营养因子的含量,在替代豆粕方面具有较高的开发价值[5]。ROZAN等使用少孢根霉菌固态发酵处理菜籽粕40h后可降解菜籽粕中47%的硫甙[6];DRAZBO 等的研究表明用6-植酸酶固态发酵菜籽粕可显著降低菜籽粕中硫甙含量并可在一定程度上提高火鸡生长性能[7]。【本研究切入点】目前关于发酵菜籽粕的研究虽有大量报道,但对发酵效果的研究主要集中在硫甙的降解,发酵条件不一,发酵效果差异较大,菜籽粕营养价值的开发还有较大的空间。基于本课题组在微生物发酵饲料的大量前期工作上,本试验拟通过两个正交设计试验探究不同菌株添加量及各发酵参数对发酵效果的影响,兼顾发酵菜籽粕硫甙的降解及营养价值的改善,深度挖掘发酵菜籽粕的饲用价值。【拟解决的关键问题】明确各因素对发酵菜籽粕效果的影响,得出混菌固态发酵菜籽粕最佳发酵工艺,为微生物发酵菜籽粕的过程控制及规模应用提供理论指导。
1 材料与方法
1.1 试验时间及地点
本试验于2016年10月至2017年6月在中国农业科学院饲料研究所农业部生物饲料重点实验室进行。
1.2 试验材料
菌种:嗜酸乳杆菌由农业农村部生物饲料重点实验室筛选并保藏,枯草芽孢杆菌与酿酒酵母由山东大学微生物技术国家重点实验室惠赠。菜籽粕为普通菜籽粕,购自北京金盛祥科技发展有限公司,其营养成分为粗蛋白37.05%,粗纤维17.47%,粗脂肪4.31%,多肽0.84%,总酸1.01%,硫甙36.08 μmol·g-1。
培养基:MRS培养基,LB培养基,YPD培养基,购自北京奥博星生物技术有限责任公司。
1.3 试验方法
1.3.1 菌种发酵培养液的制备 将菌株平板划线培养,于各菌株平板上挑取单菌落于10mL相应液体培养基中,一定条件下(其中,嗜酸乳杆菌37℃恒温静置培养;枯草芽孢杆菌37℃、200r/min恒温振荡培养;酿酒酵母30℃、200r/min恒温振荡培养)培养24h后,按1%的接种量接种于150mL液体培养基中,培养21h后制成各单菌发酵培养液。
1.3.2 发酵步骤 取50g菜籽粕装入250mL的锥形瓶中,将菌种和无菌水以一定的比例接入到发酵底物中,搅拌均匀,在试验条件下恒温静置发酵,每隔12h翻料一次,发酵结束后45℃低温烘干,粉碎过40目筛待测。
1.4 发酵条件优化
以发酵后菜籽粕中硫甙降解率(X%)、总酸增加率(Y%)、多肽增加率(Z%)为评价指标,采用加权法以M为综合评价指标(其中M=0.7*X+0.15*Y+ 0.15*Z)探究3种菌株的添加量及不同组合比例对发酵菜籽粕的影响[8],各菌株设置3个水平并设计L9(34) 三因素三水平正交试验(表1)。
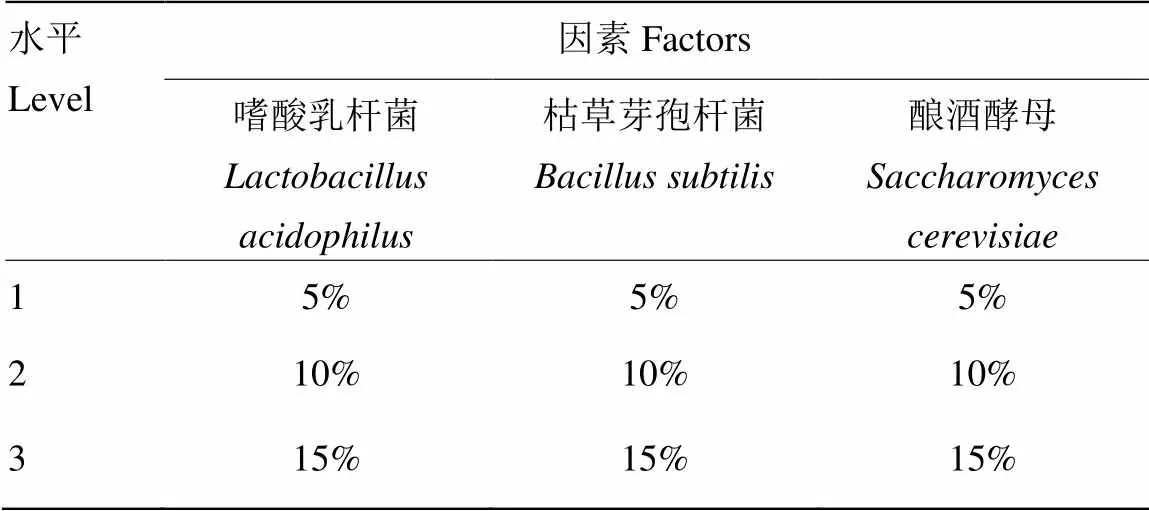
表1 L9(34)正交试验设计
在确定混菌组合比例的基础上进一步优化菜籽粕发酵工艺条件,以M为综合评价指标(其中M=0.7×X+0.15×Y+0.15×Z),以发酵温度、料水比、时间、接种量为试验因素,设计L16(45)四因素四水平正交试验(表2)。

表2 L16(45)正交试验设计
1.5 最优条件中试发酵发菜籽粕
参照前期优化条件,按1.3所述方法,采用安装有单向呼吸阀的发酵袋恒温静置中试发酵菜籽粕40kg,每隔12h翻料一次,发酵袋为普通发酵袋,购自北京百旺通达科技有限公司。发酵结束后45℃低温烘干,粉碎过40目筛,测定发酵后菜籽粕中硫甙、总酸、多肽、蛋白质及氨基酸含量。
1.6 测定指标及方法
参照文献[9],采用氯化钯比色法测定菜籽粕发酵前后硫甙的含量;采用杜马斯全自动定氮仪测定样品粗蛋白含量;参照GB/T 22492-2008 大豆肽粉的测定方法测定多肽含量[10];参照文献[11]采用滴定法测定发酵前后总酸含量(结果以乳酸计);采用氨基酸自动分析仪测定发酵前后菜籽粕氨基酸含量变化。每个指标测3个重复。
1.7 数据统计与分析
正交试验数据通过软件SPSS19.0中的一般线性模型分析,结合Duncan法进行多重比较,结果以平均值表示,以<0.05作为差异显著性判断标准。
2 结果
2.1 不同混菌比例对总变化率的影响
对以总变化率M为指标的正交试验进行极差分析(表3),结果显示当3株菌组合比例为嗜酸乳杆菌﹕酿酒酵母﹕枯草芽孢杆菌=1﹕3﹕2时,总变化率M最大。枯草芽孢杆菌对总变化率的影响最大,酿酒酵母次之,嗜酸乳杆菌的影响最小。正交试验中包含该最佳组合,且总变化率为99.55%,明显高于其他处理,由此将后期混菌组合设为嗜酸乳杆菌﹕酿酒酵母﹕枯草芽孢杆菌=1﹕3﹕2。
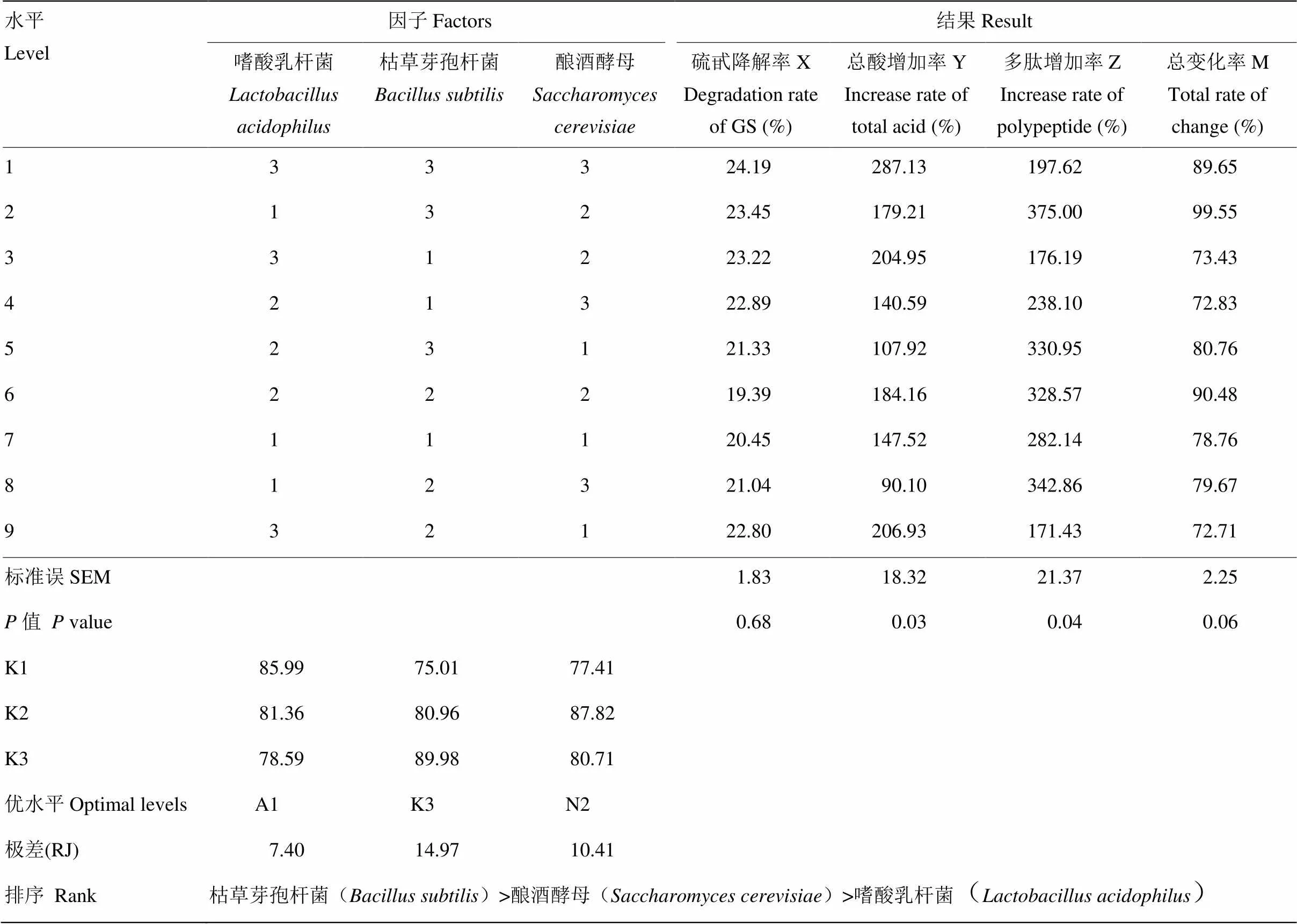
表3 混菌接种量L9(34)正交试验
2.2 混菌固态发酵菜籽粕工艺优化
混菌固态发酵菜籽粕工艺优化L16(45)正交试验结果见表4。通过极差分析可知,最佳发酵工艺条件为温度:33℃、料水比:1﹕1、时间:84h、接种量:6%,在该工艺下,总变化率理论上最高。温度对总变化率的影响最大,时间和料水比次之,接种量对总变化率的影响最小。
2.2.1 不同因素和水平对总变化率M的影响 由表5可知,1水平温度(31℃)总变化率显著低于其他水平(< 0.05),2水平温度(33℃)总变化率要高于3水平(35℃)和4水平温度(37℃),但无显著差异(> 0.05)。2水平的料水比(1﹕1)总变化率高于其他水平(> 0.05)。3水平发酵时间(84h)总变化率高于其它水平,差异不显著(> 0.05)。接种量各水平对总变化率的影响差异不显著(> 0.05)。
2.2.2 不同因素和水平对硫甙降解率的影响 由表6可知,1水平温度下(31℃)硫甙降解率显著低于其他水平(< 0.05),2水平温度下(31℃)硫甙降解率最高。总变化率随料水比水平的提高而增加,但无显著差异(> 0.05)。随时间的延长,硫甙降解率呈升高的趋势,4水平时间(96h)的硫甙降解率高于其他水平,但差异不显著(> 0.05)。接种量各水平对硫甙降解率无显著影响(> 0.05)。

表4 混菌发酵多因素试验结果

表5 不同因素和水平对总变化率M的影响
同列数据标不同小写字母表示差异显著(<0.05)。下同
Valves in the same row with different small letter mean significant difference (<0.05). the same as below

表6 不同因素和水平对硫甙降解率的影响
2.2.3 不同因素和水平对总酸和多肽增加率的影响 不同因素和水平对总酸和多肽增加率的影响方差分析见表7和表8。由表可知,温度对总酸增加率的变化呈先升高后降低的趋势,在2水平温度(33℃)时达到最大值,显著高于1水平温度(31℃)(<0.05)。料水比对总酸增加率的影响亦先升高后降低。当发酵时间为3水平时(84h)总酸增加率达到最大。接种量和料水比对总酸增加率的影响差异不显著(> 0.05)。1水平的料水比(1:0.8)多肽增加率最高,发酵时间和接种量对多肽增加率无显著影响(> 0.05)。

表7 不同因素和水平对总酸增加率的影响
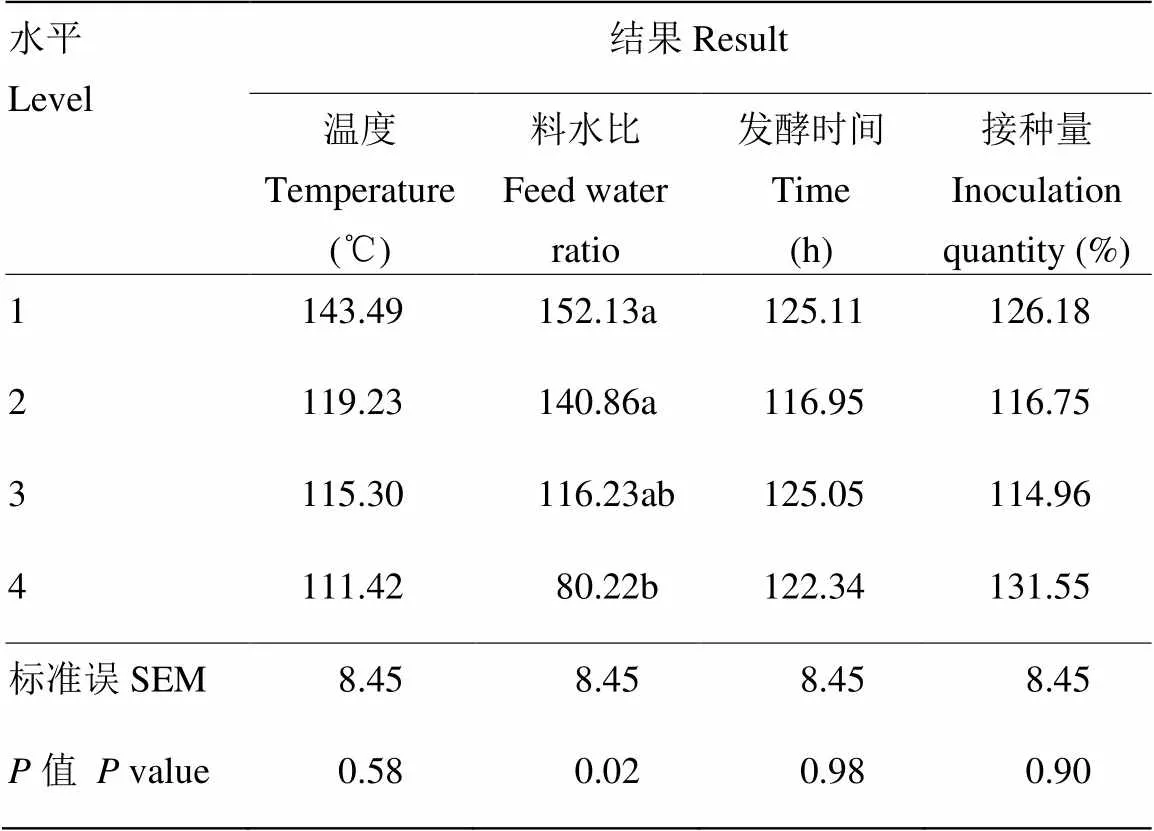
表8 不同因素和水平对多肽增加率的影响
2.3 中试验证试验
参照混菌发酵多因素结果,设定试验因素为温度:33℃、料水比:1﹕1、时间:84h、接种量:6%,中试发酵40kg菜籽粕,发酵结束后测得硫甙降解率为48.79%,总酸增加率为499.65%,多肽增加率为148.37%,总变化率为131.36%,接近于试验组中最高的总变化率134.04%。
2.4 最佳发酵条件下菜籽粕氨基酸及其他营养成分含量变化
中试发酵后氨基酸含量变化见表9。由表可知发酵菜籽粕粗蛋白较发酵前提高了5.26%,丝氨酸、苏氨酸、谷氨酸、脯氨酸、丙氨酸、缬氨酸、赖氨酸均有较大程度的提高。
3 讨论
3.1 各菌株添加量及不同组合比例对发酵菜籽粕效果的影响
本试验采用三因素三水平正交试验探究各菌株添加量及比例对发酵菜籽粕效果的影响。本试验所用的嗜酸乳杆菌、枯草芽孢杆菌和酿酒酵母均列入我国农业农村部《饲料添加剂品种目录》[12],符合农业农村部关于饲料微生物添加剂的相关规定。嗜酸乳杆菌对总变化率的影响显著(< 0.05),且随着嗜酸乳杆菌接种量的增高,总变化率呈降低的趋势,这可能是因为过多的乳酸菌在发酵前期产生大量的有机酸降低了基质pH,在一定程度上抑制了枯草芽孢杆菌和酿酒酵母的生长[13-14]。嗜酸乳杆菌与枯草芽孢杆菌及酿酒酵母在发酵过程中存在协同及共生作用[15]。发酵前期,枯草芽孢杆菌和酿酒酵母利用发酵体系中的蛋白及碳水化合物的能力较强,能够快速分解蛋白质形成更易被动物和微生物利用的多肽和氨基酸,促进了嗜酸乳杆菌的增殖,同时进一步降低发酵基质pH,有效的抑制杂菌的污染[16]。随着发酵体系内氧气的消耗及pH的降低,枯草芽孢杆菌的生长受到抑制,酿酒酵母也从有氧发酵进入厌氧发酵。孙林等的研究显示嗜酸乳杆菌和蜡样芽胞杆菌对发酵菜籽粕的交互作用达到显著水平[17]。蒋玉琴等使用不同比例的乳酸菌、酵母菌、少孢根霉发酵菜籽粕效果要优于单菌发酵[18]。

表9 发酵菜籽粕氨基酸及其他营养成分变化(风干基础)
3.2 不同因素及水平对发酵菜籽粕效果的影响
温度是影响发酵效率的重要因素。每种微生物都有其最适生长温度,多菌株形成的微生物区系亦有其最适温度范围,超过或低于其最适温度均不利于微生物的生长[19]。其次,温度能直接影响微生物源蛋白酶及纤维素酶活性,从而间接影响发酵效果。微生物发酵是一个代谢产热的过程,温度过高会导致发酵饲料内部产热过快造成热量聚集,不利于微生物的生长[20]。高冬余等的研究表明,温度对发酵菜籽粕效果的影响达到极显著的水平,且在一定范围内发酵效果随温度的升高而降低[21]。发酵时间是影响发酵菜籽粕效果的另一个重要因素[22]。选择合适的发酵时间,不但能有效的提高发酵效率,还能减少发酵过度而产生不必要的浪费。本研究发现,随时间的增加,总变化率呈先增高后降低的趋势,这说明微生物发酵菜籽粕并非是时间越久越好。随着时间的延长,发酵基质内大量的微生物会优先利用被分解的小分子蛋白合成自身微生物菌体蛋白,发酵基质内的多肽含量也是先增高后降低。总酸含量随时间变化不大,这主要是不同微生物相互作用维持内环境稳态的结果[3]。料水比是影响微生物活性的重要因素,水分过高会导致基质黏性增加并减少基质内气体交换,但能促进基质内营养成分和菌体的流动性[23];而基质水分过低会影响乳酸菌的活性,菌体生长受到抑制,酶的产量减少[24]。本试验最佳料水比为1﹕1,这一研究结果与肖萌等的报道类似[19]。本研究还发现,接种量对总变化率及其他指标的影响不显著,这可能是随着时间的延长,各接种量最终都会达到一个基质容量内的最大微生物量[25]。
3.3 发酵对菜籽粕氨基酸含量的影响
动物对蛋白质和氨基酸的利用率是评价蛋白原料质量的重要标准。原料中蛋白分子量越小,多肽含量越高,氨基酸组成越平衡,越容易被动物消化吸收[26]。本试验发现微生物发酵处理不仅提高了菜籽粕中多肽的含量,粗蛋白及各氨基酸含量也均有不同水平的提高,其主要原因是随着发酵的进行,微生物消耗碳水化合物产生的“浓缩效应”,导致粗蛋白和氨基酸含量提高。同时大部分必需氨基酸含量提高的比例要高于粗蛋白提高的比例,其原因可能是微生物分泌的转氨酶利用转氨基作用将非必需氨基酸合成为动物的必需氨基酸,同时微生物还能利用饲料中的各种非蛋白氮合成蛋白氮,提高各种氨基酸的比例。精氨酸是动物体内生物学功能最多的一种氨基酸,在体内物质代谢、免疫调节等方面有重要作用,同时精氨酸含量升高还有促进动物对其他氨基酸吸收利用的作用[27]。酪氨酸可在体内酪氨酸羧化酶的作用下转变为多巴胺、肾上腺素、去甲肾上腺素等物质,对体内内环境稳定及神经-体液调节系统有重要的作用[28]。赖氨酸是畜禽日粮中的第一限制性氨基酸,赖氨酸含量的提高有助于促进日粮氨基酸平衡并提高蛋白利用效率[29]。低蛋白日粮和氨基酸平衡是近年来动物营养学研究的热点之一,促进原料氨基酸平衡可以准确预测原料营养价值,减少不必要的氮排放对环境污染带来的影响[30]。本研究结果表明,发酵菜籽粕可以提高菜籽粕多肽和各种氨基酸的含量,有助于促进原料氨基酸平衡,为低蛋白日粮和氨基酸平衡的研究提供一种新的理论和方法。
4 结论
混菌固态发酵菜籽粕最佳发酵工艺为发酵温度33℃,料水比1﹕1,发酵时间84h,接种量6%,其中混菌组合方式为嗜酸乳杆菌﹕枯草芽孢杆菌﹕酿酒酵母=1﹕3﹕2。在该工艺条件下,发酵菜籽粕硫甙降解率为48.79%,总酸增加率为499.65%,多肽增加率为148.37%,总变化率为131.36%。通过对菜籽粕发酵工艺优化,降低了菜籽粕中硫甙的含量并改善菜籽粕营养价值,提高了菜籽粕中多肽和总酸的含量,具备一定的益生价值。该发酵工艺时间短,效率高,操作简单,易于推广,发酵后可以直接添加在家禽和家畜饲料中,但发酵菜籽粕对家禽和家畜生产性能的影响及最适用量还需进一步的研究。
[1] 蔡辉益, 张姝, 邓雪娟, 刘国华,常文环, 闫海洁. 生物饲料科技研究与应用. 动物营养学报, 2014, 26(10): 2911-2923.
CAI H Y, ZHANG S, DENG X J, LIU G H, CHANG W H, YAN H J. Research and application of biological feed technology., 2014, 26(10): 2911-2923. (in Chinese)
[2] YANG X, CHEN H, GAO H L, LI Z H. Bioconversion of corn straw by coupling ensiling and solid-state fermentation., 2001, 78(3): 277-280.
[3] EL-BATAL A L, KAREM H A. Phytase production and phytic acid reduction in rapeseed meal byduring solid state fermentation., 2001, 34(8): 715-720.
[4] 杨玉娟,姚怡莎,秦玉昌,邱静,李军国,李俊,谷旭. 豆粕与发酵豆粕中主要抗营养因子调查分析. 中国农业科学, 2016, 49(3): 573-580.
YANG Y J, YAO Y S, QIN Y C, QIU J, LI J G, LI J, GU X. Investigation and analysis of main AFN in soybean meal and fermented soybean meal., 2016, 49(3): 573-580. (in Chinese)
[5] ASHAYERIZADEH A, DASTAR B, SHAMS S M, SADEGHI M A, ZEREHDARAN S. Effects of feeding fermented rapeseed meal on growth performance, gastrointestinal microflora population, blood metabolites, meat quality, and lipid metabolism in broiler chickens., 2018, 216(18):183-190.
[6] ROZAN P, VILLAUME C, BAU H M, SCHWERTZ A, NICOLAS J P, MEJEAN L. Detoxication of rapeseed meal by: a first step towards rapeseed protein concentrate.1996, 31(1): 85-90.
[7] DRAZBO A, OGNIK K, ZAWORSKA A, FERENC K, JANKOWSKI J. The effect of raw and fermented rapeseed cake on the metabolic parameters, immune status, and intestinal morphology of turkeys., 2018, 97(11): 3910-3920.
[8] 朱少华, 曲露, 李小定, 刘平,王萌,刘硕. 菜籽粕固态分步发酵的工艺研究. 中国油脂, 2014, 39(7):37-41.
ZHU S H, QU L, LI X D, LIU P, WANG M, LIU S. Two-step solid fermentation process of rapeseed meal., 2014, 39(7):37-41. (in Chinese)
[9] 刘绚霞,杨莉. 分光光度法测定油菜籽中硫代葡萄糖甙. 陕西农业科学, 2002(6): 5-7.
LIU X X, YANG L. Determination of glucosinolate in rapeseed meal by spectrophotometry., 2002(6): 5-7. (in Chinese)
[10] GB/T 22492. (2008). 大豆肽粉. 中华人民共和国国家标准. 北京.
GB/T 22492. (2008). Soy peptides powder. Beijing: Standardization Administration of the People's Republic of China. (in Chinese)
[11] 安华明, 刘明, 杨曼, 樊卫国. 刺梨有机酸组分及抗坏血酸含量分析. 中国农业科学, 2011, 44(10): 2094-2100.
AN H M, LIU M, YANG M, FAN W G. Analysis of main organic acid compositions intratt., 2011, 44(10): 2094-2100. (in Chinese)
[12] 饲料添加剂品种目录(2013). 中华人民共和国农业部公报, 2014, (1):1-4.
Variety Catalogue of Feed Additives (2013). Gazette of the Ministry of Agriculture of the People’s Republic of China. 2014, (1):1-4. (in Chinese)
[13] 刘玉婷,吴明阳,靳艳玲,沈维亮,方扬,赵海. 鼠李糖乳杆菌利用甘薯废渣发酵产乳酸的研究. 中国农业科学, 2016, 49(9): 1767-1777.
LIU Y T, WU M Y, JIN Y L, SHEN W L, FANG Y, ZHAO H. Lactic acid fermentation byfrom sweet potato residue., 2016, 49(9): 1767-1777.
[14] COUTO S R, SANROMAN M A, Application of solid-state fermentation to food industry. A review., 2006, 76(3): 291-302.
[15] 王赫, 朱风华, 陈甫, 徐进栋, 边学伟, 张瑞星, 朱连勤. 不同发酵时间对乳酸菌发酵饲料中主要营养物质、乳酸菌和乳酸含量的影响. 中国家禽, 2017, 39(10): 27-31.
WANG H, ZHU F H, CHEN F. XU J D, BIAN X W, ZHANG R X, ZHU L Q. Effects of different fermentation time on main nutrients, lactic acid bacteria and lactic acid in feed fermented with lactic acid bacteria., 2017, 39(10): 27-31. (in Chinese)
[16] KASPRZAK M M, HOUDIJK G M, OLUKOSI O A, APPLEYARD H, KIGHTLEY S P J, CARRE P, WISEMAN J. The influence of oil extraction process of different rapeseed varieties on the ileal digestibility of crude protein and amino acids in broiler chickens.2017, 227: 68-74.
[17] 孙林, 李吕木, 张邦辉, 许平辉, 付宏赟, 徐宝同. 多菌种固态发酵去除菜籽粕中的植酸. 中国油脂, 2008, 24(08): 60-63.
SUN L, LI L M, ZHANG B H, XU P H, FU H Y, XU B T. Removal of phytic acid from rapeseed meal by solid state fermentation with multi-strains., 2008, 24(08): 60-63. (in Chinese)
[18] 蒋玉琴, 李荣林, 张玳华, 邵明诚, 高家骅. 复合菌脱毒菜籽饼粕及其应用:Ⅰ不同处理条件下复合菌体系发酵对菜籽粕硫甙的降解. 江苏农业学报, 1999, 15 (2): 104-106.
JIANG Y Q, LI R L, ZHANG D H, SHAO M C, GAO J H. Detoxication of rapeseed meal with multi-microbial solution and its applicationⅠ. effect of fermentation of multi-microbial solution on the degradation of rapeseed meal glucosinolate under different conditions., 1999, 15(2): 104-106. (in Chinese)
[19] 肖萌,王远亮. 双低菜籽粕混菌固态发酵条件的优化. 西北农林科技大学学报, 2015, 43(9): 1-8.
XIAO M, WANG Y L. Fermentation of double lower rapeseed meal by mixed solid culturing., 2015, 43(9): 1-8. (in Chinese)
[20] Li D, Xi P, Gong L, FAN S J, HUANG C H. Determination of apparent ileal amino acid digestibility in rapeseed meal and cake processed at different temperatures using the direct and difference method with growing Pigs., 2002, 56(5): 339-349.
[21] 高冬余, 李吕木, 许发芝, 张邦辉, 吴胜华. 微生物固态厌氧发酵菜籽粕的研究. 食品与发酵工业, 2010, 36 (03): 75-79.
GAO D Y, LI L M, XU F Z, ZHANG B H, WU S H. Study on solid -state anaerobic fermentation of rapeseed meal with microorganism.2010, 36 (03): 75-79. (in Chinese)
[22] 刘长松, 潘忠礼, 何荣海, 宋金彩. 混菌固态发酵菜粕对肉仔鸡生长性能、血清生化指标及免疫功能的影响. 中国家禽, 2015, 37(24): 24-27.
LIU C S, PAN Z L, HE R H, SONG J C. Effects of mixed bacteria solid-state fermented rapeseed meal on growth performance, serum biochemical parameters and immune function of broilers., 2015. 2015, 37(24):24-27. (in Chinese)
[23] 詹湉湉, 柯芙容, 陈庆达, 张少华, 许丽惠, 王全溪, 王长庚. 发酵时间和料水比对豆粕发酵的影响. 福建农林大学学报(自然版), 2015, 44(2):193-197.
ZHAN T T, KE F R, CHEN Q D, ZHANG S H, XU L H, WANG Q X, WANG C G. Effects of fermentation time and material-water ratio on soybean meal fermentation., 2015, 44(2):193-197. (in Chinese)
[24] GRUBB C D, ABEL S. Glucosinolate metabolism and its control.2006, 11(2): 89-100.
[25] 王芳, 李学文, 廖亮, 黄瑜, 侯俊楠, 杨晶, 谢元, 唐如锴, 李丹. 响应面法优化油菜籽粕中硫苷酶解工艺及其降解产物抑菌作用的初步研究. 食品工业科技, 2017, 38(5): 264-268.
WANG F, LI X W, LIAO L, HUANG Y, HOU J N, YANG J, XIE Y, TANG R K, LI D. Optimization of enzymatic hydrolysis condition of glucosinolates from rapeseed meal by response surface methodology and the preliminary research of its bacteriostasis., 2017, 38(5): 264-268. (in Chinese)
[26] 付敏, 何军, 余冰, 郑萍, 黄志清, 毛湘冰, 虞洁, 陈代文. 混菌固态发酵对菜籽饼营养价值及抗营养因子含量的影响. 动物营养学报, 2013, 25(7): 1579-1586.
FU M, HE J, YU B, ZHENG P, HUANG Z Q, MAO X B, YU J, CHEN D W. Effects of mixed microbial solid-State fermentation on nutrient values and anti-nutritional factor contents of rapeseed cake., 2013, 25(7): 1579-1586. (in Chinese)
[27] MO W, W, WU X J, JIA G, ZHAO H, C,HEN X L, TANG J Y, WU C M, CAI J Y, TIAN G, WANG J, LIU G M. Roles of dietary supplementation with arginine or N-carbamylglutamate in modulating the inflammation, antioxidant property, and mRNA expression of antioxidant-relative signaling molecules in the spleen of rats under oxidative stress.2018(3):322-328.
[28] WASTON A, WAYMAN J, KELLY R, FEUGIER A, BIOGE V. Increased dietary intake of tyrosine upregulates melanin deposition in the hair of adult black-coated dogs., 2018(4): 422-428.
[29] ZHONG H, YIN Y, CHEN X. The effect of various proportions of Canola type rape-seed oil meal on amino acid digestibility and nutrient metabolism of layer chicken ration.1997, 29(3): 107-109.
[30] 张桂杰,鲁宁,谯仕彦. 低蛋白质平衡氨基酸饲粮对生长猪生长性能、胴体品质及肠道健康的影响. 动物营养学报, 2012, 24(12): 2326-2334.
ZHANG G J, LU N, QIAO S Y. Effects of low protein diets balanced with amino acids on growth performance, carcass characteristic and intestinal health of growing pigs.2012, 24(12): 2326-2334. (in Chinese)
Optimization of Solid State Fermentation for Rapeseed Meal with Mixed Strains
WU ZhengKe, LIU GuoHua, LI Yang, ZHENG AiJuan, CHANG WenHuan, CHEN ZhiMin, CAI HuiYi
(Feed Research Institute of Chinese Academy of Agricultural Sciences/National Engineering Research Center of Biological Feed/Key Laboratory of Feed Biotechnology of Agricultural Ministry, Beijing 100081)
【Objective】The aim of this study was to optimize the solid state fermentation conditions for rapeseed meal with mixed strains and to improve the feeding value of rapeseed meal. It would provide a reference for the application of fermented rapeseed meal in animal husbandry in China.【Method】The rapeseed meal used in this study was conventional rapeseed meal. Three strains of,andwere used, and the glucosinolates degradation rate (X%), total acid increase rate (Y%), polypeptide increase rate (Z%) were used as evaluation indexes. Method M was used as the comprehensive evaluation index (M=0.7*X+0.15*Y+0.15*Z). In the experiment one, the effects of different strains addition levels and the best mixed ratio of the three strains in fermented rapeseed meal were investigated through L9(34) three-factors and three-levels orthogonal array design methods. Based on the result of experiment one, an L16(45) four-factors and four-levels of orthogonal array design experiment was designed to explore the optimal conditions of mixed strains solid state fermentation of rapeseed meal, and the fermentation temperature, feed water ratio, time, and inoculation quantity were selected as experimental factors. 【Result】The results showed as follow: (1) L9(34) orthogonal array design showed that the optimal mixed strains ratio of fermented rapeseed meal were::= 1:3:2. Under these condition, the contents of glucosinolates was degraded by 23.5%, the total acid and polypeptide increase rate were 179.2% and 375.0%, respectively. (2) Based on the result of experiment one, the range analysis of experiment two showed that the optimal conditions of mixed strains solid state fermentation of rapeseed meal were as follows: fermentation temperature was 33 °C, feed water ratio was 1:1, time was 84h and inoculation quantity was 6%. The pilot test of this conditions showed that the contents of glucosinolates was degraded by 48.8%, the total acid increase rate was 499.7%, the polypeptide increase rate was 148.4%, and the total change rate M was 131.4%. The results were in line with our expectation. The lowest total change rate M was noted when the temperature was 31 °C, and the total change rate M in temperature 33 °C was higher than 35 °C and 37 °C, but the difference between groups was not significant (> 0.05). The higher M was also noted when feed water ratio was 1:1.0 and fermentation time was 84h. No significant differences in M were observed between conditions in different levels of inoculation quantity. (3) The fermentation of rapeseed meal by mixed strains also increased the content of CP (37.05% vs. 40.90%) and decreased the concentration of crude fiber (17.47% vs. 16.72%). The amino acid composition of rapeseed meal and fermented rapeseed meal showed that fermentation increased the content of several amino acids in rapeseed meal, especially Asp, Thr, Ser, Glu, Pro, Ala, and Lys. The greatest change caused by fermentation was for glucosinolates, which decreased from 36.08 µmol·g-1to 18.48 µmol·g-1. The fermentation of rapeseed meal increased the content of polypeptides (from 0.84% to 2.09%) and increased the content of total acid (from 1.01% to 6.05%) compared to unfermented rapeseed meal. The concentration of crude fat was similar in rapeseed meal and FRSM (4.31% and 4.39%).【Conclusion】The optimal fermentation conditions could effectively degrade the glucosinolates and increase the content of polypeptide and total acid in rapeseed meal, so the nutritional value of rapeseed meal was significantly improved.
rapeseed meal; mixed strains; solid state fermentation; orthogonal design
2018-08-02;
2019-09-20
现代农业产业技术体系国家肉鸡产业技术体系项目(CARS-42)
吴正可,E-mail:wzk199107@163.com。通信作者刘国华,E-mail:liuguohua@caas.cn
(责任编辑 林鉴非)
