3.0T磁共振三维容积内插屏气序列在骨骼模型重建中的应用*
2020-01-10孙允龙冉君张亚卢小龙石志良方忠李锋
孙允龙冉君张亚卢小龙石志良方忠李锋*
长久以来,对组织器官标本观察、解剖是医学生了解和掌握解剖结构的主要途径[1],但组织器官标本高昂的维护成本和国人传统的殡葬观念使得医学生接触标本的机会大幅度减少,对于新兴的替代教学资源的需求与日俱增[2-3]。随着增材制造技术的广泛应用,越来越多的3D打印模型被用来进行临床教学、医患沟通、手术规划[4-7]、术中辅助操作[6,8]及青年医师培训[9-10]等。虽然目前用于骨骼模型重建的数据来源仍以计算机断层扫描(computed tomography,CT)为主,但其在实际应用时仍存在诸多限制。众所周知,CT利用X射线进行组织成像,在检查过程中受试者将接受大剂量电离辐射,因此CT并不适用于大规模采集健康人群的图像数据。其次,在重建骨肿瘤模型时,由于CT的软组织分辨率较低,为了提高组织间对比度,常需向患者体内注射对比剂,注射过程不仅包含侵入性操作,而且注入的对比剂存在诱发过敏反应的风险,严重时可危及患者生命。与 CT相比,磁共振成像(magnetic resonance imaging,MRI)具有无辐射、任意方向成像的优势,已在临床上得到广泛应用[11],但利用MRI数据进行骨重建的案例鲜有报道。为此,本文试图利用磁共振图像数据进行医学模型重建并探讨其适宜参数和临床应用价值。
1 材料与方法
1.1 测试模型的设计与制作
借助计算机辅助设计(computeraideddesign,CAD)软件设计扫描用的模型(见图1),以*.STL(stereolithography,STL)的格式保存并导入光固化3D打印机(LD-003,深圳创想三维)中进行制备,模型切片厚度为50 m,首层曝光时间80 s,模型制备所用LCD刚性光敏树脂购自深圳创想三维有限责任公司。该模型借助3根中空且互相垂直的圆柱体模拟空间三维坐标系中的X、Y、Z轴。为了在扫描过程中便于固定,在模型底面设计一圆形底座。模型顶端开口,并设计相应的密封盖,密封盖上设计有2个通孔,便于向模型内部补充液体。基于该设计思路生成4种不同尺寸的模型,每种模型制备5个样品。

图1 扫描模具设计图及实物图:A.模具正视图;B.模具侧视图;C.模具俯视图;D.模具成品;E.模具尺寸(单位:mm)
1.2 模型灌注液的配置
向1000.00 mL纯水中依次加入3.75gNiSO46H2O(Sigma-Aldrich,美国)、5.00gNaCl(Sigma-Aldrich,美国)及10 mL碘普罗胺注射液(Bayer,德国),在37℃下充分搅拌直至溶质完全溶解,常温保存[12]。在扫描开始前,将灌注液注入模型空腔中,加盖密封盖后使用热熔胶枪(MNT-815303,美耐特)进行封闭,为保证模型内部完全充满灌注液。用5mL注射器经密封盖上的通孔向模型内部继续注入,直至其从另一个孔溢出。
1.3 扫描仪器
分别利用GE Discovery CT750 HD宝石能谱CT和SIEMENS MAGNETOM 3.0T Skyra高场强超导磁共振扫描仪对处理后的模型进行扫描,在进行磁共振扫描时选用18通道线圈。对CT及MRI扫描所得到的图像数据导出并以医学数字图像(digitalimagingandcommunicationsin medicine,DICOM)格式存储。
1.4 扫描参数
CT扫描参数为:球管电压120kV,球管电流为100mA,像素尺寸为0.625 mm×0.625 mm×0.625 mm。磁共振扫描序列分别选用常规序列(T1WI-TSE、T2WI-TIRM)及 3DVibe序列。3D-Vibe序列又进一步细分为各向同性及各向异性序列,以后缀“I”表示各向同性(isotropic,I),后缀“A”表示各向异性(anisotropic,A),相关参数如表1所示。
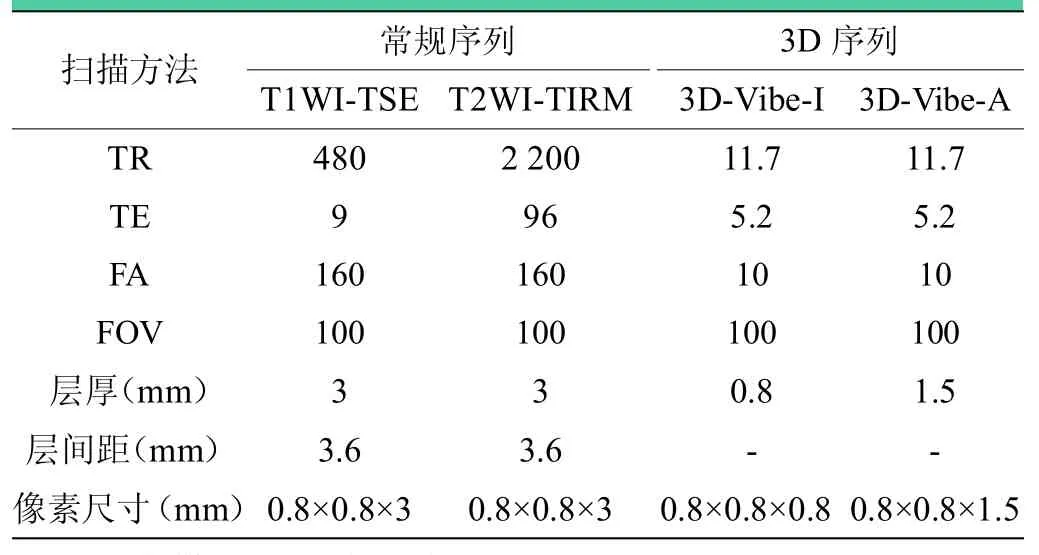
表1 MRI序列参数
1.5 三维模型的重建方法
模型重建的基础是在图像数据中勾选感兴趣区域(region of interest,ROI)[13]。将扫描到的DICOM数据导入Mimics 20.0后,应用自动阈值分割算法实现MRI图像数据中ROI的分割。与CT成像原理不同,MRI数据中各像素点间明暗的差异代表物体不同部位的氢原子核在外加磁场作用下产生的驰豫时间不同[14]。在处理MRI数据时,因不同序列外加磁场的参数不同,其像素点所反映的弛豫时间也不同。因此,在处理同一序列扫描得到的不同模型的图像数据时,我们选用相同的阈值范围。在Mimics中,所有ROI的集合称为蒙版(Mask),利用Mask可生成最终的重建模型,将生成的模型以*.STL的格式进行存储,STL格式由美国3DSystems公司提出,其基本原理是利用数量不等的三角面片拟合物体的外貌特征[15]。将原始模型与重建后所得模型导入3-Matic中,通过圆弧配准的方式,将两个模型置于同一个坐标系下。将重建模型与原始模型分别进行布尔并集和布尔交集运算,得出相应的体积大小,并利用下方的公式(1)计算重建模型与原始模型间的匹配度(MatchingDegree),具体流程如图2所示。

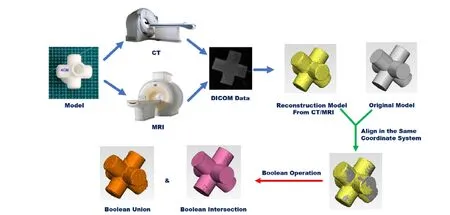
图2 匹配度计算流程图
1.6 动物实验
结合之前的实验结果将适宜骨重建的磁共振扫描参数应用于新西兰大白兔的股骨模型的重建中。选用2只健康成年雄兔,体重分别为3.3kg及3.5 kg,所用动物由华中科技大学同济医学院附属同济医院实验动物中心提供,所有参与动物实验人员均参加湖北省试验动物技术培训并通过相关考试,实验得到华中科技大学同济医学院附属同济医院医学伦理委员会的批准。在进行扫描前预先配置浓度为3%的戊巴比妥钠(Sigma,美国)溶液用于麻醉状态的维持。按照1mL/kg将戊巴比妥钠溶液经耳缘静脉注入兔子体内,分别进行CT及MRI扫描,随后通过空气栓塞的方式处死动物,分离股骨标本。参照1.5的方法进行股骨模型重建,计算模型间匹配度,最后利用3D打印技术制备股骨模型,并将所有模型置于同一坐标原点,结合主观及客观两方面共同评价股骨模型的精准性。
1.7 统计学方法
重建模型的匹配度以均数±标准差的形式表示,进行单因素方差分析,并进行Duncan多重比较,所用统计软件为SPSS 19.0,绘图软件为Graphpad Prism 7.0,为差异有统计学意义。
2 结果
不同数据来源的重建模型的匹配度如表2所示,CT组与T1WI-TSE及T2WI-TIRM模型组间匹配度比较,差异有统计学意义(P<0.01);3D-Vibe-I与3D-Vibe-A模型组间匹配度比较,差异有统计学意义(P<0.05);CT与3D-Vibe-I模型组间匹配度比较,差异无统计学意义(P>0.05);T1WITSE与T2WI-TIRM模型组间匹配度比较,差异无统计学意义(P>0.05)。
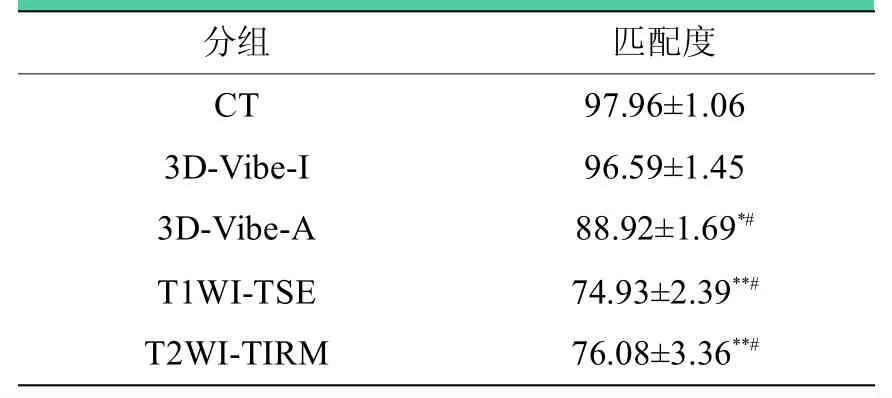
表2 不同数据来源的重建模型间匹配度(%)
分别选用CT、磁共振T2WI序列及3D-Vibe-I序列数据进行兔股骨模型重建并打印3D模型,扫描图像分别如图3-5所示。
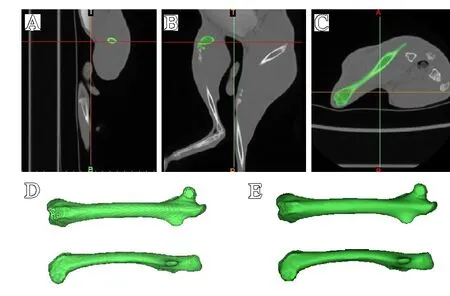
图3 基于CT数据重建股骨模型:A.矢状面;B.冠状面;C.横断面;D.基于CT数据生成的蒙版;E.经过后期处理后生成的模型
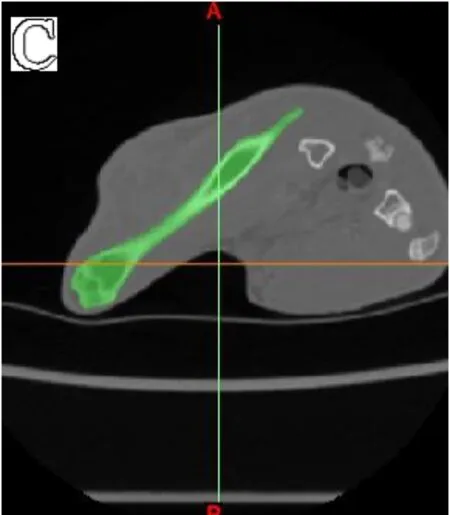
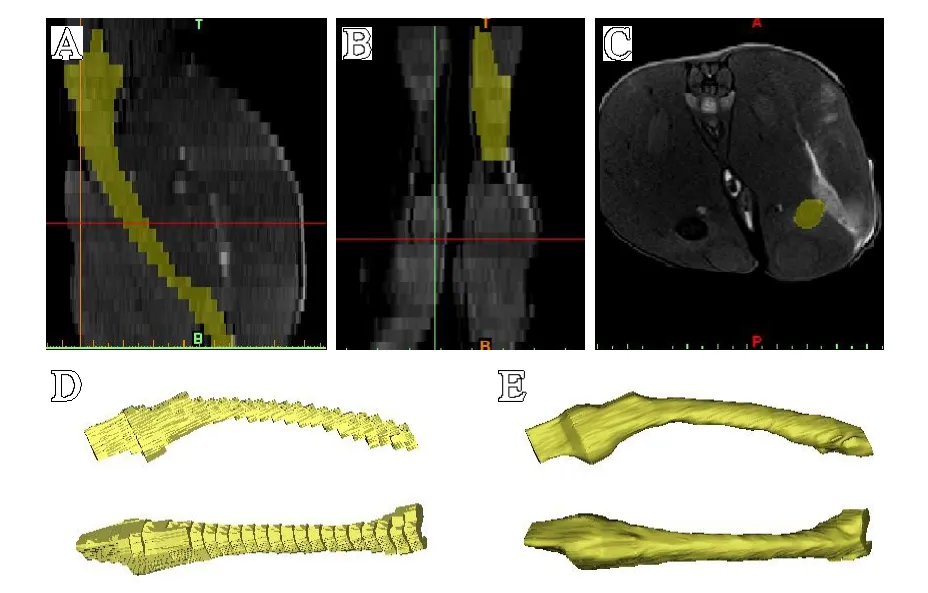
图4 基于T2WI-TIRM数据重建股骨:A.矢状面;B.冠状面;C.横断面;D.生成的蒙版;E.经过后期处理后生成的模型
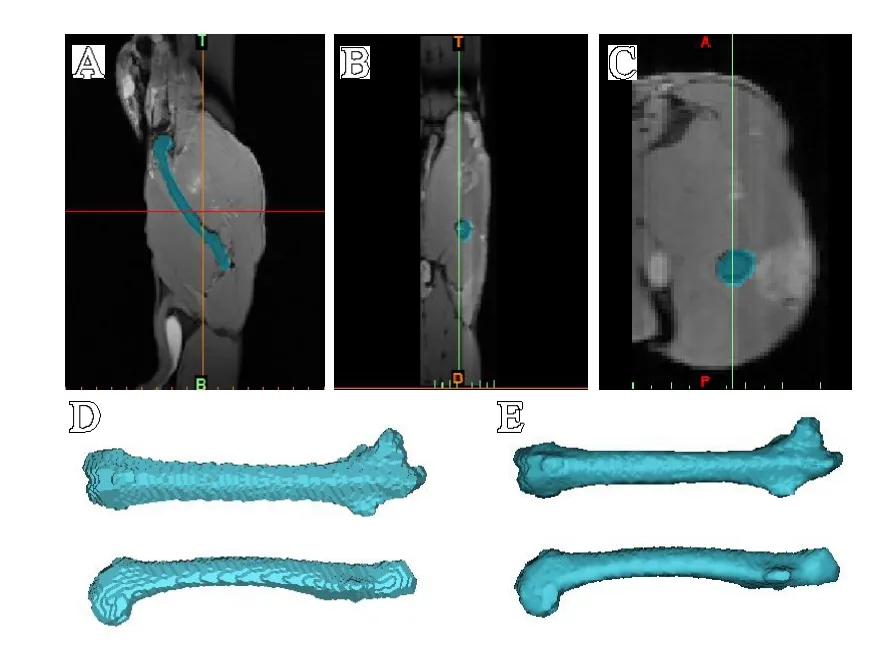
图5 基于3D-Vibe数据重建股骨:A.矢状面;B.冠状面;C.横断面;D.生成的蒙版;E.经过后期处理后生成的模型
结合图3至图5的数据可以看出,与利用CT组模型相比,基于T2WI-TIRM数据生成的蒙版具有明显的断层现象,侧视图可见模型曲度较真实股骨干明显增大。相比之下,3DVibe-I组模型外观精细程度较T2WI-TIRM组模型有显著提高,尽管在模型重建过程中需要大量的人工作业,但重建后的模型外观与 CT重建模型相似(见图6)。鉴于目前仍以CT数据模型作为骨重建的“金标准”,所以进一步将模型与T2WI-TIRM模型组进行匹配后发现,3D-Vibe-I组股骨重建模型与CT股骨重建模型间的匹配度为(89.23±2.1)%,而T2WI-TIRM 组仅为(78.69±4.2)%,两者比较差异有统计学意义(P<0.01),见图7。因此可以得出,磁共振3D-Vibe-I序列图像数据较常规磁共振序列图像数据更适合进行硬组织3D打印模型重建。
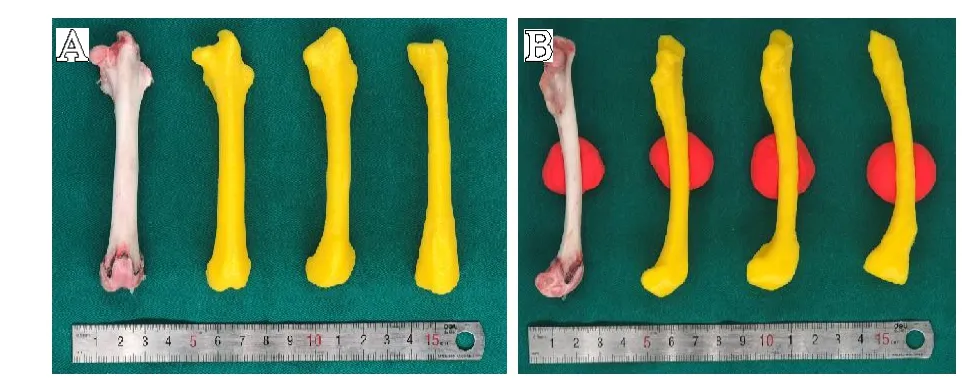
图6 不同数据来源所获得的股骨重建模型,图A为正视图,图B为侧视图(图B中红色团块为辅助固定的橡皮泥),从左侧至右侧依次为股骨实物、CT股骨模型、3D-Vibe股骨模型、T2WI-TIRM股骨模型
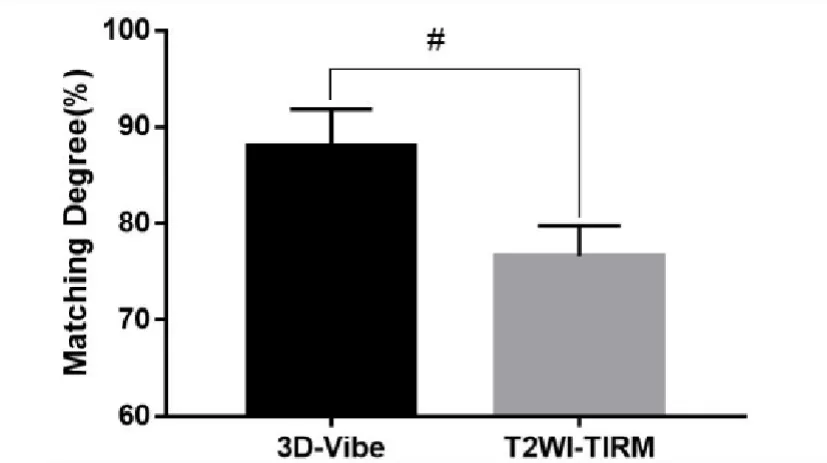
图7 3D-Vibe数据重建模型与T2WI-TIRM数据重建模型匹配度对比(#表示 P<0.01)
3 讨论
3.1 不同磁共振序列所重建的模型间匹配度差异的原因
本研究试图利用MRI图像数据进行模型的重建,并将重建结果与CT数据所重建的模型进行比较。将所得到的图像数据导入Mimics软件中获取相应的重建模型,并利用该模型与原始模型间的匹配度衡量磁共振不同磁共振序列图像数据在三维重建中的应用价值。在实际操作过程中,在向空心模型灌水的过程中不可避免地混入气泡,这导致所有序列所得到的重建模型的匹配度均低于100%。经过计算,磁共振常规序列所得到的重建模型与3D-Vibe序列相比,其匹配度显著降低,具有统计学意义。对比不同序列间的各向参数并分析可能的原因,笔者认为这是由于各个序列所获得的图像数据中单个像素的尺寸差异所导致的。本实验中4种磁共振序列的单个像素尺寸分别为0.8mm×0.8mm×3mm(T1WI-TSE)、0.8mm×0.8mm×3mm(T2WI-TIRM)、0.8mm×0.8mm×0.8 mm(3D-Vibe-I),0.8 mm×0.8 mm×1.5 mm(3D-Vibe-A),由此可见,除3D-Vibe-I序列外,其余序列中单个像素外观均为长方体。在本研究中,所有的数据均为模型的矢状位图像,若采用常规MRI图像数据进行模型重建,其基于矢状面图像所得的冠状位及横断位图像均丢失大量细节,而3D-Vibe-I序列所获得的正方体像素使得重建所获得的冠状面及横断面图像依然保持较高的清晰度,这使得重建图像时可以从3个方面校正ROI,从而获得更精准的mask,有利于模型的重建。在针对兔股骨进行三维重建时发现3D-Vibe-I组模型的匹配度有所下降,这主要是因为之前的扫描对象仅为经过稀释的对比剂,其内部含有大量的游离水,使得在模型重建过程中可以利用类似调节阈值的方式重建模型。而在针对兔子股骨进行重建时,由于周围组织多样,ROI的获取大多是通过人工勾勒出来的,这在一定程度上增大了误差,但即便如此,利用3D-Vibe数据重建的股骨模型外观依然与CT重建的股骨模型相似度较高,匹配度为(89.23±2.1)%。
得益于高空间分辨率和出色的组织对比度,MRI已经成为评价骨与关节疾病最常用的检查手段。目前,大多数针对肌肉和骨骼MRI检查使用2D序列进行扫描,但随着3D各向同性序列的发展,更高的组织分辨率以及更薄的层厚使得 MRI诊断性能大幅提升[16]。有文献指出,磁共振3D-Vibe序列的信噪比(signalnoise ratio,SNR)是常规序列的4~5倍[17],较高的SNR有利于图像的分割,但会使扫描时间延长,增加了运动伪影的产生几率[18],但这仍不妨碍3D-Vibe序列在骨与关节模型重建中的应用。
3.2 利用MRI数据进行医学3D打印模型重建的优势与挑战
不同于CT,磁共振是利用核磁共振原理进行成像,即在外加的强大磁场作用下,人体内部的原子核被赋予相应的电磁能量,使原子核产生从低能级向高能级间的跃迁,当撤除外加磁场后,高能量的原子核回到初始状态所需的时间差异经数据处理后转变为图像中各像素点的明暗差异。MRI最大的优势在于其本身无辐射,并且可在任意方向成像,这使得用MRI采集健康人群的图像数据成为可能。MRI用于模型重建的另一个优势在于其较高的组织间对比度。结合不同的成像序列可应用于脊神经、臂丛[19]、子宫卵巢及前列腺[20]等软组织器官成像。
尽管MRI在成像方面有着CT无法比拟的优势,但将MRI数据实际应用于模型重建过程中依然要面对诸多挑战:目前尚无专门针对MRI数据进行医学影像重建的商业软件。类似Mimics的商业软件可以实现对MRI数据的读取,但在对图像进行分割的过程中依然是采用类似CT数据的分割方法,且在数据分割过程中依然需要大量人工操作介入,自动化程度不高,难以广泛普及。为了获取高清晰度的图像,在进行 MRI扫描时要兼顾扫描时间和信噪比的平衡,为了获取更高清晰度的图像,扫描时间往往需要延长,由于呼吸运动和心脏大血管的搏动等运动因素难以消除,过长的扫描时间会加重运动伪影[21],这在一定程度上限制了 MRI在某些解剖区域中的应用。
本研究表明,相较于常规序列,磁共振3D-Vibe各向同性序列更适合3D打印模型的建立。由于 MRI在扫描过程中不产生电离辐射,这使得利用磁共振3D各向同性序列采集健康人群的图像数据并进一步进行组织模型重建成为可能。这不仅有助于医学生更好地了解组织器官的空间结构,并可协助医生进行更精确的术前规划,具有广阔的应用前景。
