高脂饲料结合慢性应激致大鼠非酒精性脂肪肝的药物治疗
2020-01-10孙红爽乜春城李鹏霖刘永双高玲娜
孙红爽 乜春城 李鹏霖 刘永双 高玲娜
(衡水市人民医院,河北 衡水 053000)
非酒精性脂肪肝病(NAFLD)是一种与胰岛素抵抗、糖尿病、肥胖等代谢高危因素密切相关的应激性肝损伤,主要病理特征为脂肪在肝细胞内的过度沉积〔1〕。根据NAFLD的病程发展可以分为单纯性脂肪肝变性、脂肪性肝炎、肝脏纤维化、肝硬化及肝癌〔2〕。目前对于NAFLD的治疗并没有特效制剂,生活方式的改变是首要的,药物治疗多是针对其并发症如肥胖、糖尿病、血脂紊乱、高血压和炎症等〔3〕。前期研究,通过高热量饲料结合慢性应激成功建立NAFLD大鼠模型,该模型伴随明显的氧化应激和下丘脑-垂体-肾上腺轴(HPA)亢进〔4,5〕。因此,本研究主要从改善这两方面病变进行针对性药物治疗,选用“万能抗氧化剂”α-硫辛酸(LA)或抑制促肾上腺皮质激素(ACTH)释放药物赛庚啶(CYP)分别对高脂饲料结合慢性应激引起的大鼠NAFLD模型进行药物治疗,以观察两种药物对NAFLD模型的治疗作用特点。
1 材料与方法
1.1试剂与仪器 总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、三酰甘油(TG)测定试剂盒均购自长春汇力生物技术有限公司;超氧化物歧化酶(SOD)、丙二醛(MDA)、游离脂肪酸(FFA)测定试剂盒均购自南京建成生物工程研究所;肿瘤坏死因子(TNF)放射免疫分析试剂盒、皮质醇放射免疫分析试剂盒、ACTH放射免疫分析试剂盒均购自北京北方生物技术研究所; T6紫外分光光度计购自北京普析通用仪器有限责任公司;M-96型16管手动放射免疫γ计数器购自合肥众成生物工程设备有限公司;聚合酶链反应(PCR)仪(GeneAmp PCR System 9600)购自美国Applied Biosystems公司。
1.2动物与分组 32只Wistar雄性大鼠,清洁级,购自扬州大学实验动物中心,体重150~200 g,生产许可证号:SCXK沪2002-0002。动物单笼恒温(23±2)℃、恒湿(60%±5%)饲养,明暗周期12 h,自由饮水取食。适应性喂养1 w后,所有大鼠随机分为对照组、模型组、LA组、CYP组各8只。对照组喂以普通饲料,其他3组喂以自制高脂饲料并辅以慢性应激刺激。高脂饲料配方为22%猪油+8%糖+2%胆固醇+2%食盐+66%基础饲料。慢性应激刺激采用足底电击辅以噪声刺激的方式,每日上、下午各2 h,方法同前期研究〔6〕。连续刺激8 w后,各组在高热量饲料结合慢性应激刺激的同时,LA组以100.0 mg/(kg·d)LA灌胃,CYP组以2.30 mg/(kg·d)CYP灌胃。所用药物以0.5%羧甲基纤维素钠(CMC-Na)溶液配成相应浓度的混悬液,模型组及对照组灌胃给以相同体积的0.5%CMC-Na 溶液,均给药4 w。
1.3肝指数的测定 给药4 w后禁食12 h,称重,腹腔注射20%乌拉坦注射液麻醉(0.5 ml/100 g)。颈动脉插管取血,全血3 500 r/min离心10 min获得血清,-20℃冰箱保存。取肝脏,以4℃预冷生理盐水冲洗,滤纸吸干表面水分,称取肝脏重量。肝指数(HI)=肝脏重量(g)/体重(g)×1000。
1.4血液学指标的测定 血清皮质醇、ACTH和TNF-α用DFM-96型16管放射γ免疫计数器检测;血清TC、TG、HDL-C及FFA用比色法检测;MDA用硫代巴比妥酸(TBA)法检测,SOD用羟胺法检测。
1.5肝脏生化指标的测定 0.2 g肝组织放入2 ml生理盐水中,4℃下匀浆,制成10%肝组织匀浆,3 000 r/min离心15 min,获得上清液,于-20℃冰箱保存。用于测定肝组织TC、TG、FFA、SOD、MDA及TNF-α含量,测定方法参照试剂盒说明书。
1.6肝脏TNF-α mRNA表达的检测 新鲜肝组织100 mg,用磷酸盐缓冲液(PBS)反复漂洗,-80℃冰箱冻存,用于测定肝脏TNF-α mRNA表达。TNF-α引物:上游5′-CAGACCCTCACACTCAGATCA-3′,下游5′ TCTCCTGGTATGAAATGGCA,引物长度270 bp。PCR反应条件为94℃,30 min预变性,然后94℃ 30 s;55℃ 30 s;72℃ 30 s;运行30个循环,最后72℃延伸10 min。PCR产物用1%琼脂糖凝胶电泳,全自动凝胶成像分析系统灰度扫描,计算各组相对灰度。相对灰度=各组泳道灰度/对应泳道内参灰度。
1.7肝组织形态学观察 将动物新鲜肝组织在4℃的PBS中反复漂洗,在10%中性甲醛中固定,酒精梯度脱水,切片,苏木素-伊红(HE)染色。参照NASH临床研究评分系统〔7〕,从5个方面评价肝组织病变程度,即脂肪变性(肝细胞脂肪变性<5%计0分,5%~33%计1分,34%~66%计2分,>66%计3分)、小叶炎症(放大200倍视野下,无炎症计0分,炎症<2个计1分,2~4个计2分,>4个计3分)、汇管区炎症(在低放大倍数下无到极轻的炎症计0分,大于极轻的炎症计1分)、肝细胞气球样变(无计0分,少数细胞气球样变计1分,多数细胞气球样变或显著的气球样变计2分)和肝组织纤维化(窦周状或门静脉周围的计1分,弱的、3区、窦周状的计1分,中等的、3区、窦周状的计1分,门静脉或门静脉周围的计1分,窦周状的和门静脉/门静脉周围的计2分,桥连的纤维化计3分,硬化计4)。参照Matteoni等〔8〕的建议将病理切片进行分为4个级别:1级,单纯肝细胞脂变;2级,肝细胞脂变并伴小叶炎症;3级,肝细胞脂变并伴气球样变;4级,肝细胞脂变并伴气球样变、肝细胞内出现Mallory小体或肝纤维化。
1.8统计学分析 采用SPSS13.0软件进行单因素方差分析、LSD-t检验。
2 结 果
2.1各组给药4 w后HI比较 与对照组〔(23.12±1.13)mg/g〕比较模型组〔(25.71±1.09)mg/g〕、LA组〔(24.57±1.53)mg/g〕及CYP组HI〔(25.16±0.89)mg/g〕均明显增大(P<0.05,P<0.01);与模型组比较,LA组及CYP组HI均无明显差异(P>0.05)。提示,LA或CYP治疗对HI的增大没有明显的抑制作用。
2.2血液生化指标检测结果
2.2.1表示HPA轴激活程度的指标——血浆皮质醇和ACTH 与对照组比较,模型组、LA组及CYP组皮质醇、ACTH浓度均明显升高(P<0.01),CYP组显著小于模型组(P<0.01),但LA组与模型组无明显差异(P>0.05)。见表1。
2.2.2氧化应激指标——血清SOD及MDA 与对照组比较,模型组、LA组及CYP组 SOD活力均明显下降(P<0.05,P<0.01),MDA浓度均明显升高(P<0.01);LA组SOD活力明显高于模型组且MDA浓度明显低于模型组(P<0.01);CYP组SOD活力与模型组无明显差异(P>0.05),但MDA浓度明显小于模型组(P<0.05)。见表1。
2.2.3血脂检测结果 与对照组比较,模型组及CYP组TC浓度明显升高(P<0.01,P<0.05),模型组TG浓度明显升高(P<0.01),各组HDL-C均明显下降(P<0.01);与模型组比较,LA组及CYP组TC浓度均明显低于模型组,差异有统计学意义(P<0.01),CYP组TG浓度明显低于模型组,差异有统计学意义(P<0.05),LA组和CYP组HDL-C与模型组无明显差异(P>0.05)。见表1。
2.2.4血液FFA检测结果 与对照组比较,模型组、LA组及CYP组血FFA浓度均明显升高(P<0.01);LA组及CYP组明显低于模型组,差异有统计学意义(P<0.01)。
2.2.5血浆TNF-α检测结果 与对照组比较,模型组、LA组及CYP组TNF-α浓度均明显升高(P<0.01);LA组及CYP组明显低于模型组(P<0.01)。见表1。
表1 治疗后4组生化指标比较
与对照组比较:1)P<0.05,2)P<0.01;与模型组比较:3)P<0.05.4)P<0.01;下表同
2.3肝组织生化指标 与对照组比较,模型组、LA组及CYP组肝组织TNF-α含量均明显升高(P<0.01);与模型组比较,LA组及CYP组肝组织TNF-α均明显下降(P<0.01)。与对照组比较,模型组、LA组及CYP组肝组织SOD活力均明显下降(P<0.01),MDA含量均明显升高(P<0.05,P<0.01);LA组SOD活力明显高于模型组(P<0.01),CYP组则与模型组无明显差异(P>0.05),而LA、CYP组MDA含量均明显低于模型组(P<0.05,P<0.01)。与对照组比较,模型组及CYP组肝组织TC、TG含量明显升高(P<0.01);与模型组比较,LA组TC、TG含量均明显低于模型组(P<0.01),CYP组两指标与模型组无明显差异(P>0.05)。与对照组比较,模型组、LA组及CYP组肝组织FFA含量明显升高(P<0.05,P<0.01);LA组及CYP组明显低于模型组(P<0.01)。见表2。
表2 治疗后各组肝组织生化指标比较
2.4肝组织TNF-α mRNA表达 与对照组(0.052±0.008)比较,模型组(0.043±0.004)及LA组TNF-α mRNA表达(0.137±0.022)显著升高(P<0.01),CYP组(0.085±0.005)与对照组无在显著差异(P>0.05);与模型组比较,LA组及CYP组TNF-α mRNA表达均明显下降(P<0.05,P<0.01)。见图1。
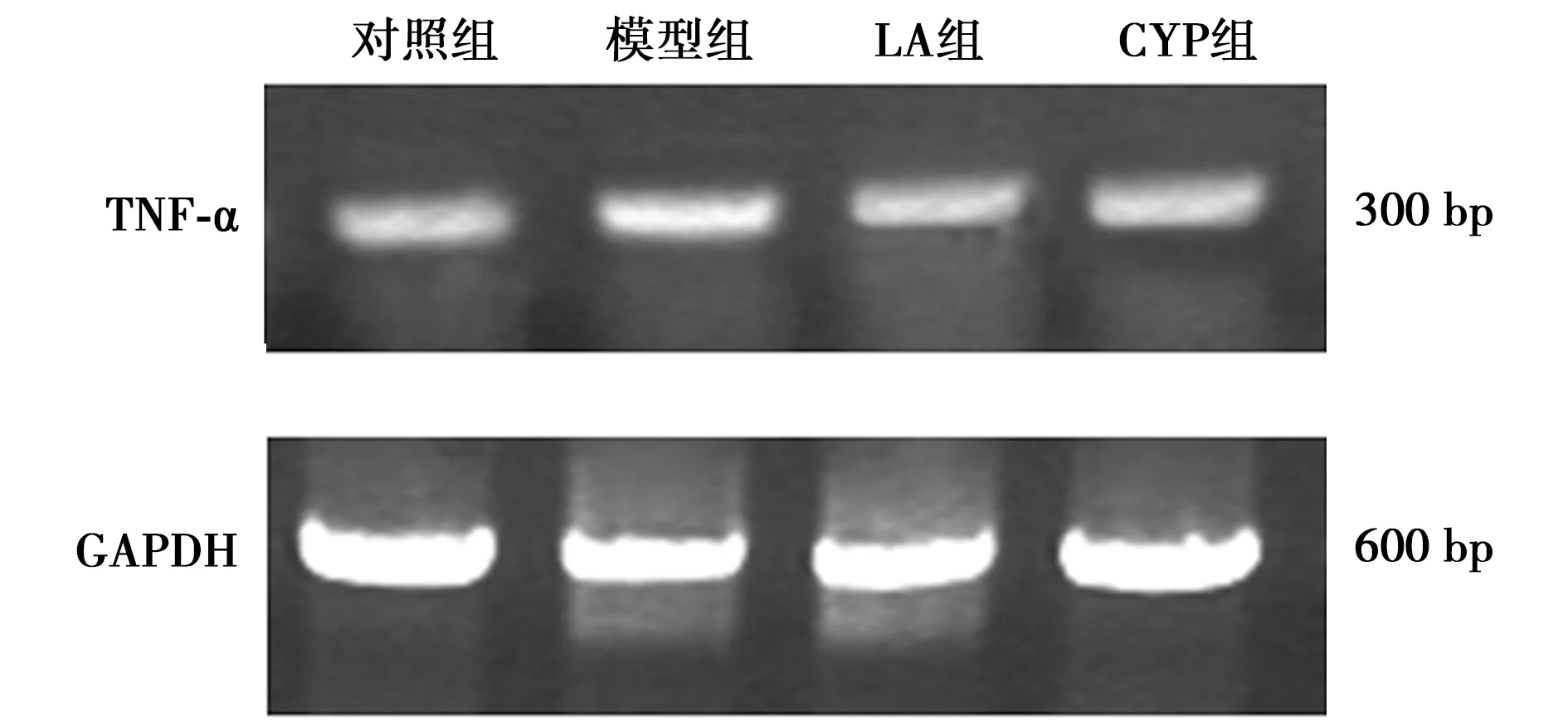
图1 肝组织TNF-α mRNA表达
2.5肝组织切片观察 对照组肝细胞结构完整、清晰,肝小叶结构清楚,所有动物都未显示有病变迹象;模型组8只动物中有7只存在轻度或中度脂变,4只有汇管区轻度炎症,3只有轻度肝细胞气球样变,4只有轻度肝纤维化,所有动物均未见小叶炎症;LA组8只动物中有5只出现轻度脂变,2只出现轻度汇管区炎症,2只有轻度肝细胞气球样变,3只有轻度肝纤维化,所有动物均未发现小叶炎症;CYP组8只动物1只有轻度脂变,1只有肝纤维化,而所有动物均未见小叶炎症、汇管区炎症及肝细胞气球样变形。见图2。

图2 各组肝组织切片(HE染色)
3 讨 论
LA是一种超强生物抗氧化剂,兼具亲水和亲脂两种特性,在水溶性和脂溶性环境中均有较好的抗氧化作用。LA易经消化道吸收,在体内部分转化为抗氧化活性更强的二氢硫辛酸(DHLA),分布到机体组织中发挥抗氧化作用,并且可以通过血脑屏障,减少中枢神经系统的氧化损伤。LA的抗氧化作用主要体现在以下3个方面:①清除自由基和活性氧:LA 能够有效清除羟基及一氧化氮自由基、过氧化氢、单线态氧、次氯酸及过氧化亚硝基。虽然LA 不能清除超氧自由基和过氧化物自由基,但DHLA对单线态氧以外的其他自由基均有清除作用。由于体内LA和DHLA同时存在,因此,上述所有自由基均可被有效清除;②鳌合金属离子:LA能够螯合Fe、Cu及其他过渡金属元素(Mn2+、Cd2+、Zn2+等),减少细胞内羟基自由基(·OH)的产生,进而阻断脂质过氧化;③再生内源性抗氧化剂:LA和 DHLA在体内的相互转化能再生维生素C、维生素E、谷胱甘肽、硫氧还原蛋白及泛醌等抗氧化剂,使这些抗氧化剂由氧化型转化为还原型〔9〕。
自1980 年德国的Sachse首次将LA应用到临床后,该药逐渐引起医学界重视,仅糖尿病领域,人们已广泛应用LA的强抗氧化应激能力,保护β细胞,延缓其衰减,减轻对其的攻击;保护肌肉、脂肪细胞,增强对葡萄糖的利用,增强胰岛素敏感性;保护神经细胞,改善糖尿病神经病变;保护内皮细胞,减少动脉粥样硬化等〔10,11〕。近年来也有学者尝试将LA应用于NAFLD的治疗,结果显示LA可从多个环节阻止氧应激和脂质过氧化反应,从而改善大鼠肝功能,是治疗脂肪肝的有效药物〔12,13〕。
CYP是一种非选择性5-羟色胺(HT)受体阻断剂,并且能够阻断组胺H1受体,属于第二代抗组胺药。CYP通过拮抗中枢特异性5-HT受体,减少促ACTH释放因子(CRF)的释放,进而使血浆ACTH、皮质醇浓度下降,降低HPA轴的反应活性,临床用于治疗肾上腺皮质功能亢进症。CYP也可抑制左旋多巴诱发的ACTH释放,使血浆ACTH氢化可的松反应。此外,研究发现该药有钙通道阻滞、自由基清除、抗感染、解热镇痛等作用〔14〕。王冰等〔15〕报道,外源性糖皮质激素能引起大鼠HPA轴过度激活,肝脂代谢紊乱,加剧肝脏脂质沉积,诱发大鼠肝脂肪变性。CYP可干扰HPA轴的过度激活,降低血清ACTH和皮质醇水平,逆转外源性糖皮质激素引起的大鼠肝功能损伤,改善糖脂代谢紊乱。
本研究结果显示,LA和CYP对高热量饲料结合应激引起的大鼠NAFLD均有治疗作用,表现为血脂紊乱及肝脏脂质沉积改善、血液及肝组织TNF-α表达降低、氧化应激状态改善、HI下降。但两者对该模型的治疗效果也存在差异:CYP可明显抑制HPA轴过分激活,LA不能;LA的抗氧化应激效果好于CYP。肝组织切片观察显示,CYP治疗对该模型肝损伤的改善较明显,可明显改善肝脂肪沉积、肝细胞气球样变、汇管区炎症等症状。本研究只是两种不同作用机制药物对NAFLD治疗的初步探索,进一步研究可观察两种药物对胰岛素抵抗、心血管系统损伤及脂肪组织病变等相关疾病的治疗作用,为NAFLD及其相关疾病的临床治疗提供新思路。
