抑制EphA7表达对非小细胞肺癌细胞迁移和侵袭能力的影响
2020-01-10金红莫迪李梦雨杨岚张黎武艳季洪良富宏然
金红 莫迪 李梦雨 杨岚 张黎 武艳 季洪良 富宏然
(1牡丹江医学院附属红旗医院检验科,黑龙江 牡丹江 157011;2 牡丹江医学院第一临床医学院;牡丹江医学院附属红旗医院 3眼科;4科研科; 5牡丹江医学院医药研究中心)
根据组织学特征肺癌可分为非小细胞肺癌和小细胞肺癌。虽然空气污染、烟草烟雾等多种因素都能增加肺癌的发病率,但肺癌形成的机制尚不清楚〔1,2〕。转移是癌症的致死特征之一,约占人类癌症死亡的90%〔3〕,肺癌转移是一个复杂过程,包括细胞迁移、局部浸润和播散,阻断其中步骤之一能够有效地防止继发性肿瘤在体内扩散〔4,5〕。受体酪氨酸激酶(RTKs)为细胞增殖、分化和迁移的主要调控因子〔6〕。抑制酪氨酸蛋白激酶受体(Eph)代表最大的RTKs家族,并与ephrins配体相互作用。研究证实RTKs可参与肿瘤生长、转移和新血管的形成〔7,8〕。本研究用小干扰RNA(siRNA)沉默EphA7,研究其对非小细胞肺癌NCI-H1975细胞迁移和侵袭能力的影响及其作用机制。
1 资料与方法
1.1一般材料 人肺腺癌NCI-H1975细胞株购自中国上海中国科学院生物化学与细胞生物学研究所,10%胎牛血清和DMEM培养基购自美国GIBCO公司,转染试剂盒细胞凋亡试剂购自美国Promega公司,CCK8检测试剂盒购自中国海门碧云天生物技术研究所,抗EphA7抗体、抗B细胞淋巴瘤(Bcl)-2抗体、抗Bcl-2相关X蛋白(Bax)抗体、抗蛋白酪氨酸磷酸酶(PTEN)抗体、抗磷酸甘油醛脱氢酶(GAPDH)抗体、抗蛋白激酶B(AKT)抗体和抗磷酸化(p)-AKT抗体购自美国Abcam。
1.2细胞培养、转染与分组 NCI-H1975细胞复苏后,待细胞生长到一定数量后,0.25% 胰酶消化,用含10%血清的二甲基亚砜(DMSO)培养基重悬细胞。计数以后调整细胞浓度为5×105个/ml,按每孔0.1 ml接种于96孔板上,37℃、5%CO2条件进行培养。将NCI-H1975细胞分为3组,抑制组和NC组分别转染EphA7抑制剂和EphA7-NC,空白对照组不转染,48 h后收集细胞。
1.3噻唑蓝(MTT)法检测细胞增殖 取生长状态良好的对数生长期细胞,0.25%胰蛋白酶消化,计数,将细胞以5×105个/ml接种于96孔培养板中,然后向其中加入含10%胎牛血清的RPMI1640培养液,在37℃培养箱中培养24 h,待细胞贴壁生长并达80%时,每孔加入10 μl MTT溶液继续培养4 h,终止培养,吸去孔内培养液,每孔加入100 μl DMSO置于摇床上低速震荡10 min,然后在490 nm波长下用酶标仪测定每个样本的吸光度(OD)值,每个样品重复做3次。
1.4实时荧光定量聚合酶链反应(PCR)检测EphA7 mRNA的表达 从每个样品中提取总RNA(1 μg)利用逆转录酶(M-MLV)可生成cDNA。使用SYBR Green PCR检测系统进行检测。EphA7引物序列:上游5′-CTAATGTTGGATTGTTGGCAAAAG-3′,下游5′-TTGATCCAGAAGAGGGCTTATTG-3′;内参GAPDH引物序列:上游 5′-AAGAAGGTGGTGAAGCAGGC-3′,下游5′-TCCACCACCCAGTTGCTGTA-3′。反应条件:95℃15 s,60℃ 30 s和72℃30 s,40个循环。设置3个复孔,数据用Sequence detection software1.3系统处理,用2-ΔΔCt给出EphA7 mRNA的相对值。
1.5用末端转移酶的dUTP缺口末端标记(TUNEL)染色法检测细胞凋亡 细胞用4%多聚甲醛在室温下固定30~60 min,用磷酸盐缓冲液(PBS)洗涤3次,用含0.1% Triton X-100的枸橼酸钠缓冲液浸透,冰浴孵育2 min,用PBS洗涤2次,加入50 μl原位凋亡检测试剂盒的TUNEL检测液,细胞核与4,6-二脒基-2-苯基吲哚(DAPI)染色,于37℃下避光孵育60 min,用PBS洗涤3次,用抗荧光淬灭封片液封片后在荧光显微镜下进行观察,激发光波长范围450~500 nm,发射波长范围515~565 nm(绿色荧光),荧光显微镜下计数细胞总数和TUNEL阳性细胞数,并计算细胞凋亡率(凋亡阳性细胞数/细胞总数)。
1.6采用 Transwell实验检测细胞侵袭与迁移 (1)细胞在37℃孵育24 h后收集各组处理后的细胞,制备细胞悬液,并将浓度为5×105个/ml细胞接种到Transwell小室中,向小室内加入含有10%胎牛血清培养液,在37℃、5% CO2培养箱中孵育24 h,用棉签擦去基质胶和上室内没有被侵袭的细胞,弃掉下室液体,下室已经被侵袭的底层细胞用95%乙醇固定,0.2%结晶紫染色1 h,纯水轻轻洗小室底部,显微镜下每孔取左上、右上、中、左下、右下5个视野拍照(固定位置,排除主观选择因素),对图片上被染色细胞进行计数。(2)细胞在37℃孵育24 h后收集各组处理后的细胞,制备细胞悬液,并将浓度为5×105个/ml细胞接种到Transwell小室中,上层室无血清,底部加入含有10%胎牛血清培养液,接着在37℃、5%CO2培养箱中孵育24 h,用棉签将上层没有被侵袭的细胞清除,弃掉下室液体,下室已经被侵袭的底层细胞用95%乙醇固定,0.2%结晶紫染色1 h,用纯水轻轻洗小室底部,显微镜下每孔取左上、右上、中、左下、右下5个视野拍照(固定位置,排除主观选择因素),对图片上被染色细胞进行计数。
1.7使用蛋白印迹法检测信号通路蛋白表达水平 将药物处理后的细胞收集加入裂解液,各组提取的总蛋白样品30~90 μg在10%~15%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离,将蛋白质从凝胶转印到硝酸纤维素膜,加入封闭液(5%脱脂奶粉),浸泡被转印膜,室温反应1 h,来封闭转印膜上的一些非特异性蛋白质的潜在结合位点,防止发生非特异性反应;转移结束后,断开电源将膜取出,割取待测膜条做免疫印迹;然后用第一抗体在4℃孵育过夜(抗PTEN抗体、抗GAPDH抗体、抗AKT抗体和抗p-AKT抗体),弃一抗,用0.01 mol/L包含0.5% Tween20的PBS分别洗膜,10 min×3次,振荡;加入荧光标记的二抗溶液,室温下反应1 h,保持平缓摇动;弃二抗,用0.01 mol/L PBS洗膜,10 min×4次,振荡。电化学发光(ECL)显色:将膜浸于ECL发光液中,避光显色3 min,将膜用滤纸吸干,以β-actin作为内参对照,用Tanon5200全自动化学发光图像分析系统进行扫描,分析目标条带的灰度值。
1.8统计学分析 采用SPSS16.0软件进行t检验、单因素方差分析。
2 结 果
2.1各组EphA7 mRNA及蛋白表达 与空白对照组比较,抑制组EphA7 mRNA和蛋白表达水平明显减少(P<0.05,P<0.01),见表1,图1。

表1 各组EphA7 mRNA及蛋白表达水平
与空白对照组比较:1)P<0.05,2)P<0.01;下表同
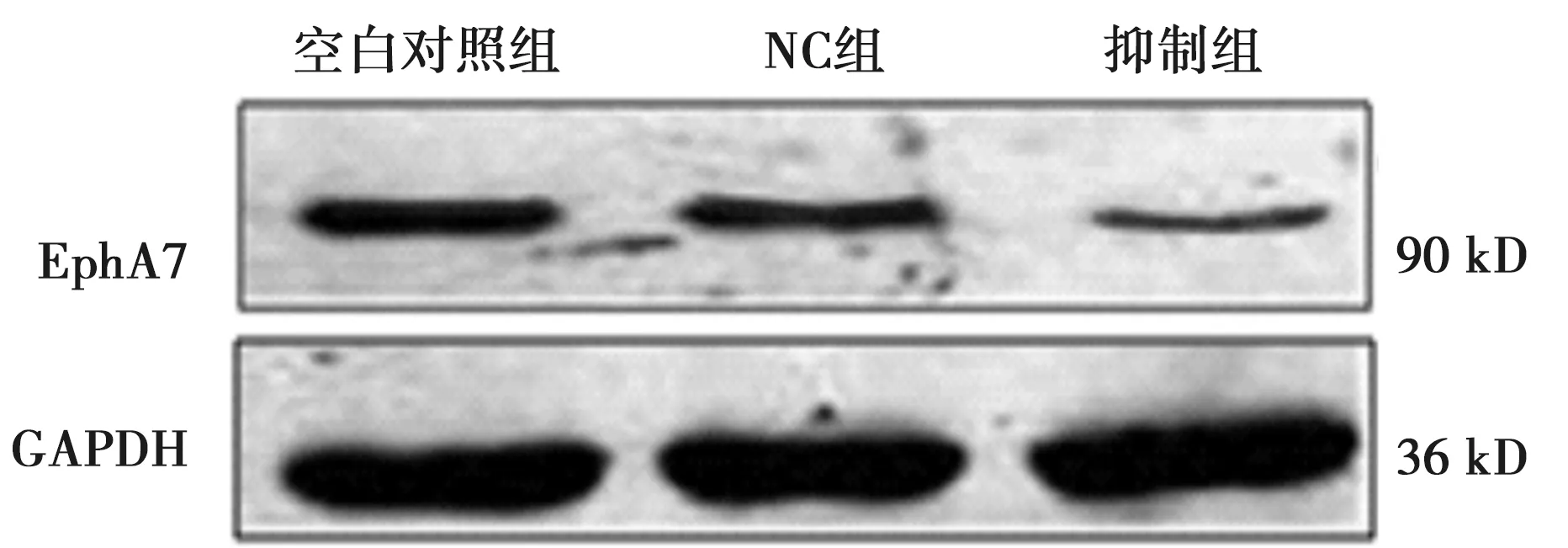
图1 各组EphA7蛋白表达水平
2.2抑制EPHA7表达对各组细胞增殖抑制作用 与空白对照组比较,抑制组细胞活力明显降低(P<0.01),细胞凋亡率明显增加(P<0.01),见图2,表2。
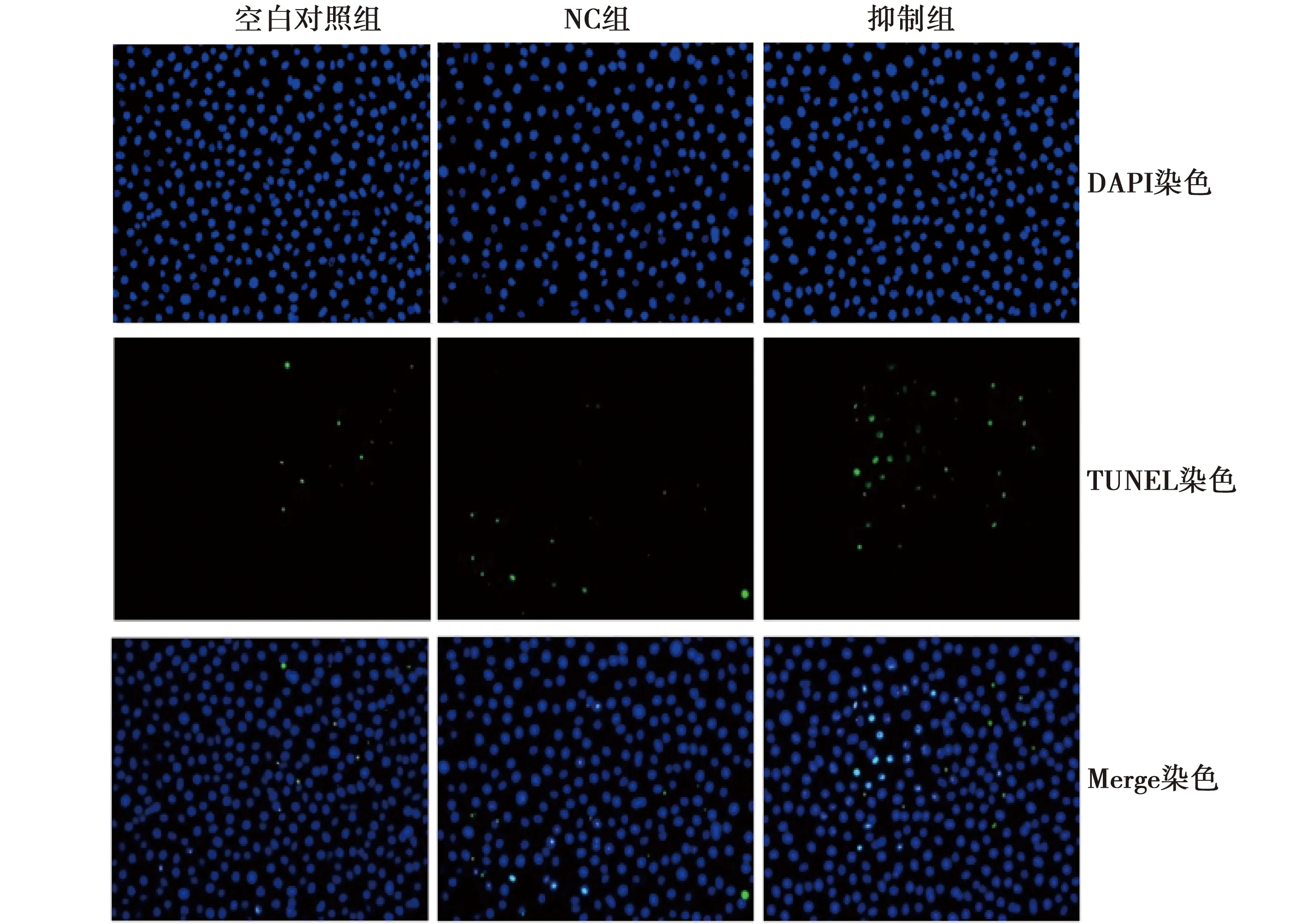
图2 抑制EphA7表达对各组细胞凋亡的影响(×100)

表2 抑制EphA7表达对各组细胞活力及细胞凋亡率的影响
2.3抑制EphA7表达对各组细胞的侵袭和迁移的影响 与空白对照组比较,抑制组的侵袭和迁移的细胞数明显较少(均P<0.05),见表3。

表3 抑制EphA7表达对各组细胞的侵袭和迁移的影响
2.4抑制EphA7表达对各组细胞信号通路蛋白(AKT、p-AKT和PTEN)表达水平的影响 与空白对照组比较,抑制组的PTEN蛋白表达水平明显升高(P<0.01),p-AKT蛋白表达水平明显降低(P<0.05),总AKT蛋白差异无统计学意义(P>0.05),见表4、图3。

表4 抑制EphA7表达对各组细胞信号通路蛋白表达水平的影响
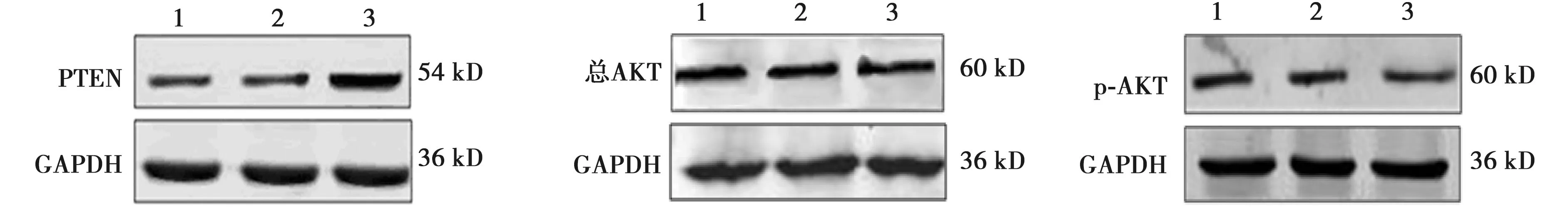
1~3:空白对照组,NC组,抑制组图3 抑制EphA7表达对各组细胞的信号通路蛋白表达水平的影响
3 讨 论
目前,肺癌晚期患者病死率较高,与肺癌晚期恶性肿瘤细胞强大的侵袭和转移能力有关。研究发现,Eph受体和ephrin配体调控是肿瘤生长、转移和不良结局的关键〔9~11〕,现已证实EphA7在肾血管系统中高度表达,EphA7的表达在肺癌组织中也被转录激活〔12〕,但很少有研究阐明EphA7在肿瘤致病性中的作用,本研究首次证明了沉默EphA7可以抑制NCI-H1975细胞的细胞活力和细胞的迁移与侵袭,并在NCI-H1975细胞中通过上调PTEN抑制AKT信号通路。
在正常情况下,机体内的细胞分裂和增殖受到信号转导通路的级联调控,如果信号转导通路中的促进生长和抑制生长的平衡作用遭到破坏,就会导致细胞的增殖失控和恶性转移。目前细胞中的膜受体Eph(ras-MAPK)信号转导通路、蛋白酪氨酸激酶信号传导及转录激活蛋白(JAK-STAT)信号转导通路和磷脂酰肌醇-3-激酶(PI3K)/AKT/哺乳动物雷帕霉素靶蛋白(mTOR)信号转导通路在细胞增殖失控与恶性转移中起重要作用,与恶性肿瘤晚期的侵袭和转移密切相关。信号通路调控异常与肿瘤发生如细胞迁移和侵袭等密切相关,是目前肿瘤治疗的靶点,对信号通路进行有效的调节是治疗肿瘤的关键。AKT/mTOR/STAT3信号通路在调节癌细胞生长、侵袭和凋亡中起重要作用〔13〕。AKT的活化减少,从而抑制信号通路达到抑制细胞生长和增殖的作用,降低了癌细胞增殖和凋亡抵抗。PI3K/AKT通路是癌症发展的一个重要信号通路和代谢途径。
本研究结果表明,EphA7的沉默下调了非小细胞肺癌细胞中PTEN-AKT信号通路。此外,siEphA7作为肿瘤抑制因子调节细胞侵袭和迁移。
