乳腺癌易感基因相关蛋白1的表达与胃癌预后的相关性
2020-01-10杨兰艳殷芳郑盛王建刚
杨兰艳,殷芳,郑盛,王建刚
作者单位:云南省第三人民医院消化内科,云南 昆明650000
胃癌是来源于胃黏膜上皮的恶性肿瘤,2018年全球癌症报告显示,全球因癌症死亡的病例中,胃癌占8.2‰,位居世界恶性肿瘤死因的第2位,胃癌也是我国最常见的恶性肿瘤之一,有较高的发病率及病死率,严重威胁着人们的健康[1]。用可行的检测方法寻找可靠有效的胃癌分子标志物,对胃癌进行早期诊断、判断预后和分子靶向药物治疗,从而实现个体化精准治疗是目前研究的重要任务之一[2]。
乳腺癌易感基因1(breast cancer gene 1,BRCA1)相关蛋白 1(BRCA1 associated protein 1,BAP1)是由BAP1基因编码的一种去泛素化酶,BAP1可参与细胞生存、细胞凋亡、DNA修复、蛋白质泛素化等多种功能的调控,BAP1与恶性间皮瘤、皮肤黑色素瘤、肺癌、结直肠癌、肾透明细胞癌、乳腺癌和头颈部鳞癌等多种恶性肿瘤的发生、发展和治疗预后相关[3]。本研究通过免疫组织化学和实时荧光定量PCR检测BAP1蛋白和mRNA在胃癌组织及其癌旁组织中的表达,分析BAP1表达与胃癌病人临床病理特征及预后的关系,初步探讨BAP1在胃癌中的临床应用价值。
1 资料与方法
1.1 一般资料 收集整理2012年1月至2016年1月云南省第三人民医院87例行手术切除的胃癌病人的胃癌及其癌旁组织标本。癌旁组织取自手术切除残端,距离癌组织大于5 cm,切缘阴性。所有病人术前及术后病理学检查均确诊为胃癌,术前均未行化疗、放疗以及其他特殊治疗,临床诊疗资料完整。所需组织切除离体后立即取材,标本获取后置于冻存管并立即保存在液氮中。胃癌诊断其及常规病理资料由两位经验丰富的病理科医师阅片后确诊。术后分期方法采用美国癌症联合委员会(AJCC)第七版的分期标准。87例胃癌病人的年龄范围为39~82岁,中位年龄为59岁;I期18例,Ⅱ期33例,Ⅲ期36例;全组病人均为腺癌,其中高分化15例,中分化27例,低分化45例;79例病人接受了术后放和或化疗。病人或其近亲属知情同意,本研究符合《世界医学协会赫尔辛基宣言》相关要求。
病人术后出院,每3~6月随访一次,随访内容包括一般情况、临床症状体征、全身体格检查和影像学(B超、CT和MRI等)检查。随访起始日为术后病理确诊日期,末次随访时间为2019年2月21日,随访时间为3~84个月,中位随访时间42个月,无失访病例。
1.2 主要仪器及试剂 组织样品研磨仪购于北京赫得科技有限公司,光学显微镜BX53购于日本奥林巴斯公司,聚合酶链反应(PCR)仪购于赛默飞世尔科技(中国)有限公司,紫外分光光度计购于美国Thorlabs公司,BAP1兔多克隆抗体购自艾博抗(上海)贸易有限公司,免疫组化SP法试剂盒购自北京百奥莱博科技有限公司,二氨基联苯胺(Diaminobenzidine,DAB)试剂盒购自上海研生实业有限公司,Trizol试剂购于美国Invitrogen公司,RevertAid First Strand cDNA Synthesis Kit试剂盒购于赛默飞世尔科技(中国)有限公司。
1.3 免疫组织化学 采用免疫组织化学SP法(链霉菌抗生素蛋白-过氧化物酶)检测87例胃癌病人胃癌及其癌旁组织的BAP1蛋白表达情况,实验采用二氨基联苯胺(DAB)显色,用已知阳性切片做阳性对照,磷酸盐缓冲溶液(PBS)代替一抗作为阴性对照。每张切片均由两位病理医生分别评分,最终取平均值。结合细胞染色强度和阳性细胞百分比对结果进行判定:切片中细胞染色强度分为未染色、浅黄色、棕黄色、棕褐色,分别记为0~3分;切片中阳性细胞百分比分为<5%、6%~25%、26%~50%、51%~75%和76%~100%,分别记为0~4分;两项分数相乘得到免疫反应积分作为最终得分。BAP1蛋白表达的评分≤7分定义为低表达,≥8分定义为高表达[4,5]。
1.4 实时荧光定量PCR 在全组87例胃癌病人中随机选取32例采用实时荧光定量PCR定量比较癌组织及其癌旁组织中BAP1 mRNA表达差异。将匀浆的组织参照Trizol试剂说明书进行提取总RNA进行检测,然后参照RevertAid First Strand cDNA Synthesis Kit试剂盒说明中的操作步骤将总RNA逆转录为cDNA,进行实时荧光定量PCR,所有样品做3个复孔[6]。相关的引物序列如下:内参照GAPDH的正向引物序列为5′-ACAGTCAGCCGCATCTTCTT-3′,反向引物序列为 5′-GACAAGCTTCCCGTTCTCAG-3′;BAP1的正向引物序列为5′-GCTCGTGGAAGATTTCGGTGT-3′;反向引物序列为5′-TCATCAATCACGGACGTATCATC-3′。
1.5 统计学方法 使用SPSS 23.0软件进行数据的录入、整理和统计学分析。BAP1表达水平与胃癌病人临床病理特征的关系采用χ2检验进行分析。计量数据以s表示,胃癌组织及其癌旁组织中BAP1 mRNA表达的差异采用配对t检验进行比较。采用Kaplan-Meier法分析各组病人生存时间,并行Log-rank检验,Cox回归模型用于胃癌预后的多因素分析。以P<0.05表示差异有统计学意义。
2 结果
2.1 BAP1在胃癌组织和癌旁组织中的表达 免疫组织化学结果表明BAP1主要存在于细胞核中,呈棕黄色。87例病人胃癌组织中,BAP1高表达34例(39.1%),低表达53例(60.9%);87例癌旁组织中,BAP1高表达58例(66.7%),低表达29例(33.3%),BAP1蛋白在胃癌组织及癌旁组织中的表达差异有统计学意义(χ2=13.290,P=0.000)。
实时荧光定量PCR检测结果显示32例胃癌病人癌组织BAP1 mRNA的表达明显低于癌旁组织[(1.195±0.470)比(3.399±0.891)],差异有统计学意义(t=15.320,P=0.000)。见图1。

图1 乳腺癌易感基因相关蛋白1 mRNA在胃癌及癌旁组织中的表达情况
2.2 BAP1表达与临床病理学参数关系 BAP1蛋白的表达水平与胃癌病人的肿瘤分化程度、浸润深度、淋巴结转移和TNM分期关系密切,差异有统计学意义(P<0.05),但与性别、年龄、肿瘤大小和生长方式无关(P>0.05)。见表1。
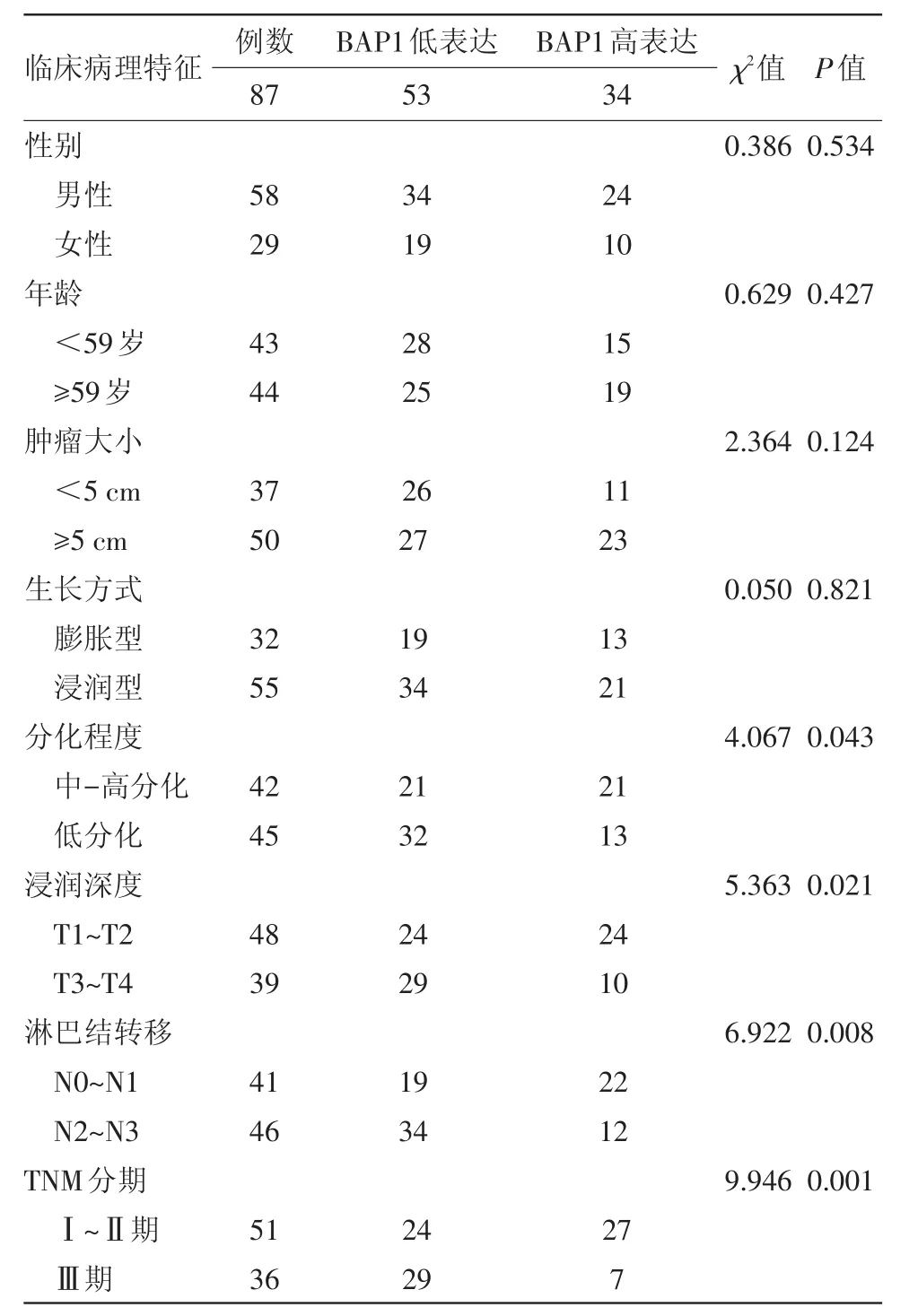
表1 乳腺癌易感基因相关蛋白1表达与胃癌病人临床病理特征的相关性/例
2.3 BAP1表达与胃癌病人预后的相关性 采用Kaplan-Meier法分析BAP1蛋白表达与病人生存期关系,全组87例胃癌病人的中位生存期41.2个月,3和5年生存年率分别为57.4%和41.2%,其中BAP1低表达组和高表达组病人3年生存率分别为45.2%和75.8%,5年生存率分别为27.6%和58.2%,与BAP1高表达组比较,低表达组病人的生存期明显缩短,见图2,两者比较差异有统计学意义(χ2=6.392,P=0.012),表明胃癌病人中BAP1低表达与不良预后密切相关。Cox回归多因素分析发现肿瘤浸润深度(HR=2.435,95%CI:1.453~4.328,P=0.015)、TNM分期(HR=3.242,95%CI:1.609~5.341,P=0.008)、BAP1表达水平(HR=1.712,95%CI:1.064~3.401,P=0.020)是影响胃癌病人生存预后的独立危险因素。
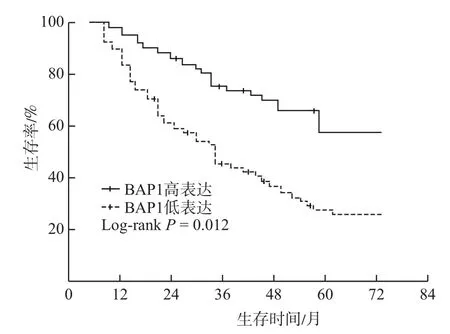
图2 乳腺癌易感基因相关蛋白1(BAP1)表达水平与胃癌病人生存期的关系
3 讨论
BAP1是一种由729个氨基酸组成的去泛素化酶,BAP1可与BRCA1的RING指状结构域的相互作用从而发挥生物学作用,BAP1可能通过调控肿瘤发生、发展中关键蛋白质的泛素化水平从而影响肿瘤的发生发展,其作用机制尚未明确[7]。多项研究表明,BAP1在不同肿瘤中的作用不同。一项关于BAP1与葡萄膜黑色素瘤[8-9]、肾透明细胞癌[10-11]、胆管癌[12-13]、非小细胞肺癌[14]和结直肠癌[15]等多种恶性预后关系的荟萃分析结果显示,BAP1作为肿瘤抑制基因在多数肿瘤中呈低表达,BAP1的表达与肿瘤病理分级、浸润深度和淋巴结转移等关系密切,BAP1低表达病人恶性程度高、侵袭性强,BAP1低表达与上述恶性肿瘤病人预后不良相关,BAP1低表达可增加病人的全因死亡率,肿瘤特异病死率和复发率,该研究还发现通过免疫组织化学分析探讨BAP1对预后的影响是可行的,并推荐BAP1作为恶性肿瘤病理诊断的重要分子标志物和潜在的治疗靶点[16]。另外,研究表明BAP1蛋白是恶性间皮瘤的可靠的诊断及预后标志物,BAP1结合其他间皮瘤相关蛋白有助于鉴别恶性间皮瘤、非小细胞肺癌和结直肠癌[17-18]。BAP1低表达可降低恶性间皮瘤细胞对吉西他滨的敏感性[19],BAP1低表达的恶性间皮瘤病人预后欠佳。
与以上研究结论不同,有研究发现恶性间皮瘤BAP1低表达病人预后良好[20-21]。另有研究表明BAP1可能在皮肤黑色素瘤、头颈部鳞癌和乳腺癌等肿瘤发生中发挥促癌作用。体外和体内实验研究均表明BAP1可促进皮肤黑色素瘤细胞增殖和集落形成,并抑制肿瘤细胞凋亡,其机制可能与BAP1诱导survivin蛋白表达有关[22]。Qin等[23]的研究发现BAP1可通过调节转录因子KLF5的去泛素化促进乳腺癌细胞增殖、存活、迁移和肿瘤生长。BAP1可能通过调节组蛋白H2Aub的去泛素化诱导头颈部鳞癌细胞放疗抗拒,BAP1与头颈部鳞癌病人的预后不良有关[24]。
目前BAP1在胃癌中的作用尚未明确。本研究免疫组化和实时荧光定量PCR检测结果表明,与癌旁组织相比,BAP1在胃癌病人癌组织中呈低表达,为进一步探讨BAP1的表达水平与胃癌病人临床预后的关系,我们分析了BAP1的表达与各种临床病理因素的关系,结果表明BAP1低表达的病人肿瘤分化程度低,局部浸润明显,淋巴结转移率高,临床分期晚,生存预后不良,BAP1的表达水平是影响胃癌病人生存预后的独立危险因素,但确切的研究结论及其作用机制仍有待进一步研究证实。
