蟾皮提取物固体脂质纳米粒的冻干工艺研究
2020-01-10张磊蔡晓瑶张莉向晓辉徐学君
张磊,蔡晓瑶,张莉,向晓辉,徐学君
作者单位:1武警特色医学中心,a药剂科,b肝胆胰脾中心,天津300162;2武警第一机动总队,河北 石家庄050800;3武警后勤学院,天津300162;4武警安徽总队医院药剂科,安徽 合肥230000
蟾皮提取物是中华大蟾蜍的干燥表皮经过煎煮得到的产物,其内含有华蟾酥毒基(Cinobufagin,CBG)、酯蟾毒配基(Resibufogenin,RBG)等多种脂溶性成分,具有抗癌、强心利尿、麻醉、提高机体免疫力等功效[1-2]。其临床应用注射液剂型存在局部刺激性和治疗窗窄等副作用[3-4]。因此前期将蟾皮提取物[5]制成固体脂质纳米粒(solid lipid nanoparticle,SLN)[6],所得 SLN 表现出良好的缓释作用[7]。但固体脂质纳米粒的混悬液在长期存储过程中易发生聚集、沉淀、水解以及磷脂氧化等现象。文献表明真空冷冻干燥、喷雾干燥、超临界流体技术[8-10]等都可以提高SLN的稳定性。因此,本试验采用真空冷冻干燥法制备冻干蟾皮提取物SLN,通过正交试验等方法优化冻干保护剂及工艺,并以蟾皮提取物中有效成分CBG、RBG的包封率为指标,评价冻干工艺对SLN稳定性的影响。本研究起止时间为2011年4月至2017年12月。
1 材料与方法
1.1 材料
1.1.1 试验仪器 LC-20AT液相色谱仪(LC-20AT二元泵,SPD-20A型紫外检测器,CTO-10AS型柱温箱,日本shimadzu公司);AT250分析天平(1/100000,瑞士METTLER TOLEDO公司);JY92-2D型超声波细胞破碎机(宁波新芝生物科技股份有限公司);EYELA冷冻干燥机(FDU-1200,东京理化公司)。
1.1.2 试验试剂 华蟾酥毒基对照品(CBG,中国药品生物制品检定所,110803-200504);酯蟾毒配基对照品(RBG,中国药品生物制品检定所,110718-200507);蟾皮(批号090310)购自安徽亳州千草药业饮片厂,蟾皮提取物浸膏(自制,含CBG和RBG分别为:1.824 mg/g和1.347 mg/g);注射用卵磷脂(批号201403012,上海太伟药业有限公司);山嵛酸甘油酯(上海卡乐康公司);甲醇(色谱纯,批号20150603,天津市康科德科技有限公司);乙腈(色谱纯,批号20140311,天津市康科德科技有限公司);甘露醇(批号20150812北京奥博星生物科技责任技术有限公司),蔗糖(批号20150923,天津市东丽区天大化学试剂厂),乳糖(批号20150412,天津市化学试剂一厂),葡萄糖(批号20151001,天津市东丽区天大化学试剂厂)。
1.2 蟾皮提取物SLN包封率测定方法的建立
1.2.1 色谱条件的确立 色谱柱为ODS-SP柱(150 mm×4.6 mm,5 μm),流动相为乙腈-水-三氟乙酸(60∶40∶0.1),柱温为50 ℃,流速为0.5 mL/min,检测波长296 nm,进样量20 μL。
1.2.2 对照品溶液制备 精密称取CBG、RBG标准品86 mg和78 mg,甲醇定容至100 mL,制得浓度分别为860.00和780.00 μg/mL,而后精密吸取1 mL至10 mL量瓶,甲醇定容制得浓度分别为86.00和78.00 μg/mL的CBG、RBG对照品溶液。
1.2.3 标准曲线 分别精密吸取50、100、150、200、250、300 μL对照品溶液,置于10 mL量瓶,用甲醇定容,浓度为0.43、0.86、1.29、1.72、2.15、2.58 μg/mL,按照“1.2.2”项下色谱条件测定CBG与RBG峰面积,分别绘制标准曲线并做线性回归。
1.2.4 稳定性试验 精密吸取对照品溶液200 μL置于10 mL量瓶中,甲醇定容,得CBG和RBG的质量浓度分别为1.72 μg/mL和1.56 μg/mL的溶液,分别于0、2、4、6、8、12、24 h进样,计算CBG和RBG峰面积的RSD值。
1.2.5 精密度试验 吸取“1.2.5”项下CBG、RBG浓度为1.72 μg/mL和1.56 μg/mL的溶液一天内连续进样6次,计算CBG和RBG峰面积的RSD值;另将上述混合对照品溶液,室温避光保存,隔天进样,连续6 d,计算CBG和RBG峰面积的RSD值。
1.2.6 蟾皮提取物SLN的制备 参照前期试验文献[11]方法:精密称取300 mg卵磷脂、100 mg山嵛酸甘油酯、300 mg浸膏溶于10 mL乙醇中,加热至80℃溶解形成油相;同时将42 mL 5%P188以及8 mL 0.5%Tween 80水溶液加热至同温度,将油相缓慢滴入其中,100 r/min高速搅拌乳化150 min。随即用400 W探头超声分散4 min(间歇10 s、持续20 s),冰浴搅拌15 min,用超纯水定容至60 mL,得到淡黄色SLN混悬液。
1.2.7 蟾皮提取物SLN包封率的测定 取“1.2.1”项下制备的蟾皮提取物SLN混悬液5 mL,放入透析袋中,而后置于100 mL的PH 7.8的PBS溶液中,室温下1 000 r/min搅拌透析液,于4 h吸取1 mL透析液进行HPLC分析,测得透析液中CBG浓度为c1,RBG浓度为c2,CBG包封率(EE%)=(投药量CBG-c1×100)/投药量CBG×100%,RBG包封率(EE%)=(投药量RBG-c2×100)/投药量RBG×100%。
1.3 冻干工艺的考察
1.3.1 预冻时间、温度的考察 取已制备好的蟾皮提取物SLN混悬液60 mL,加入600 mg甘露醇,混匀后于-40℃条件下,以外观、复溶时间、颗粒形态为指标,考察预冻时间分别为4、6、8、12、24 h对冻干SLN的影响;另取已制备好蟾皮提取物SLN混悬液60 mL,加入600 mg甘露醇,混匀后考察在-20℃、-40℃、-60℃[12]下预冻8 h对冻干SLN的影响。
1.3.2 升华干燥时间的考察 本试验设定升华干燥温度-45℃,取已制备好的蟾皮提取物SLN混悬液60 mL,加入600 mg甘露醇,-40℃下预冻8 h后,考察升华干燥12、16、20、24 h对冻干SLN的影响。
1.3.3 解析干燥时间的考察 本试验设定解析干燥温度20℃,取已制备好的蟾皮提取物SLN混悬液60 mL,600 mg甘露醇,-40℃下预冻8 h、-45℃下升华干燥20 h后,考察解析干燥3、4、5、6 h对冻干SLN的影响。
1.4 冻干保护剂的考察
1.4.1 冻干保护剂种类的考察 取已制备好的蟾皮提取物SLN混悬液60 mL,分别加入600 mg(与磷脂质量比为2∶1)的甘露醇、蔗糖、乳糖、葡萄糖,考察其对SLN的保护作用。
1.4.2 正交试验设计优选保护剂处方 为了达到最佳保护效果,将表现较好的甘露醇、乳糖、蔗糖三种混合用作保护剂。做正交设计,采用L9(34)正交表,以乳糖、甘露醇、蔗糖与磷脂(300 mg)质量比作为考察因素,每个因素设1.5∶1,2∶1,4∶1三水平,实验安排见表1。将外观、复溶性、颗粒形态作为考察指标,每个指标采用百分制,具体标准如下:外观=体积(≤40)+质地(≤30)+色泽(≤30),体积饱满30~40分、略皱缩20~30分、皱缩10~20分、塌陷0~10分,质地疏松20~30分、略致密10~20分、致密0~10分,色泽均匀20~30分、分层不明显10~20分、分层明显0~10分,外观得分为三项分数相加;复溶性得分=100-颗粒溶解时间(s),大于100 s记为零分;颗粒形态得分:颗粒不聚集70~100分、略聚集40~70分、聚集10~40分、聚集严重有结晶0~10分。

表1 乳糖、甘露醇、蔗糖质量比的因素水平安排
1.5 冻干蟾皮提取物SLN质量评价 室温下,取优化后的冻干蟾皮提取物SLN,60 mL生理盐水复溶后,采用“1.2.7”项方法测定CBG与RBG的包封率;取适量制备的蟾皮提取物冻干SLN于激光散射仪中,测定SLN的大小及粒径分布,用透射电镜观察形态。
1.6 冻干工艺对蟾皮提取物SLN稳定性的影响分别取蟾皮提取物SLN混悬液和冻干蟾皮提取物SLN,在4 ℃、避光条件下放置,于第0、1、5、10、20、30天后取样,测定并比较两者包封率。
2 结果
2.1 包封率测定方法的建立 在所建立的色谱条件下,SLN中的辅料对药物的检测无干扰,CBG、RBG与其他成分的峰分离度均大1.5,分离较好,检测限(LOD)为0.032 μg/mL,定量限(LOQ)为0.098 μg/mL,如图1。
标准曲线方程:CBG:Y=32 019X-3 169.3(r=0.9992),RBG:Y=39 789X-2 753.9(r=0.999 9),表明CBG和RBG在0.43~2.58μg/mL范围内线性关系良好;稳定性试验结果显示CBG和RBG峰面积的RSD值分别为0.52%和0.65%,表明待测样品在24 h内稳定;日内、日间精密度试验结果显示CBG和RBG峰面积的RSD分别为0.82%和0.90%、1.11%和0.81%。表明日内、日间精密度良好。以上结果表明该色谱方法可准确检测CBG与RBG,利用此方法测得CBG的包封率为(91.01±0.75)%,RBG的包封率为(89.91±0.54)%。
2.2 冻干工艺的优化 预冻温度考察结果:预冻温度为-20℃时,样品未完全冻实,有喷瓶的现象发生,-40℃与-60℃均可得到外观饱满的冻干SLN,故选择-40℃作为预冻温度;预冻时间考察结果:4 h、6 h的样品存在喷瓶、破损、外观不平整的现象,8 h、12 h的样品饱满,疏松,色泽均匀,24 h样品出现皱缩,故选择8 h作为预冻时间;升华干燥时间考察结果:当时间小于20 h,样品未完全干燥,室温下放置后内部融化,使样品产生空腔,当干燥时间大于20 h,所得冻干SLN饱满,疏松,色泽均匀、复溶性无明显差异,因此选择20 h作为升华干燥时间;解析干燥时间考察结果:解析干燥3 h的冻干SLN有水分残留,室温放置后内部融化,解析干燥4、5、6 h所得冻干SLN外观良好,因此选择4 h作为解析干燥时间。
2.3 冻干保护剂的选择 冻干保护剂种类考察的结果:使用单一的冻干保护剂会分别出现冻干产品表面塌陷、色泽不均、颗粒聚集、复溶时间过长等现象,因此本实验将甘露醇、蔗糖、乳糖三者混合用做保护剂,以达到理想的冻干效果;正交试验优化冻干保护剂组成结果见表2,比较各因素的极差可知RB最大,故因素B对实验结果影响最大,其次是C和A。由各个因素不同水平的综合平均值k1、k2、k3可知,A1、B2、C1水平最优,因此最优处方为乳糖:甘露醇∶蔗糖∶磷脂(300 mg)=1.5∶2∶1.5∶1。

表2 甘露醇、蔗糖、乳糖三者混合用做保护剂的正交试验结果(n=3)

图1 华蟾酥毒基和酯蟾毒配基的HPLC图:A为混合对照品;B为蟾皮提取物固体脂质纳米粒;C为空白固体脂质纳米粒
2.4 蟾皮提取物冻干SLN的质量评价 经过试验考察,确定乳糖:甘露醇:蔗糖:磷脂(300 mg)=1.5∶2∶1.5∶1作为保护剂,-40℃下预冻8 h,-45℃下升华干燥20 h、25℃下解析干燥4h,得到蟾皮提取物冻干SLN。蟾皮提取物冻干SLN复溶样品的CBG包封率为(88.96±1.50)%、RBG包封率为(89.65±0.78)%;激光散射仪中,测得SLN的大小及粒径分布结果:样品的平均粒径(152±6.1)nm,90%粒径小于(209.1±28.9)nm,多分散性指数为0.153±0.023,用透射电镜观察形态,见图2。
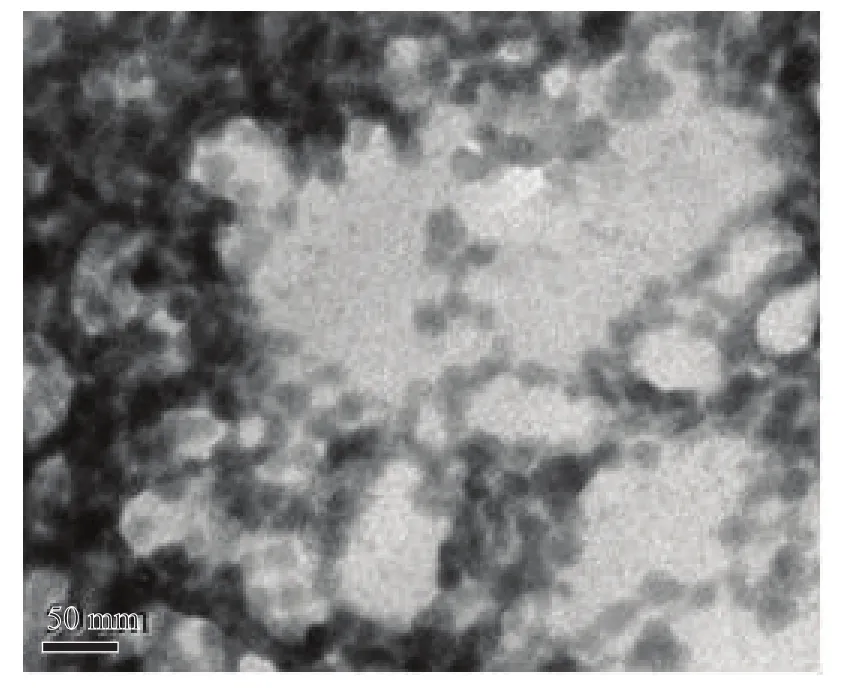
图2 蟾皮提取物脂质纳米粒透射电镜图(×50 000)
2.5 冻干工艺对SLN稳定性的影响 蟾皮提取物SLN放置第0、1、5、10、20、30 d后测得CBG的包封率分别为 91.1%、88.2%、84.8%、79.6%、73.5%、68.1%,RBG的包封率分别为90.2%、87.4%、82.5%、75.3%、70.1%、65.9%;冻干蟾皮提取物SLN放置第0、1、5、10、20、30 d后复溶测得CBG的包封率分别为89.5%、87.3%、88.1%、87.9%、89.9%、88.7%,RBG的包封率分别为 89.9%、88.4%、86.8%、87.4%、87.2%、88.6%。结果表明:长期贮存会导致SLN中有效成分CBG、RBG包封率降低,冻干工艺可显著提高蟾皮提取物SLN的稳定性。
3 讨论
理想的冻干产品应具有外形饱满、色泽均匀、表面平整、复溶时间短等性质,冻干保护剂、预冻温度和时间、干燥时间都对冻干产品的性质产生了重要的影响。在SLN混悬液中,氢键作用可使固体脂质纳米粒的脂质双分子层外部包裹着一层水化膜,可防止SLN发生聚集融合,提高稳定性。但冻干过程会破坏SLN外部的水化层,使膜稳定性降低,发生聚集、破裂[13]。加入冻干保护剂可在冷冻干燥过程代替水分子与SLN形成氢键,提高脂质双分子层稳定性[14]。在筛选保护剂种类时发现应用一种保护剂效果并不理想,因此采用混合保护剂。通过比较确定了甘露醇、乳糖、蔗糖三种保护剂,采用正交试验,以外观、复溶时间、颗粒形态为指标,筛选出复合冻干保护剂,对SLN表现出较好的保护作用,克服了单种保护剂出现的外观塌陷,颗粒聚集等问题。
预冻过程需将样品中的水全部冻实,实验中发现预冻时间短、预冻温度高均会使升华干燥时出现喷瓶的现象,而预冻时间过长会导致实验仪器浪费。因此通过考察最终确定-40℃下冷冻8 h的方式。干燥过程分为升华干燥和解析干燥。升华干燥的过程是通过减压降温的方式将样品中冻结的自由水以固态形式升华除去[15],解析干燥则需要适当升高温度来去除样品中的结晶水。实验发现若升华干燥时间短、水分去除不完全,会导致冻干产品出箱后内部出现空洞、碎块。因此本试验通过单因素考察升华干燥、解析干燥对冻干产品的影响,确定了-45℃下升华干燥20 h、25℃下解析干燥4 h的干燥方式。
包封率是评价SLN稳定性的重要指标[16-17],长期存放会导致磷脂氧化变性,脂质双分子层稳定性下降,最终使药物泄露。因此本试验采用透析法测定贮存不同时间后SLN混悬液与冻干SLN的包封率。结果显示未冻干SLN包封率明显降低,SLN出现泄漏,而冻干后的SLN包封率未见明显降低。该结果表明冷冻干燥是提高蟾皮提取物SLN的物理化学稳定性的可行办法,解决了蟾皮提取物SLN混悬液不稳定的关键难题。
