凋落物浸提液对格氏栲种子萌发及胚根生长的影响
2020-01-10蓝亦琦何中声刘金福王雪琳施友文沈彩霞
王 哲, 蓝亦琦, 何中声, 刘金福, 邢 聪, 朱 静, 王雪琳, 施友文, 沈彩霞
(1.福建农林大学海峡自然保护区研究中心,福建 福州 350002;2.生态与资源统计福建省高校重点实验室, 福建 福州 350002;3.三明莘口格氏栲自然保护区管理站,福建 三明 365000)
林木化感物质主要通过凋落物分解、根系分泌、雨雾淋溶和挥发等途径释放到土壤中,能显著改变土壤的理化性质和微生物群落结构[1-3],进而影响林下种子的萌发和幼苗生长,导致林木更新困难,群落退化[4-5].森林凋落物是林木化感物质的重要来源之一.研究[6]表明,高浓度的毛红椿(Toonaciliata)凋落叶浸提液对其种子发芽的抑制作用强,对幼苗影响存在“低促高抑”现象;而低浓度的杉木(Cunninghamialanceolata)凋落物浸提液对其种子萌发及幼苗生长均有促进作用[7];丝毛相思(Acaciaholosericea)凋落物浸提液对牧地狼尾草(Pennisetumpolystachion)种子萌发无影响,而对其胚根生长有抑制作用[8].可见凋落物浸提液对种子萌发和幼苗生长均存在显著影响,且不同类型、浓度和化学成分的凋落物浸提液对林木种子萌发和幼苗生长的影响不同[6-8].
格氏栲(Castanopsiskawakamii)是我国中亚热带南缘特有的珍贵濒危大乔木,仅在福建、台湾、江西等地零星分布.其种子无休眠期,发芽周期长而出苗率低,且受虫鼠病害和人为采食等干扰,导致格氏栲幼苗更新困难,种质自然资源濒临枯竭[14].促进格氏栲种子萌发与幼苗生长、保护格氏栲珍贵基因与稀有种质资源已成当务之急.研究人员对格氏栲生态学特性[9,10]、种子发芽胁迫与幼苗竞争[11-15]、凋落物与土壤生态化学计量特征关联性[16]、凋落物碳库分配与养分分解[16-18]等方面已进行了大量研究,而凋落物化感物质对种子更新的影响尚未见报道.本文通过探讨不同部位不同浓度的凋落物浸提液对格氏栲种子萌发与胚根生长的影响,揭示凋落物化感物质对其种子萌发受限的影响程度,旨在为揭示格氏栲天然林凋落物分解对其种子更新的影响机制.
1 研究区概况
格氏栲自然保护区位于莘口镇楼源和曹源村,26°07′—26°10′N,117°24′—117°27′E.海拔180~604 m,属亚热带季风气候,年均温19.5 ℃,年均降水量1 564.1 mm[10].土壤类型以红壤与暗红壤为主,凋落物层较厚,土层腐殖质层厚,水肥条件良好.境内地形以山地丘陵为主,局部小气候复杂多样.林内乔木层主要树种有格氏栲、马尾松(Pinusmassoniana)和木荷(Schimasuperba)等.灌木层主要有狗骨柴(Diplosporadubia)、山黄皮(Clausenadentata)和杜茎山(Measajaponica)等;草本植物主要有华山姜(Alpiniajaponica)和芒萁(Dicranopterisdichotoma)等[10].
2 研究方法
2.1 供试材料
于2016年10月中旬,在保护区设置10个林分密度一致的20 m×20 m的样方,每个样方于东、南、西、北、中5个方位放置5个凋落物收集筐,并逐月收集结构完整的4种凋落物(枝、叶、果壳、皮),分装(每袋2 kg)备用.次年,于格氏栲结实盛期(11—12月),到保护区收集地面新鲜落果,脱粒并筛选成熟种子.
2.2 方法
2.2.1 浸提液制备 将格氏栲的凋落枝、叶、果壳、皮各剪成1 cm左右小段,按0.200 g·mL-1(1 g干物质中加入5 mL蒸馏水)的比例分别加入蒸馏水,常温下浸泡48 h过滤,定为原液;稀释原液1、3、7倍,制成0.100、0.050、0.025 g·mL-1浸提液.
2.2.2 种子萌发试验 挑选当年生成熟种子,消毒后5 ℃沙藏60~80 d.发芽时,选饱满、均匀的种子((2.5±0.5) g·粒-1),用50 mg·L-1赤霉素催芽24 h,洗净划开种皮,置于沙床(培养皿)中,加入25 mL浸提液.每种凋落物浸提液设4个处理组.处理1:浸提液含量0.200 g·mL-1.处理2:浸提液含量0.100 g·mL-1.处理3:浸提液含量0.050 g·mL-1.处理4:浸提液含量0.025 g·mL-1.每个处理3次重复,每个重复50粒种子,并设3个蒸馏水组为对照(CK).于培养箱中培养,光周期25 ℃,12 h;暗周期15 ℃,12 h.光强50 nmol·cm-2·s-1,相对湿度75 %~80 %.每天补充少量(1~5 mL)相应浓度浸提液以湿润细沙,安置发芽当天为第1天,3 d后开始观察.以胚根露出种皮2 mm作为种子萌发标准[11],逐日统计发芽数,同时每3 d测量一次胚根长度并记录.待连续3 d无种子萌发时,发芽试验结束,计算种子的发芽率、发芽势、发芽指数、化感效应指数.胚根生长量基本不变时,胚根试验结束,计算每天胚根的生长情况[11].发芽率、发芽势、发芽指数和化感指数的计算参考文献[11、19].
2.2.3 数据统计 采用Excel计算并绘图,采用SPSS软件处理数据.方差分析时先检验数据方差齐性,确定不同处理间差异显著水平,将各指标数据进行对比分类,得出不同浓度梯次与对照组的差异性;通过对应分析[20]得出不同部位不同浓度的凋落物浸提液对格氏栲发芽指标及胚根生长指标的综合影响.
3 结果与分析
3.1 不同部位不同浓度凋落物浸提液对格氏栲种子萌发的影响
3.1.1 凋落壳浸提液对格氏栲种子萌发的影响 凋落壳浸提液对格氏栲种子萌发呈显著抑制作用.从表1可知:不同浓度壳浸提液对格氏栲种子各项生长指标均呈抑制效应(化感指数均为负值);各浸提组中处理1的发芽率和发芽指数均最大,处理2的发芽率最小;处理3的发芽指数最小.
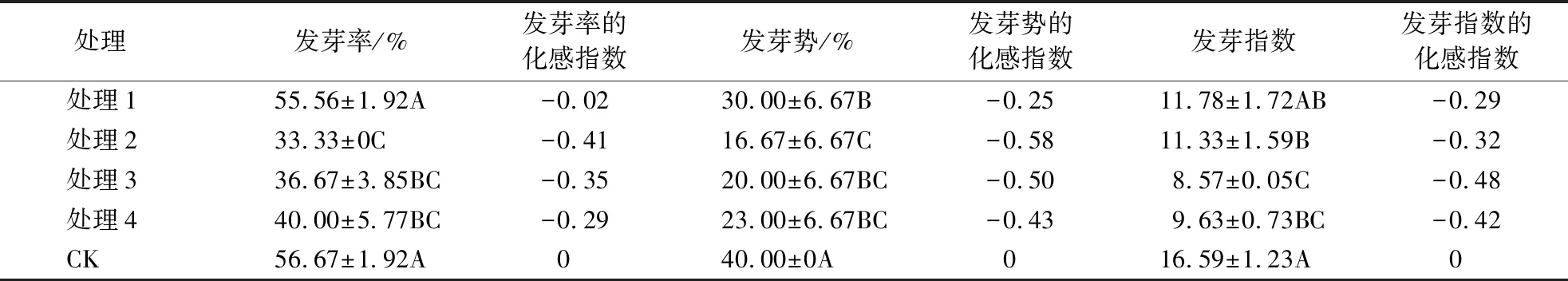
表1 不同处理壳浸提液对格氏栲种子萌发的影响1)Table 1 Effects of different concentrations of nut shell extract on the overall seed germination performances of C.kawakamii
1)同一列不同字母表示该部位的凋落物浸提液随浓度变化的发芽差异性(P<0.05).
3.1.2 凋落枝浸提液对格氏栲种子萌发的影响 凋落枝浸提液对格氏栲种子萌发影响显著.从表2可知:除处理1外,其他处理组对格氏栲种子各项生长指标的化感指数均为负值,呈显著抑制作用;浸提组内发芽率差异显著(P<0.05),处理1的发芽率最高;处理组内发芽指数差异不显著(P>0.05).
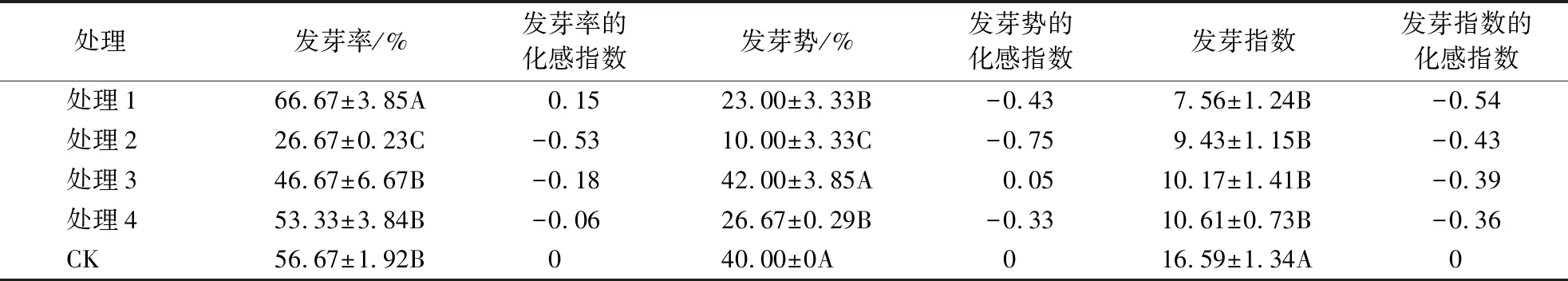
表2 不同浓度枝浸提液对格氏栲种子萌发的影响1)Table 2 Effects of different concentrations of tree branch extracts on the seed germination of C.kawakamii
1)同一列不同字母表示该部位的凋落物浸提液随浓度变化的发芽差异性(P<0.05).
3.1.3 凋落物皮浸提液对格氏栲种子萌发的影响 凋落皮浸提液对格氏栲种子萌发呈显著抑制作用.从表3可知:不同浓度皮浸提液对格氏栲种子各项生长指标均呈抑制效应(化感指数均为负值);浸提组中处理1的发芽率最小,处理3的发芽指数最小;CK组的发芽率和发芽指数最大.

表3 不同浓度皮浸提液对格氏栲种子萌发的影响1)Table 3 Effects of different concentrations of tree bark extracts on the seed germination of C.kawakamii
1)同一列不同字母表示该部位的凋落物浸提液随浓度变化的发芽差异性(P<0.05).
3.1.4 凋落叶浸提液对格氏栲种子萌发的影响 凋落叶浸提液对格氏栲种子萌发的影响显著.从表4可知:不同浓度叶浸提液对格氏栲种子两项生长指标的影响不同;除处理1外,其余处理组的种子发芽率均提高,且随着其含量的升高促进作用显著;而叶浸提液对发芽指数的化感指数均为较大的负值,表明抑制作用显著.
3.1.5 浸提液对格氏栲种子发芽指标的综合影响 分析凋落物不同部位和浓度浸提液影响在发芽率上的权重,结果见表5.凋落物浸提液对格氏栲发芽率的综合影响表现为抑制作用.枝浸提液的抑制作用最强,叶浸提液出现促进作用.从图1可知:叶、皮浸提液与浓度的关系呈相似的变化趋势,且叶与皮分布点数与低浓度距离较近;壳、枝浸提液与浓度间关系的差异性大,其点数与处理2的距离最远,与处理1的距离最近.总体上看,不同浓度叶与皮的浸提液对发芽率影响相似,枝与壳浸提液的作用类似.

表4 不同浓度叶浸提液对格氏栲种子萌发的影响1)Table 4 Effects of different concentrations of leaf extracts on the seed germination of C.kawakamii
1)同一列不同字母表示该部位的凋落物浸提液随浓度变化的发芽差异性(P<0.05).
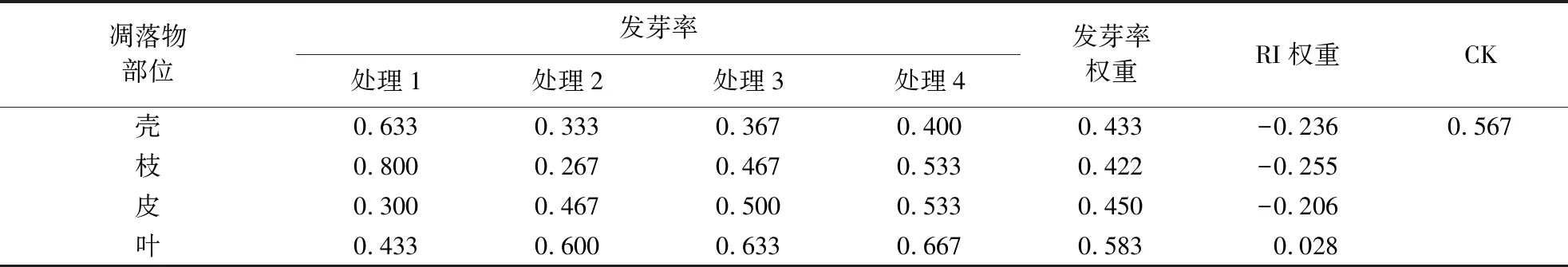
表5 不同凋落物浸提液对格氏栲种子发芽率影响的权重Table 5 Influence weight of different litter extracts on the seed germination rate of C.kawakamii
从表6可知,凋落物浸提液对发芽势的综合影响为抑制作用.其中处理2的化感指数最小,而处理3的抑制作用最弱;皮浸提液对发芽势的抑制作用最强,叶的抑制作用最弱.从图2可知:凋落物部位与浓度之间的距离分散,倾向度低;叶与皮分布点数与处理1的距离最远,与其他浓度距离均相似且较近;枝与处理1、处理2的距离均较远,与其他低浓度距离均较近;而壳与处理1的距离最近,与其余浓度组距离均较远.
从表7可知,凋落物浸提液对格氏栲发芽指数的综合影响为抑制作用.皮浸提液的抑制作用最强,叶抑制作用最弱.从图3可知,凋落物部位与浓度间距离分散,倾向度低.叶与皮的分布点数位置与高浓度间距离较大,与低浓度距离较小;而枝或壳与浓度间因子的关联较弱.枝与壳对格氏栲发芽指数影响偏弱,而叶与皮对格氏栲种子发芽指数的影响较大.

表6 不同凋落物浸提液对格氏栲种子发芽势影响的权重Table 6 Influence weight of different litter extracts on the seed germination potential of C.kawakamii
3.2 不同浓度及部位凋落物浸提液对格氏栲种子胚根生长的影响
3.2.1 凋落壳浸提液对格氏栲种子胚根长度的影响 浇注凋落壳浸提液对胚根生长呈显著的抑制作用(P<0.05),由图4a可知,处理4在胚根生长初期显著抑制,随着时间变化抑制作用逐渐减弱,胚根生长末期(30 d)转为促进作用.而其他浸提组在整个发芽期对胚根生长均产生抑制作用.试验结束时,各处理组胚根长度大小表现为处理3<处理2<处理1 3.2.2 凋落物枝浸提液对格氏栲种子胚根长度的影响 浇注凋落枝浸提液对胚根生长影响显著(P<0.01).由图4b可知,除处理1外,各处理组的胚根生长长度均小于CK组,呈显著的抑制作用.试验结束时,各处理组胚根长度大小表现为处理1=CK组>处理2>处理3>处理4. 3.2.3 凋落物皮浸提液对格氏栲胚根生长的影响 浇注凋落皮浸提液对胚根生长呈显著的抑制作用(P<0.01).由图4c可知,各浓度浸提组对格氏栲胚根生长均产生抑制效应,且随浓度的升高抑制作用显著减弱(P<0.01).高浓度的浸提组在整个试验过程中均对胚根生长产生抑制.试验结束时,各处理组胚根长度大小表现为处理1>处理2>处理3>处理4>CK组. 表7 不同凋落物浸提液对种子发芽指数影响的权重Table 7 Influence weight of different litter extracts on the seed germination index of C.kawakamii 3.2.4 凋落物叶浸提液对格氏栲胚根长度的影响 浇注凋落皮浸提液对胚根生长的影响显著(P<0.01).从图4 d可知,凋落皮浸提组对格氏栲胚根生长的影响情况大致与凋落枝浸提液一致.除处理1外,各处理组胚根生长长度均小于CK组,呈显著的抑制作用;处理1在试验18 d前均促进胚根生长,此后促进作用减弱甚至出现轻微抑制.试验结束时,各处理组胚根长度大小表现为CK组>处理1=处理2>处理3>处理4. 3.2.5 浸提液对格氏栲胚根生长的综合影响 分析不同部位和浓度凋落物浸提液对格氏栲种子胚根生长影响的权重,结果见表8.从表8可知,发芽结束时处理3的胚根长度权重最小,抑制作用最强;叶与枝的抑制作用最弱,而皮的抑制最强.从图5可知,不同浓度叶与枝浸提液对格氏栲胚根生长的影响相似,叶与枝浸提液与处理1、处理2、处理3之间的距离较小,含量对胚根长度的影响不显著.不同含量壳、皮凋落物对胚根生长的影响无明显规律. 表8 不同凋落物浸提液对第30天格氏栲种子胚根长度的影响权重 不同部位和浓度凋落物浸提液对格氏栲种子萌发的影响不同.凋落皮与叶的浸提液对格氏栲种子各项发芽指标的影响符合“高浓度抑制、低浓度抑制作用减弱或出现促进”的普遍规律,尤其在发芽率上表现突出,这与Habteab et al[21]对植物化感作用最敏感指标的研究结果一致.而壳与枝浸提液含量为0.200 g·mL-1时抑制作用极小,甚至产生促进作用;其中0.200 g·mL-1壳浸提液组发芽率达55.56%,0.200 g·mL-1枝浸提液组发芽率高达66.67%,大于对照组(56.67%,P<0.05),表明高含量壳、枝浸提液总体上对格氏栲种子萌发的化感抑制作用小,与前人[21-25]的研究结果不同.原因可能是格氏栲种子为顽拗性种子,种皮厚,种子萌发周期长,而壳、枝凋落物浸提液对种子萌发的化感作用有限,且在同等浓度条件下,其化感作用总体上小于皮、叶凋落物浸提液组.而这与朱海军等[26]研究薄壳山核桃(Caryaillinoinensis)种壳对杂交狼尾草(P.americanum)的化感效应,以及翟梅枝等[27]研究核桃(Juglansregia)枝叶水溶物对绿豆(Vignaradiata)种子萌发化感作用的结果基本一致.根据利比希最小因子定律,此时影响种子萌发的因素可能不再是凋落物的化感因素,而是水分、温度或病菌产生的霉变. 不同浓度和部位的凋落物浸提液对格氏栲种子胚根的生长也产生抑制效应,其中枝、叶、壳在较低浓度时的抑制作用强,这与周艳等[25]的研究结果一致.皮浸提液在胚根生长后期,对格氏栲胚根的抑制效应总体上随浸提液浓度的升高而减弱,这与孙庆花等[28]的研究结果一致.主要原因可能是凋落物化感物质积累到一定浓度后,阻碍种子吸水,抑制呼吸作用和酶活性,阻碍胚根生长并改变渗透压,从而使植物产生毒害[29].胚根生长前中期,0.200 g·mL-1叶浸提液对格氏栲胚根生长产生促进作用,后期促进作用减弱甚至产生抑制效应.这可能是由于胚根生长前中期该浓度凋落物中营养物质含量高于自毒物质,呼吸旺盛,ATP中高能键活跃,线粒体内膜活力强,电子传递与氧化磷酸化速率快,根尖分生区细胞分裂速度加快[30,31].当滞留化感物质不断积累,达到一定量或超过临界含量时,对种子发芽产生毒害[27,28].总体而言,格氏栲胚根对不同浓度不同凋落物的耐受性不同,导致抑制最强浓度的出现时间有差异.可能主要在于凋落物中化感物质含量受外界环境影响,如降雨量、微生物分解量、土壤因子等因素,并且测量时胚根生长形态各异,弯曲甚至畸形及培养过程中幼苗死亡等,都是导致各处理组胚根生长变化的重要因素. 化感作用对植物的影响机制复杂,不同部位和浓度的格氏栲凋落物浸提液对其种子萌发与胚根生长均产生化感效应且影响浓度阈值表现各异,总体上高浓度抑制作用更显著,皮浸提液的自毒作用最明显.可见,格氏栲本身掉皮可能是限制其种子萌发的主要原因.

4 小结与讨论
