淡水双壳类背角无齿蚌AwHSP70基因克隆及多溴联苯醚-47对其表达的影响
2020-01-09薛士鹏王涵宋国英华春秀于瑞雪刘庆春王中晓张庆远刘丽李冰洁夏西超
薛士鹏,王涵,宋国英,华春秀,于瑞雪,刘庆春,王中晓,张庆远,刘丽,李冰洁,夏西超,,*
1. 南阳医学高等专科学校基础医学部,南阳 473061 2. 平顶山学院医学院,平顶山 476000
热休克蛋白(HSP)是一个超基因家族,在调节机体应激反应和耐受性方面发挥重要作用[1-2]。在正常和应激条件下,HSP帮助蛋白质折叠、膜转位和错误折叠蛋白质降解等方面具有积极作用[3-4]。根据其分子量不同,HSP可以分为HSP100、HSP90、HSP70、HSP60和小分子HSP20等5个家族,HSP70是最为保守且研究相对广泛的家族之一[5-6]。HSP70对环境应激反应性较为敏感,温度、氧化应激、重金属、能量代谢抑制剂、紫外线和辐射、病毒、细菌和寄生虫感染均可诱导HSP70表达,以增强机体的耐受能力[7-9]。多联苯醚(PBDE)是常见淡水持久性有机污染物,具有持久性和高生物蓄积的特点,已经引起学者的极大关注[10]。PBDE-47是水体中最丰富的有机污染物,其生物毒性显著强于其他溴化化合物[11]。我们前期的研究结果表明,PBDE-47可能导致淡水背角无齿蚌机体应激反应并产生急性毒性效应,具体机制有待进一步探究。在本研究中,从背角无齿蚌中克隆出AwHSP70完整基因序列,通过real-time PCR分析AwHSP70表达,为揭示PBDE-47毒性效应奠定理论基础。
1 材料与方法(Materials and methods)
1.1 材料
背角无齿蚌购自南阳市水产市场,壳长(6.5±0.5) cm,处理之前,动物置于实验室自动水循环系统中适应养殖2周。PBDE-47(Sigma-Aldrich, St. Louis, MO, USA)溶解于二甲亚砜(DMSO)制备储备液。动物处理实验在长方形塑料盒(40 cm×25 cm,高10 cm)中进行,饲养采用人工模拟池塘水(每1 L去离子水中含48 mg NaHCO3、33 mg CaCl2·2H2O、60 mg MgSO4·7H2O和0.5 mg KCl)[10]。为了确定AwHSP70组织分布,对来自同一塑料盒5只动物进行解剖,取斧足、鳃、肝胰脏、闭壳肌、心脏、血淋巴和外套膜等组织。根据上述动物处理方法,将80只河蚌随机饲养于10个塑料盒中,每盒8只,分为对照组和PBDE-47处理组,每组5个盒子。PBDE-47处理组采用3.36 μg·L-1的PBDE-47进行处理,对照组用同体积DMSO处理,水中DMSO浓度不超过3‰。第0、1、3、6、9、12和15天从每组中取出5只河蚌,解剖肝胰脏、鳃和血淋巴,液氮速冻,于-80 ℃保存。
1.2 方法
1.2.1 总RNA提取和cDNA第一链的合成
总RNA提取采用TRIzol试剂(宝生物工程(大连)有限公司,大连),1.2%琼脂糖凝胶电泳检测RNA质量,具有完整rRNA条带的RNA用于合成cDNA,M-MLV试剂盒合成第一链cDNA,用作PCR反应模板。
1.2.2 背角无齿蚌AwHSP70核心片段的扩增
简并引物AwHSP71和AwHSP72分离AwHSP70 cDNA保守区域片段,PCR产物连接至pMDT-19载体,双向测序。确定HSP70部分cDNA序列后,根据部分cDNA序列设计的特异性引物(表1),按照试剂盒要求,扩增AwHSP70 cDNA 5’和3’区域序列,5’Race和3’Race的PCR产物进行测序和拼接。
1.2.3 序列和系统发育分析
分析AwHSP70序列,通过GenBank数据库搜索(www.ncbi.nlm.nih.gov/blast)进行BLAST程序比对;根据http://www.cbs.dtu.dk/services/SignalP预测信号肽;采用Simple Modular Architecture Research Tool (http://smart.embl-heidelberg.de/)预测蛋白质结构域;使用DANMEN分析程序对AwHSP70基因进行多序列比对;通过Swiss-model(http://swissmodel.expasy.org/)预测AwHSP70的蛋白质三维结构;使用MEGA5.0软件构建系统进化树。
1.2.4AwHSP70 mRNA水平定量检测
为了确定AwHSP70转录水平,采用SYBR Premix Ex TaqTM试剂盒并按照要求进行定量分析。β-actin作为内参基因,根据AwHSP70-F和AwHSP70-R引物常用PCR仪中的分离靶基因(表1),琼脂糖凝胶电泳检测出一个条带,并进行PCR产物测序和序列鉴别。使用ABI7500实时检测系统(Applied Biosystems,美国)进行real-time PCR分析,构建标准曲线,通过2-△△CT分析AwHSP70表达水平。
1.2.5 统计学分析
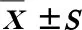
2 结果(Results)
2.1 背角无齿蚌AwHSP70基因的cDNA及预测蛋白质序列分析
AwHSP70 cDNA序列由2 305 bp核苷酸序组成,全长cDNA包含1个67 bp的5’-端非编码区、1个267 bp的5’-端非编码区和1个1 971 bp的开放阅读框。开放阅读框为由657个氨基酸组成的多肽,分子量为71.57 kDa,理论等电点为5.61(图1)。AwHSP70具有HSP70家族3个标签序列(7-IDIDLGTTYSLGTTYSCV-16、197-IFDLGGGTFDVSIL-210和334-IVLVGGSTRIPKV-348),ATP/GTP结合位点为131-AEAYLGQR-137,核定位信号区域为246-KRKHKKDISDNKRSVRR-262,另有C末端高度保守的EEVD序列和重复序列GGXP(图1)。
2.2 背角无齿蚌AwHSP70的进化关系
BLAST分析显示,AwHSP70的氨基酸序列与HSP70家族成员具有显著相似性,与三角帆蚌和光滑双脐螺同源性分别为98.63%和88.43%。AwHSP70与模式生物小鼠、斑马鱼、非洲爪蟾、水蚤和果蝇同源性分别为86.76%、85.54%、81.76%、81.91%和71.88%。为了分析AwHSP70的进化关系,分别从脊椎动物和无脊椎动物物种中选择HSP70家族的不同成员,通过MEGA5.0邻接法构建系统进化树。AwHSP70与双壳类和腹足纲动物亲缘关系最近,昆虫、甲壳动物和哺乳动物次之,脊椎动物较远,细菌亲缘关系最远(图2)。

图2 根据背角无齿蚌AwHSP70氨基酸序列使用邻接法构建的系统进化树Fig. 2 Phylogenetic tree constructed by adjacency method according to the Anodonta woodiana AwHSP70 amino acid sequence
2.3 背角无齿蚌AwHSP70 mRNA的组织分布
组织分布结果显示,AwHSP70广泛表达于背角无齿蚌斧足、鳃、心脏、肝胰脏、血淋巴、闭壳肌和外套膜(图3)。上述组织中,AwHSP70 mRNA在肝胰脏中表达水平最高,鳃和血细胞次之,心脏、闭壳肌、外套膜和斧足最低(图3)。

表1 PCR扩增引物序列Table 1 PCR amplified primer sequence

图3 背角无齿蚌AwHSP70基因的空间表达注:每组数据来源于5只动物,重复3次。Fig. 3 The spatial expression of Anodonta woodiana AwHSP70 geneNote: Each group data was derived from five animals and the experiment was repeated three times.
2.4 PBDE-47对背角无齿蚌AwHSP70表达的影响
正常条件下,AwHSP70在背角无齿蚌肝胰脏、鳃和血淋巴表达稳定,PBDE-47处理组中AwHSP70表达水平受到显著影响。1~15 d内,PBDE-47处理后肝胰脏中AwHSP70 mRNA水平随时间显著上调(图4);与对照组相比,AwHSP70 mRNA水平在第1天增加2.79倍(P<0.01),第15天增加13.15倍(P<0.01)(图4A)。PBDE-47处理后,与对照组相比,鳃中AwHSP70表达水平显著上调;且变化趋势呈现倒U字形,1~6 d内AwHSP70表达水平显著上调,第6天达到峰值,6~15 d内呈现下调趋势(图4B)。与对照组相比,第1天后血淋巴中AwHSP70 mRNA水平增加了1.81倍(P<0.05)(图4C)。
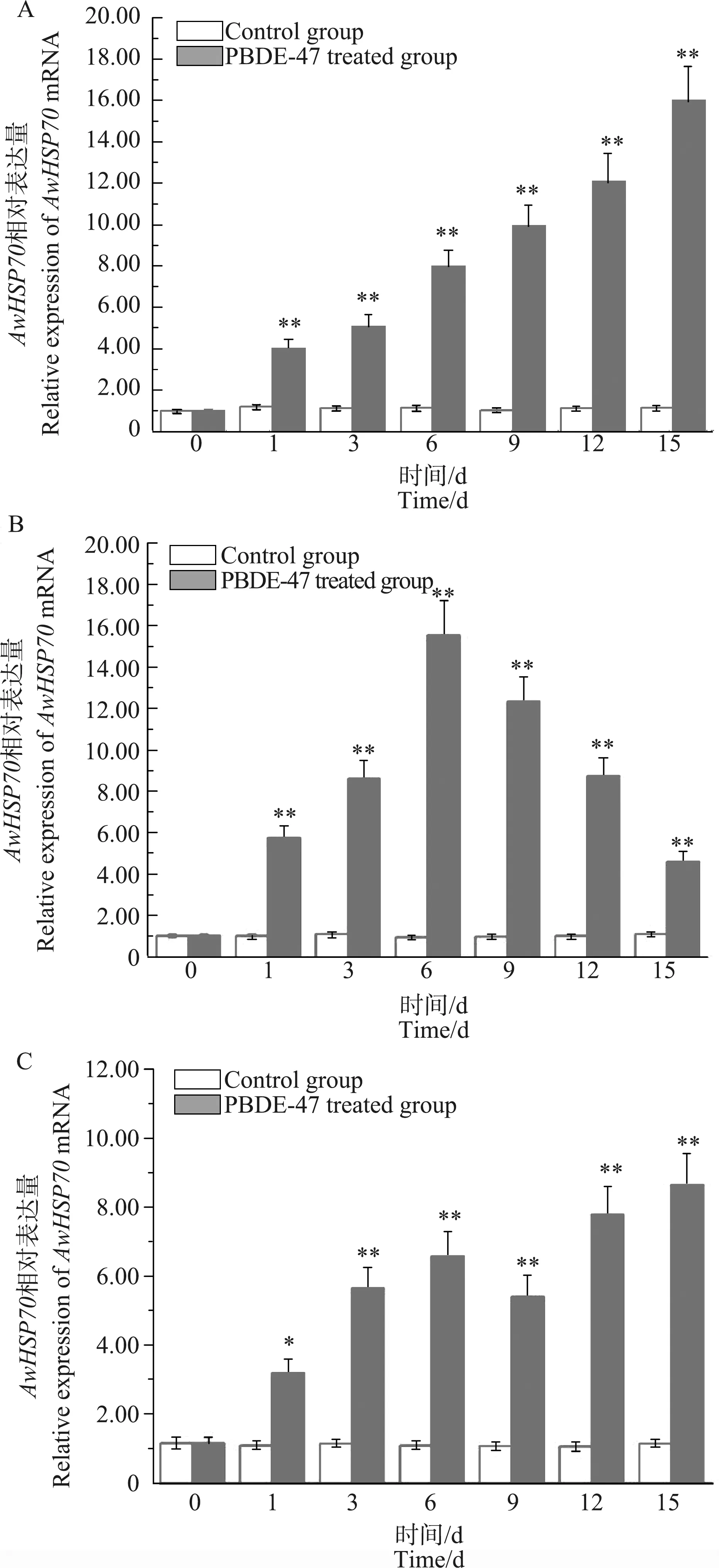
图4 PBDE-47对背角无齿蚌肝胰腺AwHSP70基因表达的影响注:A 肝胰腺,B 腮,C 血淋巴;n=5,*、**表示与相应对照组相比差异显著(P<0.05、P<0.01)。Fig. 4 The effect of PBDE-47 on AwHSP70 gene expression in Anodonta woodiana hepatopancreasNote: A, hepatopancreas; B, gill; C, hemolymph; n=5; *, **indicates a significant difference compared with the corresponding control group (P<0.05, P<0.01).
3 讨论(Discussion)
在AwHSP70蛋白质序列中包括HSP70家族的保守结构域和特征性序列,如:HSP70标签序列1、2和3,细胞核定位信号、ATP/GTP结合位点序列、C末端最后4个氨基酸形成EEVD特定基序,提示AwHSP70是一种胞浆类型热休克蛋白。根据HSP70家族特征序列和细胞中的分布,可将HSP70划分为不同类型。EEVD保守结构被视为胞浆类型热休克蛋白与其他类型区别的关键标志。HSP70的GGMP氨基酸重复结构域能够促进HSP90和其他辅助分子与其形成多分子伴侣复合体[12-13]。GGMP重复区域还参与蛋白质三维结构和螺旋亚结构域形成,在介导辅助因子与分子伴侣结合方面发挥重要作用[14]。由此可见,GGMP在AwHSP70形成的连续重复区域可能在多分子伴侣复合体形成和辅助因子识别方面发挥重要作用。值得注意的是,AwHSP70氨基酸序列与其他HSP70家族成员具有高度同源性,但UTR核苷酸序列却各不相同,推测HSP70的UTR核苷酸序列差异性可能与不同物种HSP70转录调控的复杂性有关。
序列比对和系统进化分析结果显示,从软体动物到昆虫,以及到脊椎动物,HSP70谱系高度保守。背角无齿蚌和三角帆蚌存在更为亲近的亲缘关系,提示二者在进化上来自同一个祖先。背角无齿蚌AwHSP70 mRNA具有广泛的分布,提示这种分布模式与AwHSP70参与环境应激反应和提高耐受性相关。肝胰脏是软体动物主要的消化、吸收和分泌器官,不断接触温度、pH和水体成分等变化,对环境改变敏感[15]。鳃是动物的呼吸器官,环境中污染物主要入口之一,并与污染物直接接触[16]。双壳类微循环系统是一个淋巴细胞和血细胞混合在一起的开放式循环系统,淋巴细胞和血细胞在淋巴管、血窦以及全身软组织中流通。黏膜组织中淋巴细胞和血细胞填盈充足,与这些器官与周围环境进行氧气交换或营养素提取有关。血淋巴是应对环境应激的重要防线[17]。肝胰脏、鳃和血细胞在维护动物稳态方面发挥关键作用,也是环境因素作用的关键靶器官。肝胰脏、鳃和血淋巴中的AwHSP70表达水平相对较高,提示这种分布模式很可能与器官功能有关。
在本研究中,PBDE-47处理能够诱导肝胰脏、鳃和血淋巴中AwHSP70表达,提示背角无齿蚌能够通过上调AwHSP70表达提高对PBDE-47暴露的适应能力和耐受能力。背角无齿蚌作为一种滤食性淡水生物,靠过滤水体中营养物质来维持生存。PBDE具有较高亲脂性,水中溶解的PBDE很容易蓄积在细胞中,导致活性氧(ROS)大量产生。正常情况下,ROS很快被一系列抗氧化酶清除,维持在一个合理水平。在应激环境中,过量生成ROS引起DNA损伤、脂质过氧化和蛋白质糖基化,导致蛋白质错误折叠可能性增加。HSP70表达上调有助于帮助错误折叠蛋白质进行修复和转膜,并促进错误折叠白质降解,提高机体环境适应性和耐受性。与其他热休克蛋白家族相比,HSP70研究较为广泛且对环境应激较为敏感。暴露于重金属和多环芳烃类后,紫贻扇贝能够上调HSP70表达提高对污染物的耐受能力[18]。虾夷扇贝暴露于麻痹性贝类毒素后,能够增加HSP70表达水平以增强毒性应激的适应能力[19]。高温条件下,太平洋牡蛎通过增加HSP70表达来提高自身对高温的适应能力[20]。抗抑郁型药物氟西汀处理后,河蚬消化腺中HSP70 mRNA表达水平上调[21]。研究证实,一些蚌类HSP70表达可被重金属激活,该过程是金属硫蛋白调控途径的重要环节之一[22-27]。干扰机体蛋白质正确折叠是环境因素和污染物干扰机体功能的重要路径之一,而激活HSP表达是动物提高环境适应能力的关键策略[28]。由此,AwHSP70表达上调是背角无齿蚌应对PBDE-47引起的氧化应激重要手段之一。
PBDE-47处理后,肝胰脏中AwHSP70 mRNA水平上调表现出时间依赖模式,提示这种模式与动物的代偿机制相关。动物长期暴露在PBDE-47环境中,机体通过适应性机制处理应激效应,并逐渐恢复细胞稳态。作为一种细胞内的分子伴侣,HSP70参与细胞内外免疫调控并保护细胞免受环境应激损害,HSP70表达常表现出时间和剂量依赖性模式。铜、镉和180CST燃料油等重金属和其他化学物质处理后,紫贻扇贝肝胰脏中HSP70表现出时间依赖性的上调模式。涡鞭毛虫毒素处理虾夷扇贝后,HSP70表达水平呈现出时间依赖性上调模式。太平洋牡蛎高温条件下HSP70表达水平呈时间依赖性上调模式。苯并芘处理后,菲律宾哈仔消化腺中HSP70和HSP90表达水平显著上调,其绝对表达水平呈现时间和剂量依赖性反应。
整个实验过程中,背角无齿蚌鳃中AwHSP70表达呈现倒U型曲线,早期上调,中期达到峰值,晚期下降,提示这种现象可能与动物应对持续产生氧化应激的耐受能力有关。随着PBDE-47处理时间延长,PBDE-47在体内不断蓄积,将不断产生ROS,导致细胞应对不断增加的氧化应激效应。机体通过上调HSP表达的方式减少错折叠蛋白质的产生,增强耐受性[29]。一旦PBDE-47处理后氧化应激水平达到峰值并超出细胞耐受能力,巨大应激效应将导致慢性损伤、炎症和细胞凋亡[30-31]。这种情况下,如果动物丧失产生新细胞去补偿死亡细胞的能力,活细胞数量将逐渐降低[32-33]。由此,PBDE-47处理后AwHSP70表达水平呈现出倒U型曲线变化趋势。
值得注意的是,水蚤LC50急性毒性结果显示,PBDE-28、PBDE-47、PBDE-99和PBDE-100呈现出不同的毒性效应,其原因与这些物质的亲脂性有关。其中PBDE-47、PBDE-99和PBDE-100具有明显的高亲脂性,呈现出较强的毒性效应[34]。由此,为了系统分析PBDE-47对背胶无齿蚌和淡水生物的毒性效应,需要从多个基因靶点和多个靶组织予以分析。总之,本研究首次从背角无齿蚌中克隆出AwHSP70 cDNA序列,该序列包含HSP70家族高度保守的标签序列。PBDE-47处理可显著上调肝胰脏、鳃和血淋巴中AwHSP70表达水平,AwHSP70转录水平上调与提高动物的耐受性和适应能力密切有关。
