大鼠蛛网膜下腔出血早期脑损伤及炎症反应特点
2020-01-09梁兆俊袁雨李佳仪刘康妮石强冯娅妮
梁兆俊,袁雨,李佳仪,刘康妮,石强,冯娅妮
(中国医科大学附属第一医院 1.麻醉科;2.神经外科,沈阳 110001)
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)多是由于颅内动脉瘤破裂引起,具有较高的致死率和致残率[1-2]。以往研究[3]认为SAH后引起的脑血管痉挛对疾病的发展以及对患者预后起关键性作用,但对脑血管痉挛治疗发现并未明显改善患者预后。最近研究[4]表明,SAH导致的早期脑损伤(early brain injury,EBI),即发病72 h内产生直接及继发性颅脑损伤对患者预后有重要意义。有研究[5]称炎症反应在SAH后早期脑损伤中起重要作用。最近研究[6]发现大鼠SAH早期脑损伤模型建立后,在大鼠脑皮质中有核苷酸结合寡聚化结构域样受体蛋白3(Nod-like receptor pyrin domain-containing protein 3,NLRP3)表达,但在大鼠海马神经元中是否表达未见报道。GOU 等[7]研究发现SAH造模后对海马神经元损伤最明显。本研究探讨大鼠SAH早期脑损伤特点及其作用机制。
1 材料与方法
1.1 试剂、动物及分组
实验试剂包括戊巴比妥钠,兔抗鼠NLRP3(美国NOVUS公司),兔抗鼠IL-1β、兔抗鼠IL-18(美国Abcam公司),β-actin、辣根过氧化物酶标记的山羊抗兔、山羊抗鼠二抗(中国中杉金桥公司)。
雄性SD大鼠72只,体质量280~320 g,由中国医科大学实验动物中心提供。实验室恒温(24±2)℃,相对湿度40%饲养。每笼5只大鼠,大鼠可以随时获得食物和水,所有操作均按照国家统一标准完成。
将大鼠随机分组:假手术组(n=12)和SAH组(n=60)。SAH组根据出血后时间又分为SAH6 h、12 h、24 h、36 h、72 h 5组,每组12只。假手术组行枕大池二次注射生理盐水;SAH组行枕大池二次注血法,分别于相应时间点处死大鼠并获取海马组织,-80 ℃低温冰箱保存。
1.2 SAH大鼠模型建立
采用经典枕大池二次注血法[8]制作SAH大鼠模型。使用3%戊巴比妥钠(50 mg/kg)麻醉大鼠。用立体定向头架固定大鼠头部,备皮消毒后沿头正中线切开筋膜肌肉,暴露寰枕筋膜,用一次性无菌辅料保护切口区。然后将大鼠仰卧位,备皮消毒腹股沟股动脉区,切开大鼠腹股沟区皮肤,充分暴露出股动脉,并固定该动脉,抽取自体非肝素化的股动脉血(约0.10 mL/l00 g),再将大鼠俯卧位固定,从枕骨大孔进针约1 mm(针穿过环枕膜时有突破感,回抽并有负压感)后缓慢注射自体动脉血(0.1 mL/min),注血完成停留5 min,拔出针头后用止血棉封闭穿刺口,逐层缝合肌层和皮肤。大鼠置30°头低脚高位约30 min,然后放入笼内饲养。48 h后再取对侧股动脉血进行2次注血,方法与第1次注血相同。假手术组枕大池内注射等量生理盐水(0.1 mL/100 g)。
1.3 大鼠脑水含量检测
于各目标时间将大鼠处死取脑,冰上快速分离脑组织,取左、右侧大脑半球,用电子天平(精确到0.1 mg)测量左、右脑组织湿重,然后放入恒温箱(68.7 ℃)烘烤48 h至恒重,冷却后放电子天平测其干重(2次测量误差<0.1 mg),最后计算脑组织含水量:脑组织含水量(%)=(湿重-干重)/湿重×100%[9]。
1.4 Western blotting
海马组织超声下裂解,使用总蛋白提取试剂盒(中国Beyotime 公司)提取总蛋白。10%SDS-PAGE胶,恒压80 V电泳30 min,转100 V继续分离提取蛋白样品,接着恒电流220 mA将蛋白转移到PVDF膜上,5%脱脂奶粉封闭2 h;孵育一抗:兔抗鼠NLRP3(3∶1 000)、兔抗鼠IL-1β(1∶1 000)、兔抗鼠IL-18(1∶1 000)、β-actin(1∶2 000)4 ℃摇床中孵育过夜;次日1×TBST漂洗3次(10 min/次),使用辣根过氧化物酶标记的山羊抗兔二抗(1∶20 000)孵育2 h,1×TBST漂洗3次(5 min/次),采用发光液(中国BeyoECL Plus公司)与发光仪上显影[10]。使用Image J软件进行相关蛋白分析。
1.5 评价指标
1.5.1 神经功能评分:采用 Garcia神经功能评价标准[11]评价大鼠神经功能,对大鼠体态的对称性、自动运动情况、前置伸展运动能力、网屏实验、本体感觉、两侧触须反射和两侧身体触觉反应进行评分,评分范围3~18分。评分越低,神经功能障碍越严重。
1.5.2 SAH评分:于不同目标时间将大鼠处死取脑,并将大鼠基底池分为6部分,毎部分根据血凝块的厚度进行评分:0分,无蛛网膜下腔出血;1分,少量蛛网膜下腔出血;2分,中等量血凝块,动脉可肉眼分辨;3分,血凝块覆盖,动脉不可见。6个部分所得评分相加后的总和即为SAH评分,总分0~18分。假手术组大鼠SAH评分为0分,评分<8分大鼠认为损伤较轻[10],不纳入本研究。
1.6 统计学分析
采用Graph Pad Prism7软件进行分析,数据采用表示,组间比较采用单因素方差分析或t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组神经功能和SAH评分比较
与假手术组比较,SAH组大鼠各时间的神经功能和SAH评分明显改变,差异有统计学意义(P<0.05);SAH各时间组大鼠比较,出血12 h组大鼠神经功能评分最低、SAH评分最高(均P<0.05)。见表1。
表1 6组大鼠神经功能和SAH评分比较()Tab.1 Comparison of neurological score and SAH score in the 6 groups()
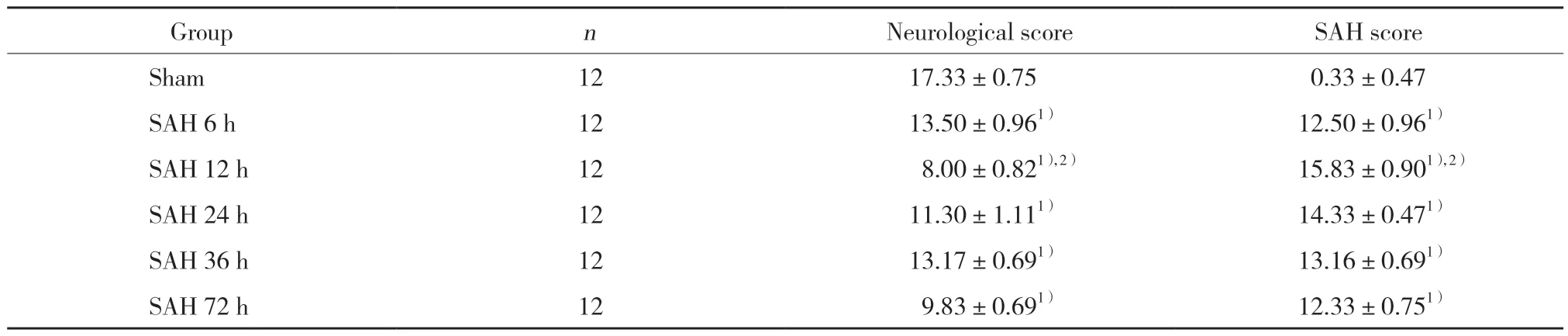
表1 6组大鼠神经功能和SAH评分比较()Tab.1 Comparison of neurological score and SAH score in the 6 groups()
1)P <0.05 vs sham group;2)P <0.05 vs SAH 6 h,24 h,36 h,72 h groups.
2.2 各组大鼠脑组织含水量比较
结果显示,假手术组,SAH 6 h、12 h、24 h、36 h、72 h组脑组织含水量分别为(44.38±0.91)%、(64.29±0.93)%、(84.51±0.93)%、(73.82±1.10)%、(69.31±1.46)%、(60.30±3.33)%。与假手术组比较,各时间SAH组大鼠脑水含量明显增加,差异均有统计学意义(均P<0.05);SAH组各时间大鼠比较,SAH12 h组脑水肿程度最明显(均P<0.05)。
2.3 各组大鼠NLRP3、IL-1β和IL-18蛋白表达水平比较
Western blotting检测结果显示,与假手术比较,SAH组各时间大鼠海马神经元中NLRP3、IL-1β、IL-18蛋白表达水平明显升高,差异有统计学意义(均P<0.05);SAH组各时间大鼠比较,SAH12 h组NLRP3、IL-1β、IL-18蛋白表达水平升高最明显(均P<0.05),见表2、图1。
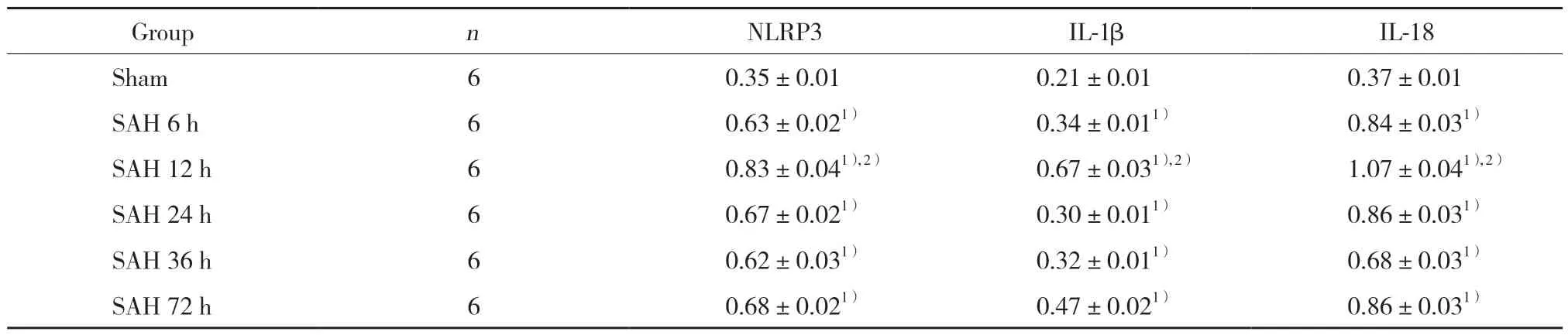
表2 6组大鼠蛛网膜下腔出血后NLRP3、IL-1β、IL-18蛋白表达比较Tab.2 Comparison of NLRP3,IL-1β and IL-18 after subarachnoid hemorrhage in the 6 groups
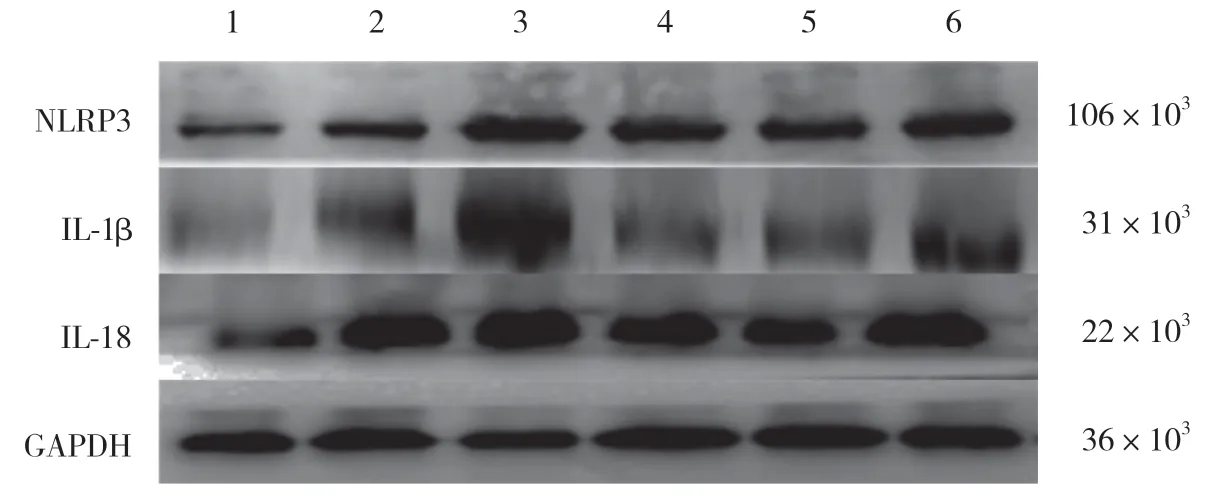
图1 炎性细胞因子NLRP3、IL-1β、IL-18在大鼠海马组织中的表达Fig.1 Expression of inflammatory cytokines NLRP3,IL-1β and IL-18 in rat hippocampus
3 讨论
SAH是由于脑底部或脑表面血管破裂,血液直接流入蛛网膜下腔引起的一种临床现象,约占急性脑卒中的10%[1]。研究[2]报道约80%SAH患者是动脉瘤破裂引起的,其他原因则是血管畸形和血管炎等。本研究采用了枕大池二次注血法来建造大鼠SAH模型,该方法能够有效模拟动脉瘤性SAH过程[8]。本研究结果发现,大鼠SAH造模后6 h就有神经功能损伤、脑水肿,同时相关炎性细胞因子在海马神经元中表达;神经功能损伤、脑水肿及相关炎性细胞因子表达在12 h达到高峰。损伤后72 h内随着时间推移各指标逐渐缓解,但与假手术组比较仍有损害。有研究[12]显示对大鼠早期脑损伤最为严重的时间点是在损伤后24 h,与本研究结果不同,分析原因可能是因为以往研究检测的是大鼠SAH后大脑皮质的损伤,而本研究检测的是大鼠SAH后海马神经元的损伤。
有研究[13]表明炎症反应在SAH后早期脑损伤发病过程中起重要作用,是引起脑组织继发性损伤的重要因素之一。动脉瘤破裂后,血液顺势流入蛛网膜下腔,此时红细胞会因为各种外界因素破坏正常形态,降解产生了大量的血红蛋白、含铁血红素等物质,这些产物刺激中枢神经系统中的固有免疫细胞,免疫细胞通过增生而上调血管内皮细胞黏附分子表达,诱导炎症细胞进入蛛网膜下腔,炎症细胞释放促炎性细胞因子(IL-1β、IL-18、TNF-α等)[14],从而引起颅脑内神经炎症反应。脑组织炎症反应的增强会进一步加重脑组织的继发性损伤,WANG等[15]研究发现星性胶质细胞可以通过释放分泌性糖蛋白(sonic hedgehog,SHH)来维持血脑屏障(blood brain barrier,BBB)的完整性,并进一步发现IL-1β通过降低SHH蛋白的释放来破坏BBB。BLIXT等[16]发现BBB破坏会进一步引起早期脑水肿,从而加重脑组织损伤。引起脑水肿的另一重要因素是水通道蛋白4(aquaporin-4,AQP4),AQP4 分布最广泛,功能非常强大,它参与许多水代谢障碍的调节过程,尤其是在脑缺血缺氧的过程中起到非常重要的作用,近期有研究[17]发现炎性细胞因子(TNF-α、IL-1β等)对AQP4有破坏作用,能够进一步引起脑水肿。本研究结果显示,SAH大鼠早期脑损伤中存在炎性细胞因子释放,同时出现脑水肿,因此猜测神经炎症反应是引起脑水肿的重要因素之一。
在固有免疫系统中,当机体受到伤害性刺激时,可以激活模式识别受体,位于细胞质内的核苷酸结合寡聚化结构域样受体是重要的模式识别受体,在固有免疫应答中发挥着独特功能,而NLRP3炎性体是目前研究较为广泛的炎性体之一[18]。NLRP3激活后可以与凋亡相关斑点蛋白(apoptosis associated speck-like protein,ASC )及效应蛋白半胱氨酸天冬氨酸酶-1前体形成蛋白复合物,此时半胱氨酸天冬氨酸酶-1前体可以通过自切割形式产生有活性的半胱氨酸天冬氨酸酶-1,半胱氨酸天冬氨酸酶-1进一步切割IL-1β前体和IL-18前体,形成有活性的IL-1β和IL-18,引起颅脑内神经炎症反应[19]。因此NLRP3激活在炎症反应中成为一个中心环节。近期有研究[6]报道在动物SAH模型中的大脑皮质中有NLRP3表达,本研究结果显示在SAH大鼠海马神经元中有NLRP3表达,并且在SAH后12 h表达达到峰值。
综上所述,大鼠SAH后存在神经功能损伤、脑水肿及海马神经元中炎性细胞因子表达,并且出血后12 h最为明显,随着时间推移损伤缓解。推测NLRP3、IL-1β、IL-18等炎性细胞因子参与了SAH后的炎症反应,并且在出血后12 h达到峰值。炎症反应可能是引起SAH患者临床症状的原因之一。本研究是大鼠实验研究,并不能完全代表SAH对患者海马神经元的影响,因此还需要进一步研究。
