人胚胎干细胞与急性早幼粒细胞白血病细胞的拉曼光谱特征研究
2020-01-08梁昊岳程雪莲杨晚竹于文颖李长虹董树旭赵轼轩茹永新
梁昊岳,程雪莲,杨晚竹,于文颖,李长虹,董树旭,赵轼轩,茹永新
中国医学科学院血液病医院(中国医学科学院血液学研究所),实验血液学国家重点实验室,国家血液病临床学研究中心,天津 300020
引 言
白血病(acute leukemia, ALs)是一种恶性克隆疾病[1],其中多种类型预后不佳[2]。急性髓细胞白血病(acute myeloid leukemia, AML)是成人中最常见的白血病,它是造血细胞在骨髓中异常增殖和分化的结果[3]。白血病的分类主要包括法-美-英国(FAB)和世界卫生组织(WHO)分类[4-5]。
目前,拉曼光谱已被用作快速和无标记方法来分析和分类具有位置特异性的细胞[6-7]。它是一种振动光谱技术,提供关于细胞和组织的分子组成信息[8]。它也适用于白血病领域的分类。Ilin等[9]应用偏最小二乘判别分析法(PLS-DA),区分长、短周期造血干细胞、粒细胞和淋巴细胞。Happillon等建立了区分CLL和正常淋巴细胞光谱的分类模型[10]。Vanna等从AML和MDS患者样本中区分原始粒细胞,早幼粒细胞,异常早幼粒细胞和成红细胞,并且发现MPO是重要的标志物[11]。但是没有来自使用具有高度分化潜能的胚胎干细胞分析白血病的项目,并发现干细胞和白血病细胞之间的差异。
实验应用拉曼光谱技术对三种不同分化阶段白血病相关细胞进行研究,获取特征光谱数据,通过数学模型分析建立鉴别模型,建立以拉曼光谱技术为基础的区分不同分化阶段白血病相关细胞的新方法。同时,结合白血病相关细胞的超微结构,对拉曼光谱特征进行探讨,以期为研究白血病细胞分化并进行早期鉴别提供一种新方法。
1 实验部分
1.1 人胚胎干细胞和急性早幼粒细胞白血病细胞系的培养与传代
人胚胎干细胞株H1培养于培养板中,培养基为mTeSR(STEM CELL Technologies)。H1细胞克隆传代,在37 ℃孵箱中孵育6~8 min,加入DMEM/F12培养基洗3次,收集细胞悬液,1 000 r·min-1离心5 min。mTeSR培养基重悬后,平均分入培养皿中。H1单细胞传代,使用1 mg·mL-1Accutase、37 ℃消化细胞3 min。DMEM/F12基础培养基重悬细胞悬液,1 000 r·min-1离心5 min。
急性早幼粒细胞白血病细胞系NB4用含10%胎牛血清的RPMI 1640 培养液,于37 ℃、5% CO2、饱和湿度孵箱中培养。
1.2 标本收集
选取天津血液病医院2016年急性早幼粒细胞白血病患者,主要为2016年1月到6月在我院住院的患者,其中男2例,女2例,年龄最小4岁,最大46岁,中位年龄43.5岁。经骨髓穿刺,并进行细胞形态学、流式细胞术和电子显微镜等检查,主要以细胞形态和组化为依据,根据FAB确诊。
1.3 电镜检测
淋巴细胞分离液分离有核细胞,部分细胞做常规电镜观察,其余部分做髓过氧化物酶(myeloperoxidase,MPO)染色。然后锇酸固定、脱水、浸透、包埋、切片和染色。日立H-600(日本)透射电镜观察。根据细胞结构分析,按FAB形成电镜诊断。
1.4 拉曼光谱检测
将分离液分离的有核细胞或培养的细胞系细胞通过甩片机Cytospin4(Thermo Fisher Scientific,美国)均匀涂于石英玻片上。本研究采用共聚焦拉曼光谱仪XploRA Raman microscope(HORIBA Scientfic,法国)对目的细胞检测。以785 nm激光作为激发光,功率为40 mW,记录波数范围为600~1 800 cm-1,通过镜下观察,随机选取一个目的细胞,在扫描拍摄中通过×40 0.75 NA尼康镜头将约40 mW激发激光束聚焦到样品上2 μm×2 μm的光斑大小尺寸上。每种白血病患者检测20~30个细胞,每个细胞标本区域扫描累积时间为250 s,分辨率为1 cm-1。应用Labspec6软件(BC Cancer Research Center,加拿大),平滑系数为1,消除噪声信号、去除荧光背景并对光谱进行平滑,并在整个光谱区域校正多点基线。所有光谱以各自的1 450 cm-1拉曼峰进行归一化。
1.5 拉曼光谱数据分析及鉴别模型建立
采用SPSS Statistics 20(IBM,USA)软件处理数据,对人胚胎干细胞系、急性早幼粒细胞白血病细胞系(NB4)和急性早幼粒细胞白血病患者(M3)骨髓白血病细胞进行主成分分析、判别分析和聚类分析。应用主成分分析(principle component analysis,PCA)法对获得的拉曼光谱数据进行PCA。应用判别函数分析(discrimination function analysis,DFA)对获取的主成分数据进行分析,建立鉴别模型对ESCs,NB4和M3患者白血病细胞的光谱数据进行鉴别,应用交互验证(cross-validation)的方法对鉴别模型进行验证。采用SIMCA-P (Ver 14.1,Umetrics,Umea,Sweden)软件对三组细胞进行偏最小二乘判别分析(partial least squares discrimination analysis,PLS-DA)。所有数据操作使用Origin(OriginLab,Northampton,MA)、Graphpad Prism5(Graphpad Software,USA)和Volocity(Perkin Elmer,USA)软件进行。
2 结果与讨论
2.1 三组细胞瑞氏-吉姆萨染色光学显微镜成像与电子显微镜成像结果
从图1(a)吉姆萨染色的病理图中可以看出M3细胞核不规则,胞浆含大量颗粒。图1(b)中NB4细胞胞浆少,核质比大,细胞核规则,核仁不明显。图1(c)中ES细胞胞浆稀少,异染色质多,核仁不明显,无致密颗粒。图1(d)的电镜结果显示M3细胞富含颗粒,内质网扩张。图1(e)中NB4细胞颗粒少,细胞核轻度不规则。图1(f)中ES细胞核仁明显,无颗粒。M3细胞胞浆内所含颗粒主要为MPO颗粒。为了确认拉曼数据,从形态学成像计算细胞核质比例。我们从图1(a)—(c)选取20~24个细胞计算核质比例。M3,NB4和ES细胞的平均比例依次上升[图1(g)]。通过形态学成像获得的数据与通过拉曼显微镜获得的数据一致。然后通过TEM图像分析MPO含量。在TEM图像中清楚地显示了含有亚细胞水平的MPO颗粒的分布[图1(d)—(f)]。M3细胞显示强烈的MPO活性[图1(d)]。NB4细胞含有一些显示细胞质中MPO活性较弱的细颗粒[图1(e)]。ES细胞中MPO的分布非常少[图1(f)]。三种不同分化阶段白血病相关细胞中MPO含量的变化趋势与MPO带(1 581 cm-1)收集的拉曼数据一致。
2.2 三组细胞平均拉曼光谱的外形比较
本研究共获得不同分化阶段白血病相关细胞拉曼光谱181例,其中ES细胞特征光谱29例,NB4细胞特征光谱25例,M3细胞特征光谱127例(图2)。细胞拉曼光谱的分子结构和峰位归属见表1。在600~1 800 cm-1的范围内可见三种不同分化阶段白血病相关细胞拉曼光谱呈现多个谱峰,形态相近。通过对比平均光谱,获得差异性光谱,显示不同种细胞间的拉曼光谱存在一定差异(图3)。在M3细胞和NB4细胞差异光谱中,M3细胞在754,781,852,1 003,1 033,1 121,1 157,1 215,1 340,1 551,1 581 cm-1等处对应的谱峰明显强于NB4细胞,其中852,1 003,1 033,1 157和1 551 cm-1反映样本细胞内蛋白质的结构及含量,781,1 340,1 581 cm-1与核酸相关,在这些波数处谱峰强度的变化表明M3细胞中的DNA,RNA和蛋白质等物质的含量明显高于NB4细胞。M3细胞在754,1 003,1 121,1 157,1 173,1 215,1 340,1 551和1 581 cm-1等处的谱峰强于ES细胞,表明前者核酸、蛋白质、脂类等物质的含量较高。NB4细胞和ES细胞拉曼光谱的比较显示,前者在622,643,781,852,934,1 003,1 340和1 581 cm-1谱峰明显高于ES细胞,其中622,643,852,934和1 003 cm-1与蛋白质有关,781,1 340和1 581 cm-1与核酸组分有关,提示NB4细胞内蛋白质和核酸等物质与ES细胞存在较大差异。上述结果显示白血病细胞的整体活跃程度高于相对原始的胚胎干细胞,这与PI3K/Aku/mTOR通路有密切关系。例如mTOR复合物1(mTORC1)通过调控RNA翻译、线粒体基因转录、磷酸化线粒体蛋白、参与糖酵解等方式,控制线粒体活性和生物合成。mTORC1也可促进磷酸戊糖途径相关基因表达来促进核酸生成。mTORC1也可通过调节核糖体合成(mTORC1-S6K-S6通路)和mRNA的转录起始来调控蛋白质合成。此外,mTORC1可通过激活脂肪合成基因的调控分子SREBP来促进脂肪生成。更为重要的是,mTOR可以抑制细胞的过度自噬。上述生物学过程解释了白血病细胞光谱在核酸、蛋白质及脂类等物质谱峰强度高于ES细胞的原因。电镜下观察到M3细胞胞浆中存在大量MPO颗粒,数量明显高于NB4、ES细胞。MPO是一种含血红素辅基的血红素蛋白酶。因此三组白血病相关细胞平均光谱在754,1 121,1 215和1 581 cm-1峰位上存在明显的差异,这对通过拉曼光谱鉴别三种白血病相关细胞具有潜在的应用价值。
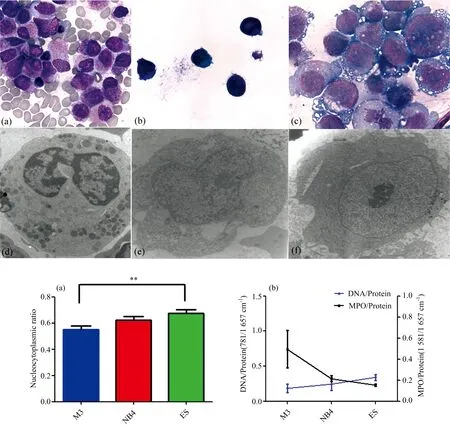
图1 三组细胞形态学分析结果
(a)—(c): M3, NB4, ES细胞瑞氏-吉姆萨染色结果; (d)—(f): M3, NB4, ES细胞透射电镜结果; (g): 数字化图像中M3, NB4, ES细胞核质比率计算结果; (h): M3, NB4, ES细胞MPO含量和核质比率平均值比较(**p<0.01)
Fig.1Morphologicalanalysisofthreegroupsofcells
(a)—(c): Wright-Giemsa staining result of M3, NB4, ES cell; (d)—(f): TEM result of M3, NB4, ES cell; (g): Calculation of nucleocytoplasmic ratio of M3, NB4, ES cell in digitization images; (h): Comparison of averaged intensity of MPO content and nucleocytoplasmic ratio of M3, NB4, ES cell (**p<0.01)
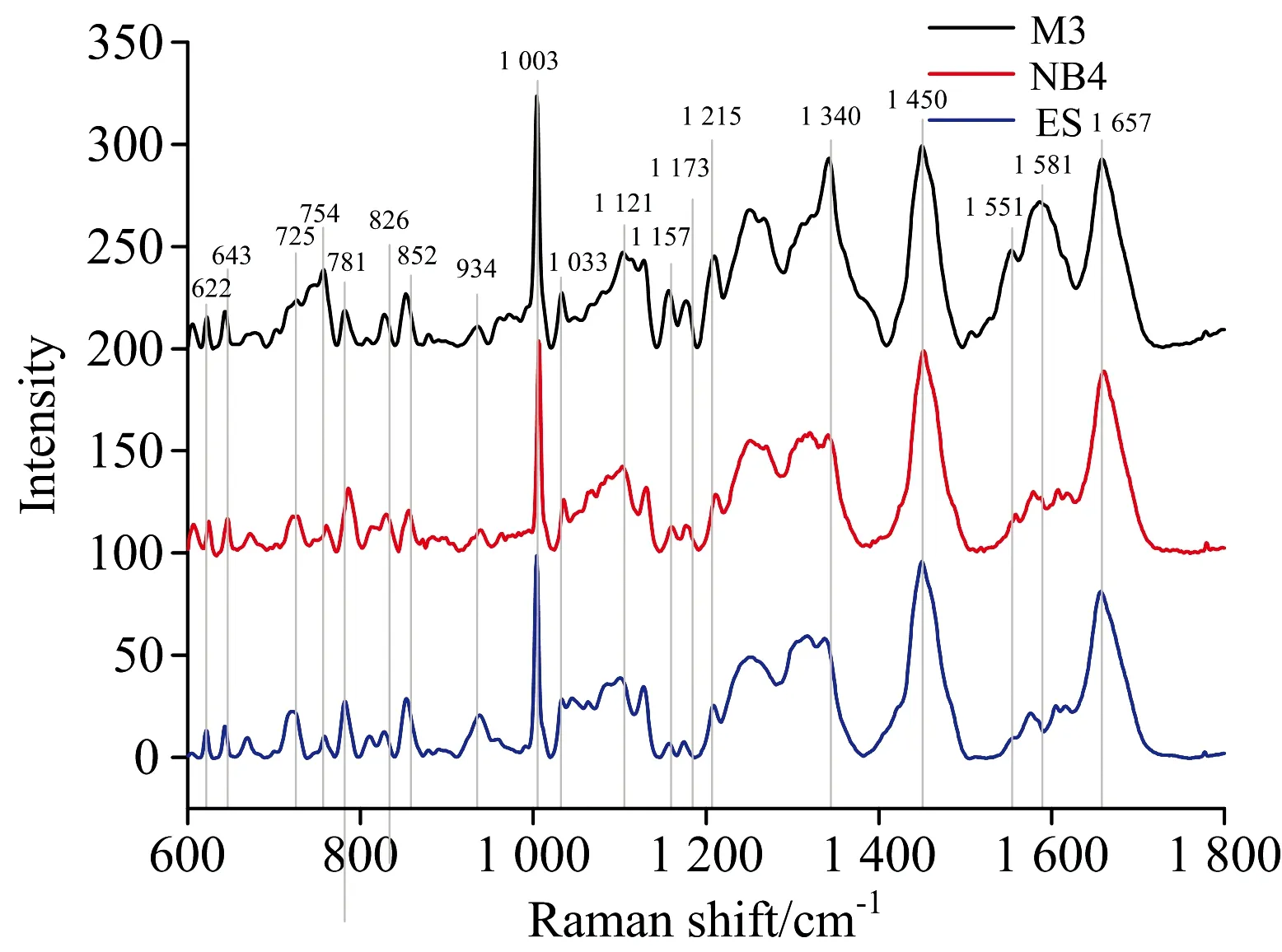
图2 三组细胞平均拉曼光谱
2.3 三组细胞拉曼光谱的主成分分析-判别分析结果
通过对ES,NB4和M3患者骨髓白血病细胞的光谱数据进行PCA分析,从每张光谱1211个数据点提出79个主成分,累积变异性97%。将提取出的181张光谱数据的主成分进行DFA分析,建立鉴别模型。在DFA鉴别分类过程中,ES鉴别准确率为100%(29/29),NB4鉴别准确率为100%(25/25),M3鉴别准确率为100%(127/127),总体鉴别准确率达100%(181/181)。本研究采用交互验证的方法对鉴别模型进行检验,ES鉴别准确率为100%(29/29),NB4鉴别准确率为96%(24/25),M3鉴别准确率为99.2%(126/127),而通过交互验证检验后鉴别模型的总体准确率达98.9%(179/181),表明鉴别模型预测能力良好(表2)。本文从3类细胞拉曼光谱结果中随机抽取30张特征光谱(每类10张),组成三组数据。图4显示3组数据的二维分布和三维分布,表明应用PCA-DFA方法可以很好地鉴别ES,NB4和M3患者骨髓白血病细胞的光谱数据。

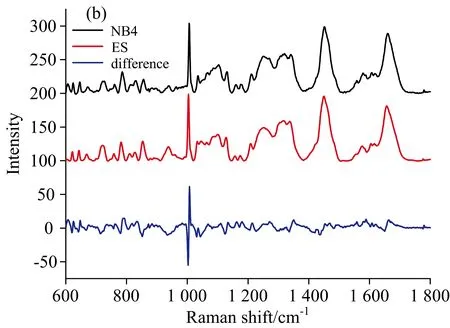
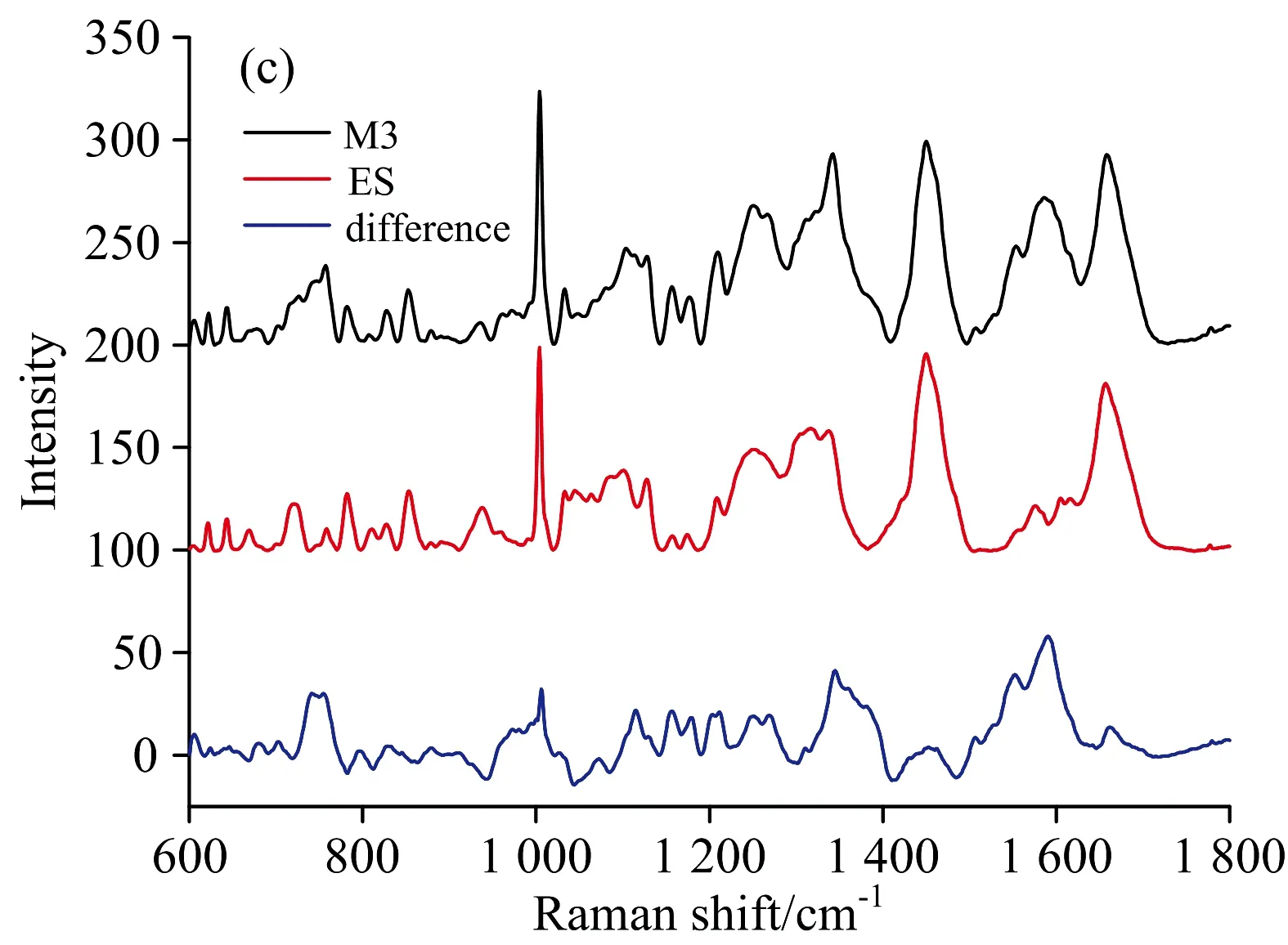
图3 三组细胞的平均和差异谱

表1 细胞拉曼光谱的分子结构和峰位归属
续表1
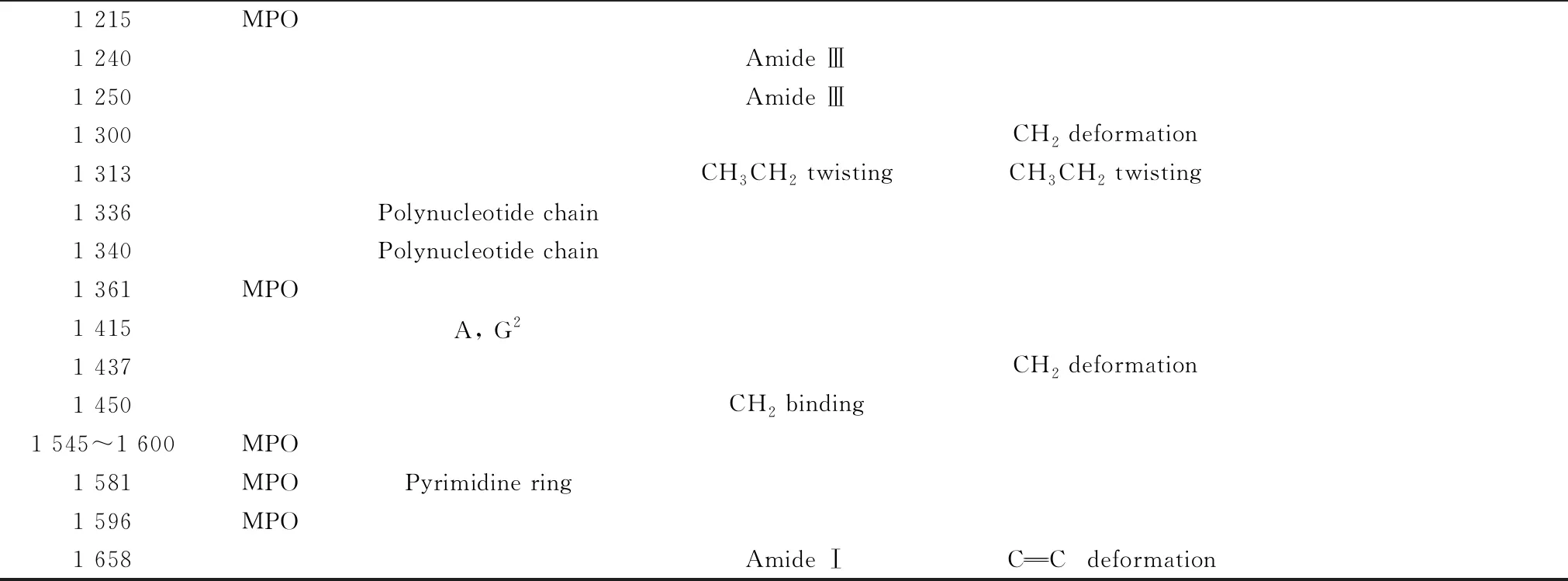
1 215MPO1 240Amide Ⅲ1 250Amide Ⅲ1 300CH2 deformation1 313CH3CH2 twistingCH3CH2 twisting1 336Polynucleotide chain1 340Polynucleotide chain1 361MPO1 415A, G21 437CH2 deformation1 450CH2 binding1 545~1 600MPO1 581MPOPyrimidine ring1 596MPO1 658Amide ⅠCC deformation

图4 主成分分析结果
2.4 系统聚类分析
系统聚类法是目前最常用的一种聚类方法。使用前文所述方法从3类细胞拉曼光谱结果中随机抽取30张特征光谱(每类10张),组成三组数据。由图5可知,该方法能很好地将ES细胞(1~10)、NB4(11~20)和M3细胞(21~30)拉曼光谱区分为三大类。
表2 基于PCA-DFA的三组细胞分类和交互验证结果

Table 2 Classification and cross-validation result of the three groups based on PCA-DFAClassification Resultsa,c
a: 100.0% of original grouped cases correctly classified; b: Cross validation is done only for those cases in the analysis. In cross validation, each case is classified by the functions derived from all cases other than that case; c: 98.9% of cross-validated grouped cases correctly classified.
2.5 三组细胞拉曼光谱的偏最小二乘判别分析结果
为了更好的区分ES,NB4和M3细胞的拉曼光谱差异,区分这三种细胞的特异性生物标志物,在PCA分析结果的基础上对数据进一步运用有监督的模式识别方法——偏最小二乘判别分析(PLS-DA)对样本数据进行分析比较。如图6所示,使用前文所述分组方法,三种细胞被成功区分。模型质量参数R2X=0.684,R2Y=0.979,Q2=0.937,模型质量参数表示该模型概括了第一主成分(t[1])和第二主成分(t[2])两种整体信息的68.4%,能解释因变量97.9%的变异信息,模型可预测准确程度为93.7%。三种细胞中起主要区分作用的峰位在于MPO相关峰(754,1 121,1 215和1 581 cm-1)、蛋白质相关峰(934,1 003和1 450 cm-1)以及核酸相关峰(826和1 340 cm-1)。
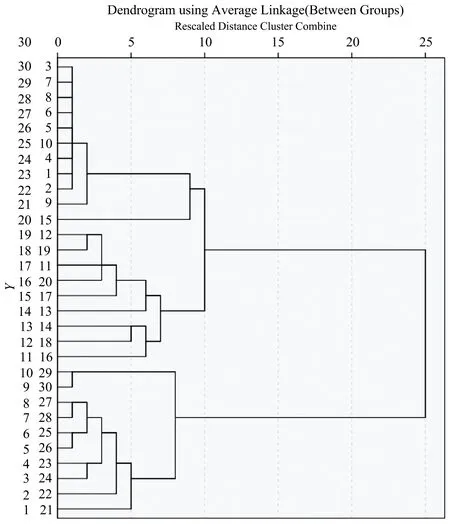
图5 三组细胞聚类分析树状图
2.6 三种细胞两两组合进行偏最小二乘判别分析结果和潜在变量负荷
为了进一步客观地验证三种细胞的拉曼谱峰差别,在差异谱的基础上将三种细胞两两组合进行PLS-DA并分析载荷表征情况。如图7(a)—(c)所示,三种细胞被两两成功区分,PLS拟合参数如下: (a)R2X(cum)=0.634,R2Y(cum)= 0.99和Q2(cum)=0.966,(b)R2X(cum)=0.581,R2Y(cum)=0.991和Q2(cum)=0.941,(c)R2X(cum)=0.496,R2Y(cum)=0.99和Q2(cum)=0.945。表明大部分方差由模型解释,PLS-DA得分图模型参数良好,并且拟合程度良好。使用这种方法,我们清楚地将其他三种不同分化阶段细胞区分开。通过载荷分析,ES细胞在核酸峰(781,826和1 340 cm-1)高于M3细胞,这与影像学观察到的ES细胞具有较高的细胞核与细胞质比率一致,符合处于分化早期的原始细胞的一般特征。MPO相关峰(754,1 121,1 215和1 581 cm-1)是区分三种细胞的主要因素之一,在M3,NB4和ES细胞中的含量依次减少,这一现象与三种细胞超微结构观察到的颗粒依次减少相符。其余蛋白相关峰(622,643,852,934,1 003,1 450和1 551 cm-1)反映了三种细胞的活跃程度和增值代谢依M3,NB4和ES顺序逐渐递减,这与它们所处的分化阶段有关,也与拉曼差异谱反映的信息一致,但并非如MPO和细胞核质比率具有较高的特异性。
3 结 论
该研究证明了拉曼光谱作为基于内在分子指纹的临床工具来研究不同分化阶段白血病相关细胞的潜力[12]。据我们所知,这是有关人胚胎干细胞和早幼粒细胞白血病之间的第一个研究。我们已经证明,ES细胞、NB4细胞和M3细胞中主要的区别光谱特征是由于不同的MPO含量和核胞质比率。这些分子变化可以用作光谱标记以区分不同分化阶段早幼粒细胞白血病相关细胞。证明了利用拉曼光谱和PLS-DA来识别白血病相关细胞的谱系特异性分化阶段的可行性。这表明微小的变化可以在拉曼光谱的PLS-DA模型中捕获并用于鉴定细胞谱系。本研究通过PCA-DFA建立的鉴别模型总体准确率为100%,交互验证后准确率为98.9%,表明该模型预测性较好。系统聚类对不同种白血病细胞具有理想的甄别能力。

图6 三种细胞的PLS-DA分析结果
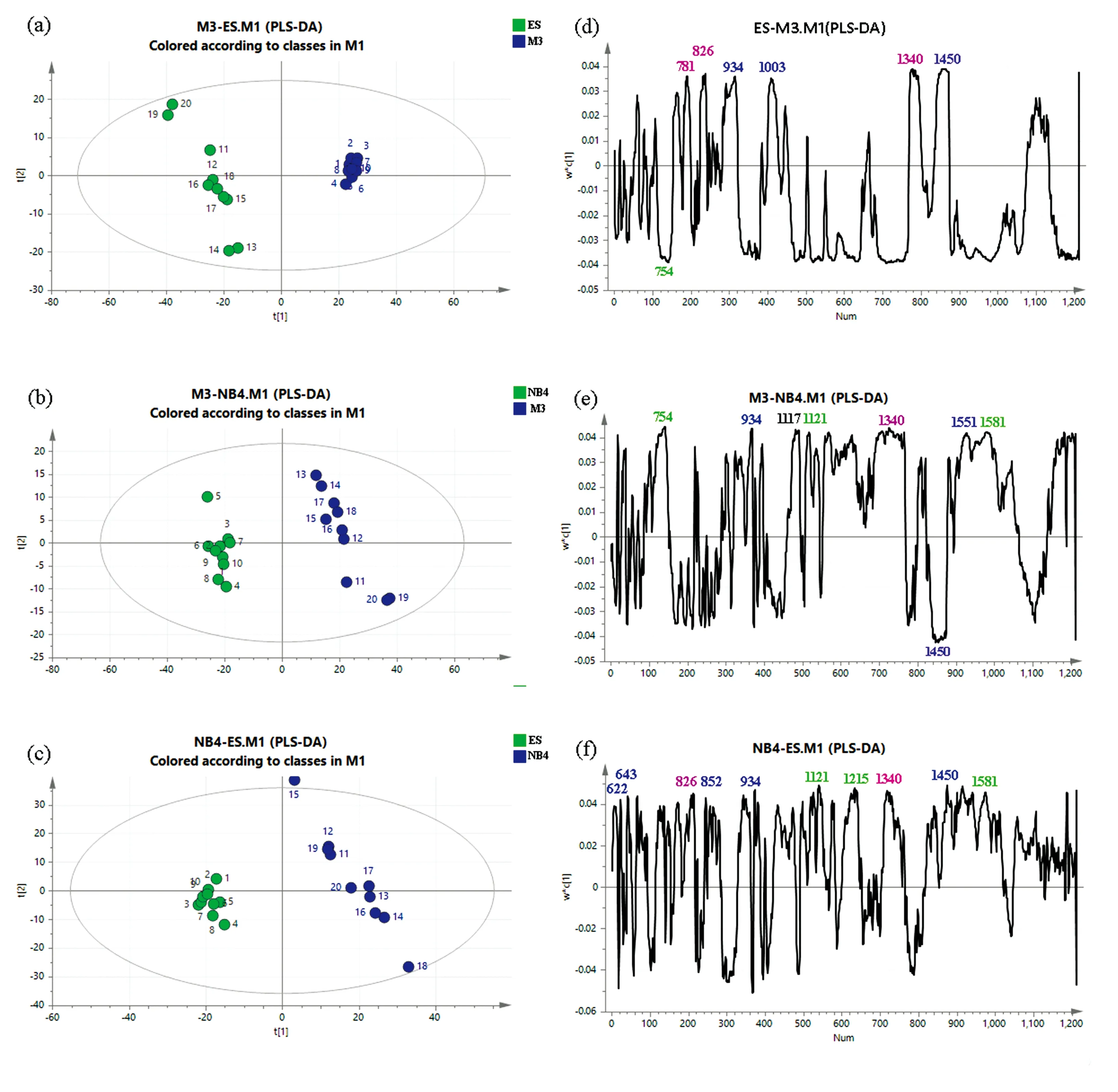
图7 三种细胞两两组合PLS-DA模型中的分类散点图和潜在变量负荷
显微拉曼光谱技术与PCA-DFA、系统聚类、PLS-DA等分析方法相结合,不仅可以识别胚胎干细胞和急性早幼粒细胞白血病细胞内化学成分的差别,并可以根据这些差异鉴别处于不同分化阶段的白血病相关细胞,探索细胞命运,具有广阔的科学研究价值。
