GSK3β对食管癌KYSE450细胞迁移、侵袭和克隆增殖方面调控作用的研究
2020-01-07刘怡文孔金玉高社干
原 翔,刘怡文,孙 蔚,孔金玉,张 灏,高社干
食管癌是我国常见的恶性肿瘤之一,每年发病人数约22万,死亡人数约19万[1]。其中90% 以上为食管鳞癌(esophageal squamous cell carcinoma,ESCC)[2],河南省林州市、辉县、安阳等地是我国食管癌发病率和死亡率最高的地区[3]。多数患者确诊时已属晚期或伴有远处转移,预后极差,5 a生存率极低[4]。目前,虽然对食管癌治疗方面的研究已取得了很大进展,但仍没有有效的治疗方法。多年来,学者们一直致力于食管癌分子靶向治疗研究,以预测其发生、发展、转移及预后情况。
糖原合成酶激酶(glycogen synthase kinase 3,GSK3)是一个广泛表达的丝氨酸/苏氨酸激酶,包括GSK3α和GSK3β两种亚型。二者具有85%的同源性,催化结构域具有93%同源性,但在哺乳动物中执行不同的功能[3]。GSK3β是多种信号转导通路中的关键激酶之一,主要参与慢性炎症的调控,并与多种肿瘤的发生发展密切相关[4-15]。本研究采用Wound-healing、Transwell、平板克隆形成实验等方法检测GSK3β对食管癌KYSE450细胞恶性生物学行为的影响,并分析其调控作用及意义,为食管鳞癌的分子靶向治疗提供新的靶点和思路,现报道如下。
1 材料与方法
1.1 材料及主要试剂食管癌KYSE450细胞系(上海博古生物细胞所);RPMI-1640培养基、胎牛血清(美国Gibco公司);胰酶、青链霉素(中国索莱宝公司);慢病毒包装试剂盒(美国selleck公司)。
1.2 细胞系培养常规细胞系培养:食管癌KYSE450细胞系,用含有10%胎牛血清的RPMI-1640完全培养基,于37 ℃、5%CO2的培养箱中常规培养;2~3 d换液、传代1次,取对数生长期细胞进行后续实验。
1.3 慢病毒载体包装常规培养293T细胞,密度至50%~60%时,开始转染。配制“DNA质粒-EndoFectin”混合物,室温放置30 min。将混合物加入293T细胞,5%CO2、37 ℃恒温箱孵育8~14 h,向培养基中加入1/500体积的“Titer Boost”。分别于48、96 h收获病毒,将细胞上清至0.45 μm滤器去除细胞碎片,取上清(立即进行感染)。将目的细胞铺板,待密度长至50%~60%时,直接加入含病毒的培养基进行转染。转染病毒后,每天在荧光显微镜下观察信号。待视野中大部分细胞都带有荧光时,用嘌呤霉素或潮霉素进行筛选。提取细胞蛋白质,通过Western blot检测转染效率。
1.4 Western blot方法检测GSK3β蛋白敲降效率将对数生长期的KYSE450细胞消化下来后,分成两组,即450-GFP(对照组)与450-1(GSK3β敲降组)应用慢病毒包装试剂盒进行GSK3β蛋白敲降处理,并筛选稳定细胞系。然后将两组细胞提取新鲜蛋白质,进行Western blot检测GSK3β的表达。具体步骤为:提取细胞蛋白质后,用BCA法进行蛋白质定量(康为公司)。用10%SDS-PAGE凝胶进行上层胶恒压90 V 30 min,下层胶恒压120 V 60 min电泳,切胶后采用“三明治夹心法”,恒压90 V 150 min转膜,5% 脱脂奶粉封闭PVDF膜1 h,TBST 清洗1次,每次30 s,加入GSK3β兔一抗(1∶1 000,Abcam)和内参GAPDH(1∶2 000,康为公司)4 ℃过夜,TBST清洗3次,每次5 min,加入兔二抗(1∶2 000,康为公司)室温孵育2 h,再用TBST漂洗3次,每次5 min,采用ECL(美国Invitrogen公司)检测目的蛋白条带,凝胶成像系统(美国BIO-RAD公司)采集图像并进行定量分析。
1.5 细胞功能学实验①通过Wound-healing实验比较各组细胞不同时间点迁移面积的大小。将对数生长期的细胞经胰蛋白酶消化后制成5×103·mL-1的单细胞悬液,分为两组,450-GFP(对照组)与450-1(GSK3β敲降组),分别于0 h和24 h对同一位置细胞拍照,比较两组细胞24 h迁移面积。应用Image J软件测量不同时间点划痕内空白面积的大小,并用以下公式计算迁移面积:迁移面积(n h)=空白面积(0 h)-空白面积(n h),进而比较各组细胞不同时间点迁移面积的大小,采用t检验,分析各组之间差异,检测肿瘤细胞的体外迁移能力。②通过Transwell实验比较各组细胞降解基质,向深层侵袭的数量。实验分为450-GFP(对照组)与450-1(GSK3β敲降组),每组铺2个平行对照,分别于16 h和24 h固定1组细胞拍照并计数穿过下层胶细胞数量,采用t检验,分析各组之间差异,检测肿瘤细胞的体外侵袭能力。③通过平板克隆形成实验检测细胞形成单克隆的数量。实验分为450-GFP(对照组)与450-1(GSK3β敲降组),设置两个细胞铺板密度,分别于6孔板中铺入500个细胞和1 000个细胞,采用t检验,分析各组之间差异,检测肿瘤细胞的体外增殖及克隆形成能力。
1.6 统计学处理运用SPSS 23.0对数据进行统计学处理。Wound-healing、Transwell、平板克隆形成实验结果分析采用配对样本t检验。以GrapPad Prism5.0统计绘图软件处理、分析数据、绘制图形。以P<0.05为差异有统计学意义。
2 结果
2.1 Western blot方法检测GSK3β蛋白敲降效率通过Western blot检测GSK3β蛋白的表达,结果显示,450-1(GSK3β敲降组)组中GSK3β蛋白表达被显著抑制。
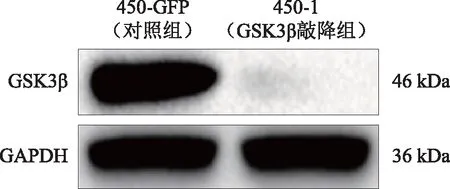
图1 Western blot显示敲降组中GSK3β蛋白表达显著被抑制
2.2 Wound-healing实验通过Wound-healing实验检测肿瘤细胞的体外迁移能力。结果显示,与450-GFP(对照组)相比,450-1(GSK3β敲降组)细胞24 h迁移面积显著变小(t=11.66,P<0.05,图2),其体外迁移能力明显减弱。
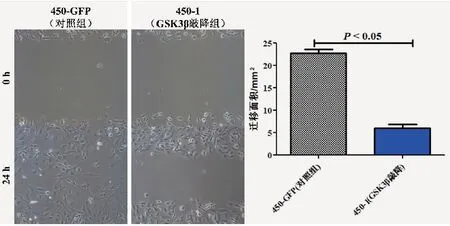
图2 GSK3β对食管癌细胞系迁移能力的影响
2.3 Transwell实验结果通过Transwell实验检测GSK3β对食管癌细胞系侵袭能力的影响,结果显示,与450-GFP(对照组)相比,450-1(GSK3β敲降组)16 h(t=3.31,P<0.05,图3)及24 h(t=4.80,P<0.05,图3)穿过下层胶细胞数目显著减少,其体外侵袭能力明显减弱。
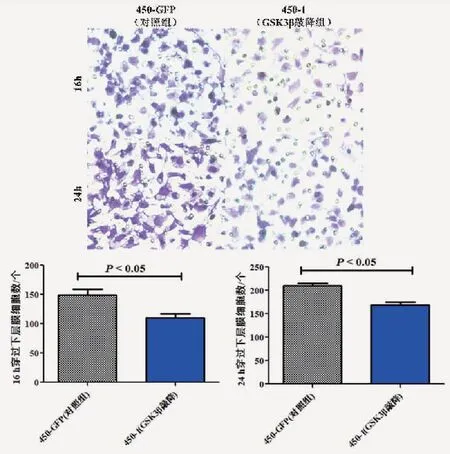
图3 GSK3β对食管癌细胞侵袭能力的影响
2.4 平板克隆实验结果采用平板克隆实验检测GSK3β对食管癌细胞系体外克隆增殖能力的影响,结果显示,与450-GFP(对照组)相比, 450-1(GSK3β敲降组)500个细胞(t=8.69,P<0.05,图4)和1 000个细胞(t=6.85,P<0.05,图4)的细胞克隆数均显著减少,其细胞克隆增殖能力明显减弱。
3 讨论
GSK3β是多功能丝氨酸/苏氨酸蛋白激酶的一种,不仅可通过抑制磷酸化糖原合酶的活性升高机体血糖浓度,还可通过调控多种转录因子的活性/稳定性(如AP-1、NF-κB、c-Myc、β-catenin、P53和STATs)而参与多种肿瘤相关病理过程,包括细胞增生、分化、迁移、凋亡、黏附及产生炎症因子等。因此,GSK3β与多种肿瘤的发生发展关系密切。然而,GSK3β在肿瘤发生及演进过程中的作用,目前报道不一。在骨肉瘤、肝癌、卵巢癌、结直肠癌、胰腺癌、白血病等肿瘤中能够促进肿瘤发生发展,而在肺癌、口腔癌、皮肤癌、乳腺癌中,则可抑制肿瘤恶性进展[5-13]。
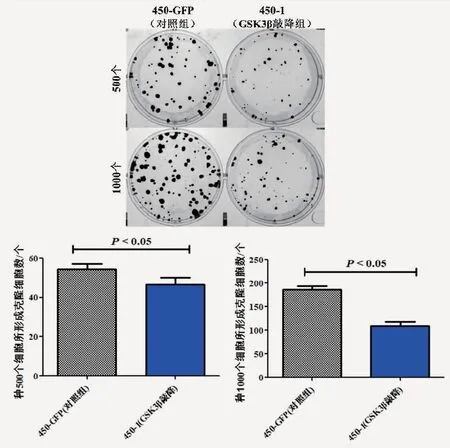
图4 GSK-3β对食管癌细胞系克隆增殖能力的影响
本研究通过Wound-healing、Transwell、平板克隆形成实验等方法检测GSK3β对食管癌KYSE450细胞恶性生物学行为的影响,发现在食管癌KYSE450细胞系中,对GSK3β进行下调时,其迁移、侵袭及克隆增殖方面恶性生物学行为显著减弱,差异有统计学意义(P<0.05)。Li RL等[14]检测GSK3β在前列腺癌中的表达,发现GSK3β表达与前列腺癌临床病理分期、Gleason评分及淋巴结转移显著相关,表明GSK3β高表达与前列腺癌侵袭转移及恶性进展相关。周晓波等[15]检测GSK3β在正常食管上皮及食管癌组织中的表达,发现GSK3β在食管癌组织中表达明显升高,并与淋巴结转移显著相关,提示GSK3β高表达与食管癌侵袭转移及恶性进展相关。上述两项研究均与本研究结果有一致性,即GSK3β高表达可显著促进肿瘤迁移、侵袭等方面恶性生物学进展。但本研究更深入探讨了敲降GSK3β后,食管癌细胞KYSE450体外迁移、侵袭及克隆增殖方面恶性生物学行为显著减弱,更明确了GSK3β可能为食管癌治疗的潜在分子靶点。
综上所述,本研究发现在食管癌细胞KYSE450中,对GSK3β进行下调时,其迁移、侵袭及克隆增殖方面恶性生物学行为均显著减弱。抑制GSK3β的表达能显著抑制食管癌细胞的恶性生物学行为,提示GSK3β可能成为食管癌治疗的新指标,并为食管癌的治疗提供新的靶点。
