贝伐单抗联合顺铂治疗复发性脑胶质瘤的疗效研究
2020-01-07王亮高本林刘南
王亮, 高本林, 刘南
恶性脑胶质瘤的主要病理类型包括间变星形细胞瘤、胶质母细胞瘤、间变少突星形细胞瘤、间变少突细胞瘤等,约50%的成人原发性恶性脑肿瘤为恶性脑胶质瘤[1]。患者主要表现出恶心呕吐、头痛、视力障碍等颅高压症状,部分患者还存在癫痫发作、精神改变和局灶性神经症状等[2]。恶性脑胶质瘤进展迅速,死亡率较高,临床中多给予患者保存神经功能的手术切除治疗,术后辅助局部放疗,可有效提高患者生存期[3]。但由于其恶性程度较高、呈浸润性生长,且具有较强的侵袭性,仅通过手术切除无法彻底清除肿瘤细胞,因而术后患者极易复发[4]。复发性恶性脑胶质瘤患者预后较差,已有研究指出其中位生存期较难超过9个月[5],因此临床中需要进一步改善复发性恶性脑胶质瘤患者的临床疗效。顺铂是传统的临床神经肿瘤化疗药物,在体内溶解后可与细胞核内DNA的碱基相结合,造成DNA损伤,破坏DNA的转录和复制,抑制蛋白质和RNA的形成,单药治疗复发性恶性脑胶质瘤的临床疗效可达30%[6]。贝伐单抗为人源性血管内皮细胞生长因子受体(vascular endothelial growth factor receptor,VEGFR)单克隆抗体的一种,具有较好的抗肿瘤血管生成作用,可阻断下游传导通路,降低肿瘤新生血管的生成量,进而抑制肿瘤生长,临床中已广泛用于肺癌和直肠癌患者的治疗中[7]。本研究就贝伐单抗联合顺铂治疗复发性恶性脑胶质瘤的疗效进行了探究。现分析报道如下。
1 资料与方法
1.1 一般资料 选取2013年1月至2018年1月期间德州市第二人民医院收治的112例复发性恶性脑胶质瘤为研究对象。依据随机数字表分为对照组(n=56)和观察组(n=56)。对照组男36例,女20例;年龄65~85岁,平均(76.67±4.38)岁;27例多形性胶质母细胞瘤,15例间变性星形细胞瘤,12例Ⅱ~Ⅲ级星形细胞瘤,2例间变性少突胶质细胞瘤;其中13例患者行肿瘤全切除,22例行部分切除,21例未行二次手术。观察组男33例,女23例;年为62~87岁,平均(78.81±4.92)岁;24例多形性胶质母细胞瘤,17例间变性星形细胞瘤,13例Ⅱ~Ⅲ级星形细胞瘤、2例间变性少突胶质细胞瘤;其中15例患者行肿瘤全切除,24例行部分切除,17例未行二次手术。纳入标准:①经临床诊断为复发性恶性脑胶质瘤患者;② 年龄≥18周岁者;③首次肿瘤复发者。排除标准:① 肝肾功能和血常规异常者;② 合并严重心脑血管疾病者;③ 凝血功能障碍者;④ 存在血栓栓塞病史者;⑤ 预计生存期<2个月;⑥ 严重精神疾病或认知功能障碍者。两组患者的年龄、性别等资料比较差异不具有统计学意义(P>0.05)。研究方案经本院医学伦理委员会批准,患者及家属均签署知情同意书。
1.2 方法 对照组:给予顺铂治疗。每日静脉滴注30 mg/m2顺铂(南京制药厂有限公司,H20030675),且每天静脉滴注0.9%氯化钠溶液100 ml+5 mg盐酸托烷司琼注射液(太极集团四川太极制药有限公司,H20090021),日补液量≥2 500 ml,静脉滴注5%碳酸氢钠溶液250 ml,每日1次碱化治疗,用药期间和用药后1 d静脉滴注20%甘露醇(四川太平洋药业有限责任公司,H20103199)125 ml,共治疗3个月。
观察组:在对照组患者治疗的基础上联合静脉滴注贝伐单抗(美国罗氏制药国际集团公司)治疗。每两周用药一次,每次剂量为10 mg/kg,初次静脉滴注需连续输注90~120 min,若耐受良好,第二次输注可连续输注60~90 min,若耐受良好,以后输注可为连续输注30~60 min。
1.3 观察指标 通过电话、微信、门诊等方式对患者进行随访,治疗后随访10个月。比较两组患者的临床疗效、生存状况、生活质量评分和不良反应发生情况。① 临床疗效:治疗后病灶体积增大>25%或出现新病灶为进展;治疗后病情无显著改善,病灶体积缩小<50%或增大<25%为稳定;治疗后病灶体积持续1个月以上缩小>50%为部分缓解;治疗后持续1个月以上病灶基本消失且临床症状完全消失为完全缓解。总有效率=完全缓解率+部分缓解率+稳定率;② 生存状况:随访并记录患者疾病控制率、5个月生存率和10个月生存率。疾病控制为治疗后获得缓解和病变稳定的病例;③ 生活质量评分:采用生活质量指数问卷进行评定。问卷包括健康状况、情感较色、机体疼痛、心理职能、躯体较色、躯体功能、生命力、社会功能8个条目的相关内容,每项评定的分数均使用Liket-3级评分,将每项的分数均转换为0~100分,分数越高说明生活质量越佳;④ 不良反应:记录并比较高血压、发热与感染、乏力、贫血、白细胞下降、恶心与呕吐、鼻出血的发生率。
1.4 统计学方法 采用SPSS20.0软件对数据进行统计学分析,计量资料和计数资料分别采用t检验和χ2检验,生存率比较采用Kaplan-Meier检验,以P<0.05为差异统计学具有意义。
2 结果
2.1 临床疗效比较 治疗总有效率观察组(87.50%)高于对照组(67.86%),差异统计学具有意义(P<0.05)。见表1。
2.2 生存状况比较 治疗后随访10个月,观察组患者的控制率、5个月生存率和10个月生存率分别为98.21%、89.29%和83.93%,高于对照组患者的66.07%、66.07%和55.36%,差异具有统计学意义(P<0.05)。见表2。
2.3 生活质量评分比较 治疗后较治疗前两组患者的生活质量各项评分均改善,且观察组优于对照组,差异统计学具有意义(P<0.05)。见表3。
2.4 不良反应比较 不良反应总发生率观察组(32.15%)与对照组(35.71%)比较差异无统计学意义(P>0.05)。见表4。
3 讨论
恶性脑胶质瘤是一种恶性程度较高的颅内占位性脑肿瘤,病情进展快、病情重、预后差、复发率高,复发率几乎高达100%,且复发后脑胶质瘤预后极差[8]。再手术治疗仅适用于一般状况较佳、肿瘤体积适中、肿瘤未处于非功能区,且复发与首次手术间隔较长的患者,对于部分一般情况较差、肿瘤体积较大、肿瘤处于功能区,且复发间隔较短的患者来说,再手术治疗的临床疗效相对较差[9]。部分学者认为再程放疗会造成正常脑组织损伤,尤其是部分患者肿瘤复发在首次照射野范围内,随着受照射剂量的逐渐增加,患者多发放射性脑水肿和脑坏死,且正常脑组织耐受剂量有限,若肿瘤复发在延髓和脑干附近,治疗难度显著增加[10]。因此临床中目前多给予复发性恶性脑胶质瘤患者化疗治疗,常用的化疗药物为细胞周期非特异性的铂类药物,在患者能够忍受的毒性限度内,随着剂量的增加其杀伤能力逐步提高[11]。但单纯使用铂类药物治疗的临床有效率仍<50%,因而部分学者以期通过联合用药改善临床疗效,提高患者生存率[6]
表1 临床疗效比较[n(%)]

分组完全缓解部分缓解稳定进展总有效率 观察组(n=56)19(33.93)25(44.64)5(8.93)7(12.50)48(87.50) 对照组(n=56)7(12.50)18(32.14)13(23.22)18(32.14)38(67.86)
注:两组治疗总有效率比较,χ2=6.791,P=0.023
表2 生存状况比较[n(%)]
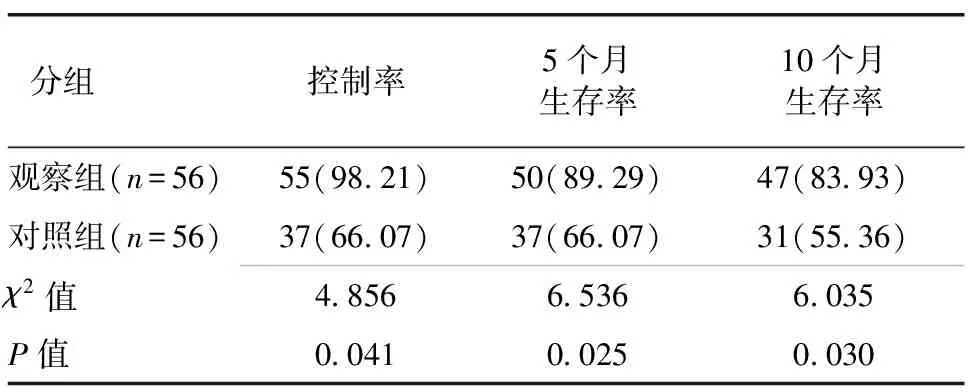
分组控制率5个月生存率10个月生存率 观察组(n=56)55(98.21)50(89.29)47(83.93) 对照组(n=56)37(66.07)37(66.07)31(55.36) χ2值4.8566.5366.035 P值0.0410.0250.030
表3 生活质量评分比较(分)
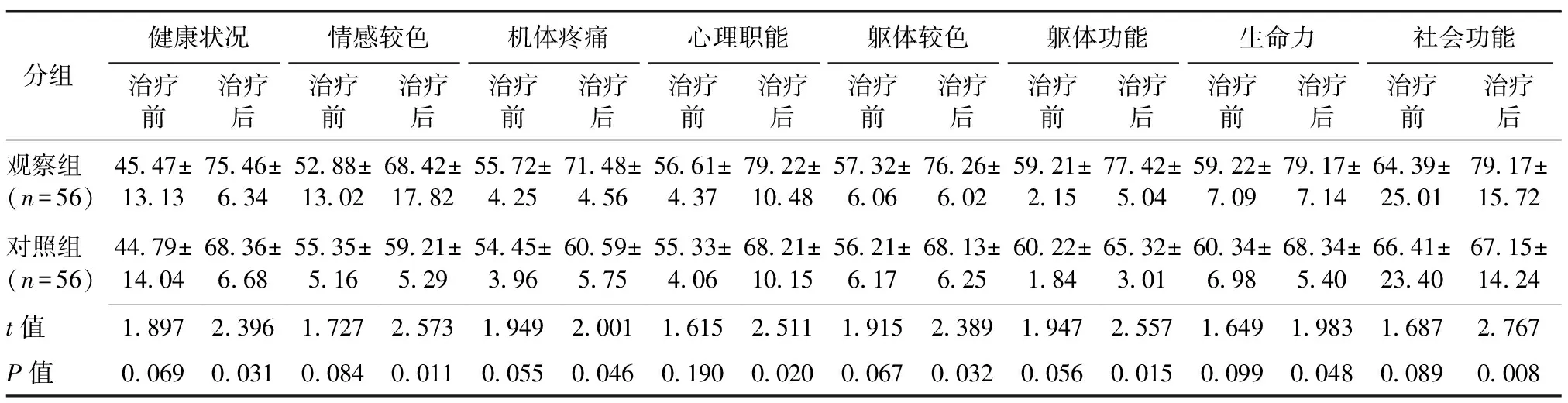
分组健康状况情感较色机体疼痛心理职能躯体较色躯体功能生命力社会功能 治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后 观察组(n=56)45.47±13.1375.46±6.3452.88±13.0268.42±17.8255.72±4.2571.48±4.5656.61±4.3779.22±10.4857.32±6.0676.26±6.0259.21±2.1577.42±5.0459.22±7.0979.17±7.1464.39±25.0179.17±15.72 对照组(n=56)44.79±14.0468.36±6.6855.35±5.1659.21±5.2954.45±3.9660.59±5.7555.33±4.0668.21±10.1556.21±6.1768.13±6.2560.22±1.8465.32±3.0160.34±6.9868.34±5.4066.41±23.4067.15±14.24 t值1.8972.3961.7272.5731.9492.0011.6152.5111.9152.3891.9472.5571.6491.9831.6872.767 P值0.0690.0310.0840.0110.0550.0460.1900.0200.0670.0320.0560.0150.0990.0480.0890.008

表4 不良反应比较[n(%)]
注:两组不良反应总发生率比较,χ2=8.427,P=0.007。
患者使用顺铂注射液后,顺铂作为铂的金属络合物在癌细胞内逐渐水化成反式并水解,形成DNA蛋白质交联,在DNA中形成链间和链内交联,通过修复这些交联细胞能够促使DNA断裂,干扰癌细胞DNA复制,促进癌细胞死亡[12]。本研究结果显示,观察组的治疗总有效率(87.50%)高于对照组的(67.86%);治疗后随访10个月,观察组患者的控制率、5个月生存率和10个月生存率分别为98.21%、89.29%和83.93%,高于对照组患者的66.07%、66.07%和55.36%,差异统计学具有意义(P<0.05)。这是由于观察组患者在给予顺铂注射液治疗的基础上联合贝伐单抗治疗。血管内皮生长因子(vasculoar endothelial growth factor,VEGF)为肿瘤血管生成中重要的生理和病理调控因子,恶性脑胶质瘤实质上属于VEGF过度表达的肿瘤,贝伐单抗为人源性VEGFR单克隆抗体,能够与特异性靶向受体结合,进而阻断VEGF的生物学效应,使VEGFR络氨酸激酶无法磷酸化,阻止其继发的下游信号传导通路[13]。而这个下游传导通路能够对血管内皮细胞产生刺激,促使其活化并引出促有丝分裂信号,促进生成肿瘤血管,建立新的血管网。但恶性脑胶质瘤患者体内肿瘤细胞处于持续增殖的状态,为了获得足量的营养和氧供给,肿瘤、内皮、基质细胞会释放出大量促血管生成因子,促进肿瘤血管增殖[14]。在这一过程中观察组患者经贝伐单抗治疗即可阻断脑胶质瘤中VEGF的生物学效应,促使现存的肿瘤血管系统退化,进而改善肿瘤血管通透性,影响心血管生长,控制肿瘤生长[15]。因此治疗后较治疗前两组患者的生活质量各项评分均改善,但观察组优于对照组,差异统计学具有意义(P<0.05)。观察组患者经贝伐单抗联合顺铂治疗后临床疗效显著改善,疾病控制率和生存率较高,无论是生理还是心理均产生了积极的变化,因而患者生活质量得到显著提高。同时,观察组的不良反应总发生率(32.15%)与对照组的(35.71%)比较差异无统计学意义(P>0.05)。这一结果提示我们,观察组患者联合贝伐单抗治疗并未增大不良反应发生率,贝伐单抗常见并发症为高血压和鼻出血,这两者的发生率也未见明显增高,说明其具有较佳的安全性。同时两组患者均未出现严重并发症,患者可自行缓解,或经临床治疗后可缓解,并未对后续治疗产生严重影响。但临床随访结果显示,虽给予复发性恶性脑胶质瘤贝伐单抗联合顺铂治疗较单纯给予顺铂治疗能够提高短期生存率,但对于长期生存率并无显著提升,考虑本研究所选取研究对象较少,随访时间较短,并未能显示出其在长期生存率方面的优势,应扩大研究对象,延长随访时间,进一步进行探究。
综上所述,给予复发性恶性脑胶质瘤患者贝伐单抗联合顺铂治疗较单纯给予顺铂治疗能够有效改善其临床疗效,生活质量,提高生存率,且无明显不良反应。
