模拟盐度变化对人工湿地脱氮除磷效果的影响①
2020-01-06赵林丽姜小三邵学新陆琳莹陶吉兴
赵林丽,姜小三,邵学新,吴 明,陆琳莹,陶吉兴
模拟盐度变化对人工湿地脱氮除磷效果的影响①
赵林丽1,2,姜小三1,4*,邵学新2,吴 明2,陆琳莹2,陶吉兴3*
(1 南京农业大学资源与环境科学学院,南京 210095;2 中国林业科学院亚热带林业研究所,浙江富阳 311400;3 浙江省森林资源监测中心,杭州 3100200;南京农业大学泰州研究院,江苏泰州 225311)
为探究人工湿地处理含盐生活废水的可行性,本研究构建了小尺度的人工湿地模拟系统,比较了不同盐度(0.0%、0.5%、1.0%、1.5%、2.0%)下人工湿地芦苇的生长情况以及几种典型污染物的去除效果。结果表明:①盐度对人工湿地中芦苇生长的影响表现出“低盐促进”、“高盐抑制”的特点,在0.5% 进水盐度下,芦苇有最高株高1.22 m和最大基径0.48 cm;②人工湿地对COD的去除率总体表现为随盐度的升高先升高后降低,在盐度为0.5%时,COD去除率达到最高84.86%;③当进水盐度为0.5% 时,人工湿地对氮磷的去除几乎没有受到盐度的抑制;当进水盐度高于1.0%,随着盐度的升高,TN(总氮)、NH4+-N、NO– 3-N、TP(总磷)的去除率均显著降低(<0.05),在2.0% 盐度下分别下降到了44.40%、58.89%、49.23%、49.49%,相较0.0% 盐度时分别降低了38.5%、23.4%、23.8%、19.2%。④不同污染物受盐分抑制程度不同,氮比磷更容易受到盐分的抑制,NH4+-N比NO– 3-N更容易受到盐分的抑制。
人工湿地;盐度;COD;氮;磷
随着我国沿海城市水资源短缺形势的加剧,海水代用大生活用水技术逐渐受到人们的重视,随之而来的含盐废水的处理成为了当前急迫的研究课题。目前常用的处理方法包括离子交换法、SBR、A2/O法等[1-3]对含盐废水均有一定的处理效果,但因投资运行费用较高或处理能力不稳定而难以在实际生产过程中推广应用。
人工湿地作为一种生态、高效的净化技术,为含盐废水的处理提供了新的选择。近十几年,国内外学者已开始尝试采用人工湿地对含盐废水进行处理[4-6],但含盐废水来源广泛,目前对含盐污水的研究主要集中在海水养殖用水、制革厂废水、纺织厂废水等方面,针对海水代用大生活用水所产生的含盐生活污水的处理研究还鲜有报道。由于不同来源的含盐废水在组成和浓度上均存在差异,导致人工湿地对其处理能力也会不同。因此,本研究构建了小尺度的人工湿地模拟系统,通过比较不同盐度(0.0%、0.5%、1.0%、1.5%、2.0%)进水下人工湿地芦苇的生长指标及有机物、氮、磷的去除效果来探讨利用人工湿地处理海水代用大生活用水所产生的含盐废水的可行性。
1 材料与方法
1.1 试验装置与基质
试验场地设在中国林科院亚热带林业研究所内虎山生态学试验基地,如图1所示,试验装置为高60 cm,内径25 cm 的PVC 特制盆钵,底部为出水口。盆钵由下往上分别填充5 cm 厚的砾石层(粒径8 ~ 16 mm)、10 cm 厚的无烟煤层(粒径4 ~ 8 mm),25 cm 厚的沸石层(粒径2 ~ 4 mm)以及10 cm 厚的土壤层。
1.2 试验设计与进水
试验供试植物为耐盐性较好的芦苇,在2017年4月于杭州湾围垦区芦苇湿地挖取长势相近的植株进行移栽,每盆移栽8株,种植密度为163株/m2。芦苇移入盆钵后先用虎山试验基地的池塘水(水质情况见表1)调试培育一段时间,在植株高度为60 cm 左右时开始试验。
试验所用含盐生活污水参考了冯华军等[7]对浙江大学华家池校区家属区化粪池出水的调查结果,由虎山试验基质的池塘水加入葡萄糖、硫酸铵、磷酸二氢钾、硝酸钙和不同比例的海盐配制而成(表1)。进水盐度分别控制为原污水盐度0.0%、0.5%、1.0%、1.5% 和2.0%。采用间歇进水方式运行,每隔3 d 进一次水,一次进水12 L,依靠重力作用漫流入人工湿地,使污水正好能没过沸石层而不超过土壤层,水力停留时间为3 d,水力负荷为0.08 m3/(m2·d)。
试验以阶段提高盐度的方法逐渐提高污水中的盐度:在1 ~ 6 d,15个盆钵中均注入未添加海盐的生活污水;在7 ~ 12 d,除0.0% 组,其他4个试验组均注入盐度为0.5% 的生活污水;以此类推,直到第25 天,5个试验组中分别注入0.0%、0.5%、1.0%、1.5% 和2.0% 的生活污水,运行2周进入稳定状态,之后的1个月每隔3 d 采集水样,测定COD、TN、NO– 3-N、NH4+-N、TP。试验结束,收割芦苇,测定株高和基径(量取离根部约15 cm 处的径粗作为芦苇的基径)。

表1 试验用水及进水水质(mg/L)
1.3 指标测定与统计分析
试验过程中的主要水质监测项目为COD、TN、NO– 3- N、NH4+-N、TP,分别采用重铬酸钾法(GB 11914—1989)、过硫酸钾氧化分光光度法(GB/T 11894)、紫外分光光度法(GB 7480—1987)、纳氏试剂分光光度法(GB/T 7479)和钼锑抗分光光度法(GB/T 11893)进行测定[8]。
使用Microsoft Excel 2010和SPSS 20.0对数据进行统计分析和绘图,对不同进水盐度下的芦苇生长指标数据和水质数据分别进行 LSD 法显著性检验(< 0.05)和 Duncan多重比较(= 0.05)。
2 结果与分析
2.1 不同盐度下芦苇的株高和基径变化
从表2可知,芦苇在0.0%、0.5%、1.0% 盐度进水下均有小苗长出,且长势较好,株高总体在1.00 m以上,基径总体在0.4 cm以上;当盐度超过1.5%,芦苇叶片变小、发黄,且植株较为矮小和纤细。
多重比较结果表明,不同盐度下芦苇的株高和基径均存在显著性差异(<0.05)。随着盐度的升高,芦苇的株高和基径均表现出先升高再降低的趋势。当进水盐度为0.5% 时,芦苇平均株高达到最高1.22 m,相较0.0% 盐度下升高了14.0%;当进水盐度分别为1.0%、1.5%、2.0% 时芦苇生长受到抑制,株高相较于0.0% 盐度下分别降低了7.7%、26.6%、37.5%。芦苇的平均基径在进水盐度为0.5% 时也最大,达到了0.48 cm,相较0.0% 盐度下升高了6.4%;在1.0%、1.5%、2.0% 盐度下的芦苇基径相较0.0% 盐度水平下分别降低了12.8%、27.4%、38.5%。
2.2 不同盐度下人工湿地有机物及氮、磷去除率的变化
表3结果显示,在低盐度下,人工湿地对污水中几种典型污染物均有较高的去除率。当进水盐度为0.0%,人工湿地对COD、TN、NH4+-N、NO– 3-N、TP的去除率分别为72.13%、72.19%、76.90%、64.60%、61.24%。随着盐度的升高,人工湿地对不同污染物的去除能力受到的抑制程度有所不同。
多重比较结果显示,不同盐度下人工湿地对COD的去除率之间均存在显著性差异(<0.05),总体表现为随盐度的升高先升高后降低;当进水盐度为0.5% 时,人工湿地对COD去除率达到最高84.86%,相较0.0% 盐度时升高了17.6%;当进水盐度为1.0%、1.5%、2.0% 时,COD去除率分别为63.11%、51.18%、47.46%,相较0.0% 盐度时分别降低了12.5%、29.0%、34.2%。
当进水盐度升高为0.5% 时,人工湿地对氮的去除几乎没有受到盐分的影响,去除率之间不存在显著差异(>0.05),其中TN、NO– 3-N的去除率相较0.0% 盐度下有所升高,说明轻微的盐度刺激可以提高人工湿地对TN、NO– 3-N的去除率,但升高幅度不明显;当盐度升高到1.0% 时,TN、NH4+-N、NO– 3-N去除率均明显降低,分别为62.83%、71.31%、61.05%,相较0.0% 进水盐度下分别降低了13.0%、7.3%、1.6%,说明在1.0% 的进水盐度下人工湿地中TN、NH4+-N、NO– 3-N的去除均表现出了较为明显的抑制作用,其中NO– 3-N的去除率下降幅度很小,可以判断出,其受到的盐胁迫相较NH4+-N小一点;当进水盐度为2.0% 时,氮素的去除作用受到了明显的抑制,TN、NH4+-N、NO– 3-N的去除率分别下降到了44.40%、58.89% 和49.23%,相较0.0% 进水盐度下分别降低了38.5%、23.4%、23.8%。

表2 不同盐度下芦苇的株高和基径
注:表中数据为平均值±标准差;同列数据小写字母不同表示Duncan多重比较结果存在显著性差异(<0.05),下同。
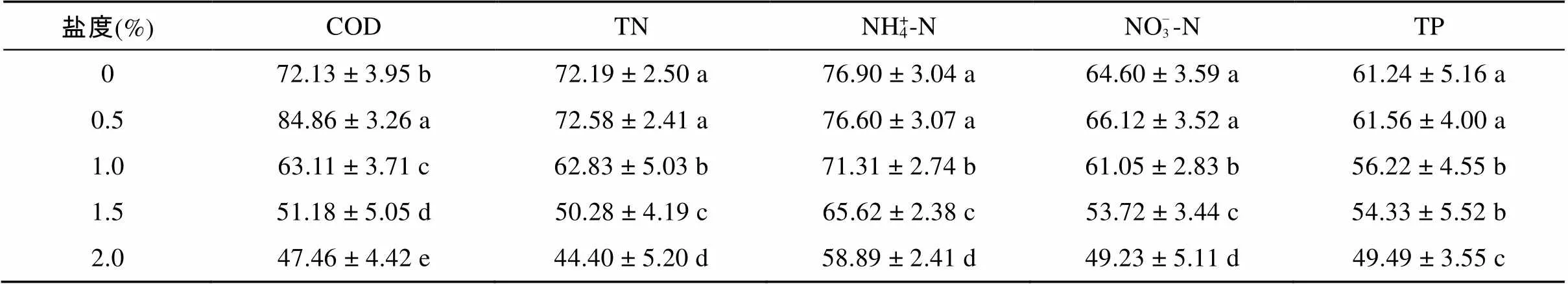
表3 不同盐度下人工湿地对污染物的去除率及水环境情况(%)
盐度对TP去除率的抑制作用表现为先增大后减弱再增大的趋势。当进水盐度升高为0.5%时,人工湿地对磷的去除几乎没有受到影响,甚至有轻微的升高;当盐度升高到1.0% 时,TP去除率降低为56.22%,相较0.0% 进水盐度下降低了8.2%,说明此时盐度对人工湿地中磷的去除表现出了明显的抑制作用;在1.5% 进水盐度下,TP去除率相较1.0% 盐度时不存在显著性的差异(>0.05),说明此时盐度对TP去除的抑制作用反而有所减弱;当进水盐度为2.0% 时,人工湿地对TP的去除率下降到了49.49%,相较1.5% 盐度时降低了8.9%,相较0.0% 盐度时降低了19.2%。
3 讨论
3.1 盐度变化对芦苇生长的影响
本研究发现,盐度对芦苇生长的影响表现出“低盐促进”和“高盐抑制”的特点,这与目前大多数的研究结果一致。陈友媛等[9]发现,轻微的盐度刺激下(盐度为0.5%)芦苇的株高净增长和含水量均会升高,但随着盐度继续升高,芦苇植物受到盐胁迫的影响,其株高和含水量均随盐分的升高逐渐降低。程宪伟等[10]分别比较了0.0、2.7、4.7、6.7 和 9.5 g/L盐度下芦苇的株高增长率,发现芦苇的株高增长率随着盐度升高先增大后减小,在盐度为2.7 g/L时株高增长率最高。戚志伟[11]的研究也发现,芦苇株高随着土壤电导率的增加呈现出先升高后降低的趋势。
盐度是影响湿地植物生长、分布和繁殖的重要环境因子。有研究表明[12],环境中过量的Na+、Cl–会对湿地植物吸收K+、Ca2+等有益元素起到干扰作用。本研究选用的芦苇植株均采自杭州湾滨海芦苇湿地,由于滨海湿地所处地理位置特殊,长期受到海水的影响,其土壤以盐土类的滨海盐土亚类和潮土化盐土为主[13],使得芦苇植株本身具有一定的耐盐性,能够在盐度较高的环境中正常生长和代谢,因此,在试验进水盐度较低时,芦苇植株对盐分和盐分提高带来的高渗透压具有一定的抵抗能力。轻微盐度刺激下芦苇株高和生物量反而增加可能是因为芦苇受盐胁迫时可以通过调整生物量分配模式来适应高盐环境。Mauchamp和Mésleard[14]研究了芦苇对盐分的耐受响应,发现芦苇在受盐胁迫时生物量分配模式会发生改变,其地上部分尤其是茎的生物量分配比例会增加,而地下部分的比例将会减少。Naidoo和Kift[15]研究也发现,在受盐胁迫死亡的植物的茎中Na+浓度要明显高于其他的器官。当盐度≥1.5%,芦苇长势变差,说明此时盐分升高带来的渗透胁迫、离子毒害等可能抑制了芦苇植物的生理过程如呼吸作用、光合作用、脂类代谢、蛋白质合成等[16],进而对芦苇植株的生长起到了明显的抑制作用。
3.2 盐度变化对人工湿地COD去除的影响
人工湿地中有机物的去除方式主要为湿地微生物的好氧降解与厌氧降解作用,除此之外,植物的吸收作用也能去除一部分外界环境中的有机物质。本研究中,不同进水盐度下芦苇人工湿地系统对COD的去除率之间均存在显著性差异(<0.05),总体表现为随盐度的升高呈现出先升高后降低的规律。这与高锋等[17]的研究结果不一致。高锋等[17]探究了盐分对人工湿地净化污水效果的影响,发现随着盐度的升高,COD去除率呈现出逐渐下降的趋势。
当进水盐度为0.5% 时,盐分促进了芦苇植株的生长,进而促进了芦苇对污水中有机物的吸收作用。笔者猜测,轻微的盐度可能刺激了植物和微生物的抗盐反应,使其通过增强呼吸作用以分解有机物获得更多的能量来抵抗盐胁迫产生的高渗透压,从而导致系统COD去除率有所升高。当进水盐度超过0.5%,COD去除率是逐渐降低的,这是由于盐分对芦苇产生了胁迫作用,抑制了芦苇的生长代谢作用从而减少了植物对污水中有机物的吸收;同时,盐分的升高导致的环境渗透压升高、离子毒害作用等对湿地微生物也产生了影响,从而破坏了湿地系统中有机污染物的降解过程。
3.3 盐度对人工湿地氮素去除的影响
本研究中,当进水盐度低于0.5% 时,人工湿地对氮素的去除几乎没有受到盐度的抑制,相反,TN和NO– 3-N的去除率有所升高,这与芦苇的生长指标所表现的“低盐促进”、“高盐抑制”的规律一致。湿地植物在生长代谢过程中能够吸收污水中的氮素[18-19],同时根系能够释放分泌物,提供氧气[20]和表面附着位点来间接促进硝化和反硝化微生物类群的活性[21]。微生物的硝化和反硝化作用是人工湿地氮去除的主要机制,占总去除氮量的比例为60% ~ 90%[22-23]。因此,低盐度对芦苇生长的促进作用也间接提高了人工湿地系统中氮素的去除率。
当进水盐度大于1.0% 时,随着盐度的升高,TN、NH4+-N、NO– 3-N的去除率均显著降低,但降低的幅度不一致,分别为13.0%、7.3%、1.6%,TN和NH4+-N的去除相较NO– 3-N受到盐度的抑制作用更明显。这与以往的研究结果一致。Dincer 和 Kargi[24]的研究发现,盐分浓度为NaCl 10 g/L时开始对硝化反应产生抑制,且亚硝酸盐氧化率比好氧氨氧化率降低程度更大。蔡舰等[25]比较了0.5%和1.0% 盐度下芦苇湿地的脱氮效率,发现TN和NH4+-N的去除率均受到了显著的抑制,但NO– 3-N的出水浓度没有明显变化。这是由不同功能的微生物群落在盐度的胁迫下有不同的响应机制和耐受范围导致的。微生物的硝化和反硝化作用是人工湿地脱氮的主要途径,硝化反应是硝化菌在好氧条件下将铵氮氧化为亚硝酸盐氮,再将亚硝酸盐进一步氧化为硝酸盐的过程;反硝化反应是反硝化菌利用碳源作为电子供体将亚硝氮和硝氮还原为氮气的过程,涉及的微生物包括反硝化菌(氨氧化细菌、亚硝酸盐氧化菌)和反硝化菌。Liu等[26]在用序批式反应器处理含盐废水时发现,当盐浓度 > NaCl 20 g/L时,亚硝酸盐氧化菌(NOB)存活率 < 1%,好氧氨氧化细菌(AOB)的存活率仅下降了50%,说明硝化过程中NOB比AOB对盐分更敏感,从而导致了好氧氨氧化和亚硝酸盐氧化过程的分化。此外,Panswad和Anan[27]比较了不同种类微生物的抗盐冲击能力,发现反硝化菌的抗盐冲击能力优于硝化菌。因此,在低盐度进水下,亚硝酸盐氧化菌首先受到盐度的抑制,使亚硝酸盐的氧化受阻,人工湿地中亚硝酸盐的积累导致TN去除率下降;随着盐度的升高,好氧氨氧化细菌也逐渐受到了盐分的抑制,导致出水中NH4+-N浓度逐渐升高,NH4+-N去除率显著降低;反硝化菌的抗盐性最好,但在高盐度下其活性也会受到盐度的影响,导致NO– 3-N去除率的降低。
3.4 盐度对人工湿地磷素去除的影响
本研究中,不同盐度下人工湿地对TP的去除率在49.49% ~ 61.24%,相较氮素,磷的去除受进水盐度的影响较小,这与前人的研究结果一致。高锋等[28]研究发现,不同盐度下芦苇人工湿地的TP去除率在38.2% ~ 46.5% 之间,受盐度的抑制作用较小。王巧芳[29]比较了潜流人工湿地对含盐污水的净化效果,发现0.5%、1.0% 盐度下TP去除率分别为57.80% 和52.07%。但孙萍[30]的研究结果显示,水培试验系统中芦苇的TP去除率随盐度升高显著降低,说明基质对人工湿地磷素的去除起着关键的作用。人工湿地中磷的去除是在基质吸附[31]、过滤,化学沉淀作用,植物体的吸收[32]以及微生物的同化[33]等多种途径的协同作用下除去的。Reddy等[34]的研究发现,基质吸附沉淀作用除去的磷约为总去除磷量的7% ~ 87%,是人工湿地中磷去除的主要途径。基质中的Ca2+、Mg2+、Al3+、Fe3+等金属离子、金属氧化物和氢氧化物以及黏土矿物可与可溶性无机磷酸盐发生吸附沉淀反应或配位体交换作用[35],几乎不受盐浓度的抑制作用影响。因此,在不同盐度进水下人工湿地对磷素的去除效果相对较为稳定,盐度人工湿地除磷造成的部分影响主要是通过影响植物吸收和微生物的同化作用来实现的。
在进水盐度为0.5% 时,人工湿地的TP去除率为61.56%,相较0.0% 盐度时升高了0.5%,这可能是由于低盐度刺激了芦苇生长,促进了其对污水中磷素的吸收,从而提高了人工湿地的除磷效果。但植物吸收作用除去的磷占总去除磷量的比例很小[36],出水中TP去除率的提高并不明显。
当进水盐度为1.0% 时,芦苇长势良好,相较0.0% 盐度下株高和基径的变化幅度不大,但人工湿地的TP去除率明显降低至56.22%,相较0.0% 盐度时降低了8.2%,可以判断出,此时TP去除率的降低是由于除磷微生物受到了盐度的抑制。微生物对磷的去除机制主要是聚磷菌对磷的过量积累[37-38]。聚磷菌在好氧条件下不断地分解自身以及外界的有机物以获得能量,这个过程中,其能将大部分来自于外界环境的磷酸盐合成ATP,从而去除水中的磷。Panswad和Anan[27]的研究发现,聚磷菌对盐分具有强烈的敏感性,相较硝化细菌更容易受到盐分的抑制,因此1.0% 的盐度对聚磷菌已经产生了胁迫作用。当进水盐度为1.5% 时,湿地出水中TP去除率为54.33%,相较1.0% 盐度时的去除率无显著差异(>0.05),但在进水盐度为2.0% 时,试验出水中磷酸盐浓度又有明显的升高,导致TP去除率降低至49.49%。产生这种现象的原因可能是由于大部分聚磷菌在1.0% 盐度下已失去活性,因而随着盐度的升高,TP去除率的下降幅度反而降低,在2.0% 进水盐度下,聚磷菌体内的ATP水解,将磷酸盐重新释放到了水中。
4 结论
1)盐度对人工湿地中芦苇生长的影响表现出“低盐促进”、“高盐抑制”的特点,在进水盐度为0.5% 时,芦苇有最高株高1.22 m和最大基径0.48 cm。
2)不同进水盐浓度下芦苇人工湿地对COD的去除率均存在显著性差异(<0.05),总体表现为随盐度的升高先升高后降低,在进水盐度为0.5% 时,人工湿地系统COD去除率达到最大。
3)人工湿地对TN、NH4+-N、NO– 3-N、TP的去除率在0.5% 的进水盐度下分别为72.58%、76.60%、66.12%、61.56%,与0.0% 盐度时相比不存在显著差异(>0.05);当进水盐度超过1.0%,盐分对氮磷的去除效果均有明显的抑制作用;在2.0% 盐度下,TN、NH4+-N、NO– 3-N、TP去除率分别下降到了44.40%、58.89%、49.23%、49.49%,相较0.0% 盐度时分别降低了38.5%、23.4%、23.8%、19.2%。
4)在相同进水盐度下,不同污染物受盐分的抑制程度不同,氮比磷更容易受到盐分的抑制,NH4+-N比NO– 3-N更容易受到盐分的抑制。
[1] Víctor-Ortega M D, Ochando-Pulido J M, Martínez-Ferez A. Impacts of integrated strong-acid cation exchange and weak-base anion exchange process for successful removal of saline toxicity from model olive mill wastewater[J]. Ecological Engineering, 2015, 77: 18–25
[2] Zhan P, Chen J, He G, et al. Microbial dynamics in a sequencing batch reactor treating alkaline peroxide mechanical pulp and paper process wastewater[J]. Environmental Science & Pollution Research, 2010, 17(9): 1599–1605
[3] Aloui F, Khoufi S, Loukil S, et al. Performances of an activated sludge process for the treatment of fish processing saline wastewater[J]. Desalination, 2009, 246(1): 389–396
[4] Saeed T, Sun G. A lab-scale study of constructed wetlands with sugarcane bagasse and sand media for the treatment of textile wastewater[J]. Bioresource Technology, 2013, 128(1): 438–447
[5] Arivoli A, Mohanraj R, Seenivasan R. Application of vertical flow constructed wetland in treatment of heavy metals from pulp and paper industry wastewater[J]. Environmental Science & Pollution Research International, 2015, 22(17): 13336–13343
[6] Sansanayuth P, Phadungchep A, Ngammontha S, et al. Shrimp pond effluent: Pollution problems and treatment by constructed wetlands[J]. Water Science & Technology, 1996, 34(11): 93–98
[7] 冯华军, 冯小晏, 薛飞, 等. 浙江省典型地区生活污水水质调查研究[J]. 科技通报, 2011, 27(3): 436–440
[8] 国家环境保护总局. 水和废水监测分析方法[M]. 4 版. 北京: 中国环境科学出版社, 2009: 210–257
[9] 陈友媛, 孙萍, 陈广琳, 等. 滨海区芦苇和香蒲耐盐碱性及除氮磷效果对比研究[J]. 环境科学, 2015, 36(4): 1489–1496
[10] 程宪伟, 梁银秀, 祝惠, 等. 六种植物对盐胁迫的响应及脱盐潜力水培实验研究[J]. 湿地科学, 2017, 15(4): 635–640
[11] 戚志伟. 崇明东滩滨海围垦湿地芦苇光合和生长对土壤水盐因子的响应[D]. 上海: 华东师范大学, 2017
[12] 秦娟娟. 人工湿地填料对含盐污水中污染物吸附性能研究[D]. 青岛: 中国海洋大学, 2014
[13] 王蒙, 吴明, 邵学新, 等. 杭州湾滨海湿地CH4排放通量的研究[J]. 土壤, 2014, 46(6): 1003–1009
[14] Mauchamp A, Mésleard F. Salt tolerance in Phragmites australis, populations from coastal Mediterranean marshes[J]. Aquatic Botany, 2001, 70(1): 39–52
[15] Naidoo G, Kift J. Responses of the saltmarsh rush Juncus kraussii, to salinity and waterlogging[J]. Aquatic Botany, 2006, 84(3): 217–225
[16] 李峰, 谢永宏, 覃盈盈. 盐胁迫条件下湿地植物的适应策略[J]. 生态学杂志, 2009, 28(2): 314–321
[17] 高锋, 杨朝晖, 李晨, 等. 人工湿地处理含盐生活污水的特性研究[J]. 环境科学, 2012, 33(11): 3820– 3825
[18] Tanner C C. Growth and nutrient dynamics of soft-stem bulrush in constructed wetlands treating nutrient-rich wastewaters[J]. Wetlands Ecology & Management, 2001, 9(1): 49–73
[19] Ouyang Y, Luo S M, Cui L H. Estimation of nitrogen dynamics in a vertical-flow constructed wetland[J]. Ecological Engineering, 2011, 37(3): 453–459
[20] Armstrong W, Cousins D, Armstrong J, et al. Oxygen distribution in wetland plant roots and permeability barriers to gas-exchange with the rhizosphere: A microelectrode and modelling study with phragmites australis[J]. Annals of Botany, 2000, 86(3): 687–703
[21] Tanner C C. Growth and nutrient dynamics of soft-stem bulrush in constructed wetlands treating nutrient-rich wastewaters[J]. Wetlands Ecology & Management, 2001, 9(1): 49–73
[22] Truu M, Juhanson J, Truu J. Microbial biomass, activity and community composition in constructed wetlands[J]. Science of the Total Environment, 2009, 407(13): 3958– 3971
[23] Faulwetter J L, Gagnon V, Sundberg C, et alMicrobial processes influencing performance of treatment wetlands: A review[J]. Ecological Engineering, 2009, 35(6): 987– 1004
[24] Dinçer A R, Kargi F. Salt inhibition of nitrification and denitrification in saline wastewater[J]. Environmental Technology Letters, 1999, 20(11): 1147–1153
[25] 蔡舰, 巴图那生, 娜仁格日乐, 等. 盐度对芦苇(Phragmitesaustralls)表流湿地除氮效果的影响[J]. 湖泊科学, 2017, 29(6): 1350–1358
[26] Liu Y, Peng C Y, Bing T, et al. Determination effect of influent salinity and inhibition time on partial nitrification in a sequencing batch reactor treating saline sewage[J]. Desalination, 2009, 246(1): 556–566
[27] Panswad T, Anan C. Impact of high chloride wastewater on an anaerobic/anoxic/aerobic process with and without inoculation of chloride acclimated seeds[J]. Water Research, 1999, 33(5): 1165–1172
[28] 高锋, 杨朝晖, 李晨, 等. 人工湿地处理含盐生活污水的特性研究[J]. 环境科学, 2012, 33(11): 3820–3825
[29] 王巧芳. 进水NaCl浓度对3种植物生长及湿地污水净化效果的影响[D]. 兰州: 甘肃农业大学, 2017
[30] 孙萍. 滨海重盐碱区几种水培植物的耐盐碱性及其净化氮磷效果的研究[D]. 青岛: 中国海洋大学, 2015
[31] 王万宾, 胡飞, 孔令瑜, 等. 人工湿地脱氮除磷基质的吸附能力及其影响因子[J]. 湿地科学, 2016, 14(1): 122–128
[32] Richardson C J. Mechanisms controlling phosphorus retention capacity in freshwater wetlands[J]. Science, 1985, 228(4706): 1424–1427
[33] Sun W, Zhao H, Wang F, et al. Effect of salinity on nitrogen and phosphorus removal pathways in a hydroponic micro-ecosystem planted with Lythrum salicaria, L[J]. Ecological Engineering, 2017, 105: 205–210
[34] Reddy K R, Connor G A O, Gale P M. Phosphorus sorption capacities of wetland soils and stream sediments impacted by dairy effluent[J]. Journal of Environmental Quality, 1998, 27(2): 438–447
[35] 汤显强, 黄岁樑. 人工湿地去污机理及其国内外应用现状[J]. 水处理技术, 2007, 33(2): 9–13
[36] Kadlec R H. Large constructed wetlands for phosphorus control: A Review[J]. Water, 2016, 8(6): 243
[37] 张玲, 彭党聪, 常蝶. 温度对聚磷菌活性及基质竞争的影响[J]. 环境科学, 2017, 38(6): 2429–2434
[38] 朱德锐, 贲亚琍, 韩睿, 等. 聚磷菌生物除磷机理研究进展[J]. 环境科学与技术, 2008, 31(5): 62–65
Effects of Simulated Salinity Change on Nitrogen and Phosphorus Removal in Constructed Wetland
ZHAO Linli1,2, JIANG Xiaosan1,4*, SHAO Xuexin2, WU Ming2, LU Linying2, TAO Jixing3*
(1 College of Resources and Environmental Sciences, Nanjing Agricultural University, Nanjing 210095, China; 2 Research Institute of Subtropical Forestry, Chinese Academy of Forestry, Fuyang, Zhejiang 311400, China; 3 Center for Forest Resource Monitoring of Zhejiang Province, Hangzhou 310020, China; 4 Taizhou Academy, Nanjing AgriculturalUniversity, Taizhou, Jiangsu 210095, China)
In order to explore the feasibility of treating saline wastewater in constructed wetlands, a lab-scale constructed wetland was built to compare the removal effects of several typical pollutants under different salinities (0, 0.5%, 1.0%, 1.5%, 2.0%). The results showed that: 1) The effects of salinity on the growth ofin constructed wetlands showed the characteristics of “low salt promoting” and “high salt inhibiting”. Under 0.5% influent salinity, the reed had the highest plant height (1.22 m) and the maximum basal diameter (0.48 cm); 2) The removal rate of COD in constructed wetlands was generally increased first and then decreased with the increase of salinity. When the salinity was 0.5%, COD removal rate reached a maximum (84.86%). 3) Under 0.5% influent salinity, the removal of nitrogen and phosphorus from the constructed wetland were almost not inhibited by salt; when the influent salinity was higher than 1.0%, the removal of TN, NH4+-N, NO– 3-N, and TP all decreased significantly (<0.05) with the increase of salinity. Under 2.0% salinity, the removal of TN, NH4+-N, NO– 3-N, and TP dropped to 44.40%, 58.89%, 49.23% and 49.49% respectively, compared with 0.0% salinity, decreased by 38.5%, 23.4%, 23.8% and 19.2%, respectively. 4) Under the same influent salinity, different pollutants were inhibited by different salt levels. Nitrogen is more easily inhibited by salt than phosphorus. NH4+-N is more easily inhibited by salt than NO– 3-N.
Constructed wetland; Salinity; COD; Nitrogen; Phosphorus
浙江省科技计划项目(2015C32011)、浙江省–中国林科院合作林业科技项目(2015SY01)和国家林业公益性行业科研专项(201404305)资助。
xsjiang@163.com;taojixing@126.com)
赵林丽(1993—),女,浙江嵊州人,硕士研究生,研究方向为土壤学和湿地生态学。E-mail: 545948585@qq.com
X52
A
10.13758/j.cnki.tr.2019.06.011
