溴鼠灵对斑马鱼的急性毒性效应研究
2020-01-04王帅应剑波王斌杰王继业姚伟宣吴元钊
王帅 应剑波 王斌杰 王继业 姚伟宣 吴元钊

摘要 [目的]研究溴鼠灵对斑马鱼的生态毒性效应。[方法] 在2 h内将受精后6 d的斑马鱼幼鱼暴露在不同浓度的溴鼠灵溶液中,计算溴鼠灵对斑马鱼幼鱼的半数致死浓度,并记录染毒后斑马鱼的运动轨迹。[结果] 2 h内溴鼠灵对斑马鱼幼鱼的半数致死浓度(LC50)可达13.51 mg/L,表明溴鼠灵对斑马鱼幼鱼具有显著的急性毒性作用。光暗交替环境刺激下,随着溴鼠灵浓度的升高,对斑马鱼幼鱼的平均运动速度、加速度的抑制作用愈加显著。当药物浓度低于1.00 mg/L时,各试验组斑马鱼幼鱼的运动行为均未出现异常,当试验进行至60 min,10.00、50.00和100.00 mg/L浓度组斑马鱼幼鱼的运动能力显著下降。随着药物浓度的升高,斑马鱼幼鱼对强光刺激的应激反应受到显著抑制,100.00 mg/L浓度组斑马鱼幼鱼基本失去应激能力。[结论] 溴鼠灵在2 h内对斑马鱼幼鱼具有显著的急性毒性作用,能够显著抑制其运动行为。
关键词 溴鼠灵;急性毒性;斑马鱼;运动行为
中图分类号 X503.225文献标识码 A文章编号 0517-6611(2020)24-0102-05
doi:10.3969/j.issn.0517-6611.2020.24.028
开放科学(资源服务)标识码(OSID):
Study on Acute Toxicity of Brodifacoum to Danio rerio
WANG Shuai1, YING Jianbo2, WANG Binjie1 et al
(1.Zhejiang Police College, Key Laboratory of Drug Prevention and Control Technology of Zhejiang Province, Hangzhou,Zhejiang 310051; 2. Institute of Criminal Science and Technology Public Security Bureau of Hangzhou, Hangzhou,Zhejiang 310004)
Abstract [Objective] To investigate the ecotoxicological effects of brodifacoum on Danio rerio. [Method] The larvae of D. rerio were exposed to brodifacoum solution at different concentrations within 2 hours. The median lethal concentration of brodifacoum to D. reriolarvae was calculated, and the locomotor behavior of zebrafish after exposure was recorded. [Result] LC50 of brodifacoum to zebrafish larvae was 13.51 mg/L within 2 hours, which indicated that brodifacoum had significant toxicity to D. rerio larvae. Under the conditions of light dark alternation, with the increase of brodifacoum concentration, the inhibition of the average velocity and acceleration of D. rerio larvae gradually increased. When the concentration of brodifacoum was lower than 1.00 mg/L, there was no abnormal behavior of D. rerio in each experimental group, but the motor behavior of D. rerio decreased significantly in the concentration groups of 10.00,50.00 and 100.00 mg/L(P < 0.05)when the experiment lasted for 60 minutes.Moreover, with the increase of brodifacoum concentration, the stress response of D. rerio larvae to the strong light stimulation was significantly inhibited, and D. rerio in 100.00 mg/L treatment group almost lost the stress ability. [Conclusion]Brodifacoum had significant acute toxic effect on D. rerio larvae within 2 hours, and it could significantly inhibit the motor behavior.
Key words Brodifacoum;Acute toxicity;D. rerio;Motion behavior
近年来,毒鼠强、氟乙酰胺等急性强效杀鼠剂逐渐被禁用,目前较常见的杀鼠剂主要是第二类抗凝血杀鼠剂。与第一类抗凝血类杀鼠剂相比,第二代抗凝血殺鼠剂的毒性更强,毒力持续时间长,因此在农业生产中得到了广泛使用[1-2]。此类杀鼠剂的大量使用可能导致部分药物残留进入土壤、水体等环境中,引发水资源污染、食品污染等一系列问题,进而危害水生生物甚至人类的生命健康[3]。以溴鼠灵为代表的第二代抗凝血类杀鼠剂对环境造成的污染问题越来越严重,也逐渐引起人们的重视。茅海琼等[4]首次研究溴鼠灵在水环境突发性污染事故中的痕量残留,采用超高效液相色谱串联质谱法进行检测,其检出限可达0.08 μg/L。宓捷波等[5]建立了蔬菜及水果中溴鼠灵高效液相色谱-质谱分析方法,检出限可达0.5 μg/kg。
溴鼠灵(brodifacoum)又称大隆、溴鼠隆,是第二类抗凝血杀鼠剂的典型代表,也是目前应用最广泛的杀鼠剂,其中文名称为3-[3-(4′-溴联苯-4-基)-1,2,3,4-四氢-1-萘
基]-4-羟基香豆素,属于4-羟基香豆素类衍生物杀鼠剂[6]。与其他抗凝血类杀鼠剂作用机制类似,当溴鼠灵进入机体后,阻碍肝脏合成凝血酶原及一些凝血因子在肝脏的合成,造成各个脏器及黏膜大量出血而死亡[7-8]。由于使用不当、误食而引起的抗凝血类杀鼠剂的中毒事件屡见报道[9-10],在国内甚至出现了利用抗凝血类杀鼠剂进行投毒的案件[11]。目前,针对溴鼠灵等抗凝血类杀鼠剂的研究主要集中在中毒案例的救治[12-13]、生物样品中药物的检测等领域[3,14-15],目前尚缺乏能在短时间内实现对溴鼠灵等抗凝血类杀鼠剂的快速、有效且准确的检测方法。因此,有必要开发高效、快速、灵敏的针对溴鼠灵急性毒性检测手段,为及时、有效地预防和预警此类事件提供必要的技术支持和数据支撑。
斑马鱼(Danio rerio)是近年来新兴的模式动物,其基因与人类具有80%以上的高度同源性,并且具有成本低、通量高、试验周期短、灵敏度高、毒性生理指标丰富等优点[16],被国际经济合作组织(Organization for Economic Cooperation and Development,OECD)列为实验室测试的推荐实验物种。我国也出台了《水质物质对淡水鱼(斑马鱼)急性毒性测定方法》将斑马鱼应用于水质检测。目前,国内外越来越多的学者以斑马鱼为模型开展药物筛选[17-18]、化合物毒性评估[19-20]、环境监测[21-22]等领域的研究。Rihel等[23]首次利用斑马鱼模型的行为学参数实现了神经毒性化合物的筛查,在对明暗交替环境刺激模式下的斑马鱼运动行为参数分析后,从5 648个化合物中筛选出对斑马鱼有神经毒性的化合物547个。笔者以斑马鱼为实验动物,研究2 h内溴鼠灵暴露对斑马鱼幼鱼的急性毒性以及溴鼠灵对斑马鱼幼鱼运动行为的影响,建立短时间内溴鼠灵斑马鱼的中毒模型,以期为短时间内溴鼠灵毒性评估提供试验数据和理论依据。
1 材料与方法
1.1 主要材料
试验所用的亲代斑马鱼均购自中国科学院水生生物研究所国家斑马鱼资源中心,自繁的第一代用于试验,在自动水循环养殖系统中进行养殖,水环境电导率400~540 μS/cm,pH 7.0~7.6,水温(28.0±0.5)℃。鱼缸和过滤垫每周清理1次,去除粪便,饲养光周期控制光暗比为14∶10。每天10∶00和15∶00分别投喂鲜活丰年虾饵料1次。
E3培养液的配制:分别称取NaCl 17.2 g、KCl 0.76 g、CaCl2 2.91 g、MgSO4·7H2O 4.9 g,用双蒸水溶解后配制成1 L的E3培养液。常用试剂购自国药集团化学试剂有限公司,4 ℃ 下保存,14 d内使用。溴鼠灵标准品由杭州市公安局刑事科学技术研究所提供。因溴鼠灵微溶于水,20 ℃时在水中的溶解度仅为10 mg/L。试验前,用二甲基亚砜(DMSO)将溴鼠灵配制成母液,逐级稀释到所需试验浓度,暴露溶液均为现配现用,确保各浓度组DMSO最终体积分数小于0.5%,对照组DMSO体积分数为0.5%(经预试验可知,当DMSO体积分数为0.5%以下的处理与空白组处理无显著差异,对胚胎期斑马鱼的发育以及幼鱼的运动行为均无影响)。
主要仪器设备有Lab Tower EDI纯水系统(美国赛默飞世尔公司)、恒温培养箱(上海龙跃仪器设备有限公司)、DanioVision行为观测系统(荷兰诺达思信息技术公司)、电子分析天平(德国赛多利斯公司)、ZW-H3000体式显微镜(中国深圳中微科创公司)等。
1.2 实验动物
试验前12 h,选择6~12月龄的健康性成熟斑马鱼按照雌雄1∶2的比例放置在孵化盒中,用透明玻璃板将雌、雄斑马鱼分隔开,在黑暗安静环境下放置14 h。次日早晨,将雌、雄斑马鱼中间隔板抽离并给予光照刺激,使雌、雄斑马鱼在光照刺激下进行交配产卵,约0.5 h后收集受精卵。用 E3培养液冲洗受精卵2~3次去除杂质,6 h后在体视显微镜下观察去除未受精以及形态有缺陷的胚胎,挑选出正常发育的斑马鱼胚胎于28 ℃恒温培养箱中控光培养用于试验。
1.3 急性毒性试验
参考国际经济合作组织(OECD)鱼类急性水生毒性试验设计暴露试验,急性毒性试验采用6孔板,每孔內放置30尾6日龄(6dpf)幼鱼,每孔加注溴鼠灵溶液6 mL,溴鼠灵浓度设置为0.01、0.10、1.00、10.00、50.00、100.00 mg/L。加鱼、加药时间控制在10 min内,试验开始后记录2 h内斑马鱼幼鱼的死亡数量,根据试验需要可适当调节浓度设置,以便于计算半数致死浓度(LC50),拍照并记录染毒后幼鱼的形态变化。
1.4 运动行为试验
斑马鱼幼鱼的运动行为学试验溴鼠灵浓度设置为0.01(Ⅰ)、0.10(Ⅱ)、1.00(Ⅲ)、10.00(Ⅳ)、50.00(Ⅴ)、100.00 mg/L(Ⅵ),每个浓度组随机选择12尾6日龄斑马鱼幼鱼放入96孔板中,每孔1尾,将96孔板置于斑马鱼行为观测系统箱体内。参考Mcgrath[24]报道的采用光暗交替刺激条件,系统设置10 min光照、10 min黑暗的明暗交替模式,循环6次,共记录2 h内斑马鱼幼鱼的运动轨迹,受试鱼在试验前适应10 s。主要测试斑马鱼幼鱼在2 h内的自由运动行为。使用EthoVision XT 14软件分别记录各浓度组幼鱼的运动轨迹,计算运动的总距离、平均速度、运动热图以及各浓度组药物毒性起效时间、受强光刺激后的运动加速度等行为参数。
1.5 强光刺激应激试验
药物浓度设置、孔板选用及加药方式均与斑马鱼运动行为试验设置一致。参考文献[25]报道的强光刺激试验方法,并进行适当调整:在斑马鱼幼鱼染毒60 min 后开启强光照射刺激,采集并记录第59~61 min斑马鱼幼鱼的运动速度和加速度。
1.6 数据统计与分析
试验数据使用SPSS 23.0统计软件对浓度与致死率进行回归分析,计算出溴鼠灵对斑马鱼的半数致死浓度(LC50)以及胚胎孵化率等指标,根据单因素方差分析(ANOVA)法比较暴露组与对照组间各观测指标的差异显著性,P<0.05表示差异显著,P<0.01表示差异极显著。数据绘图均使用Origin 8.5 软件。
2 结果与分析
2.1 溴鼠灵对斑马鱼的急性毒性效应
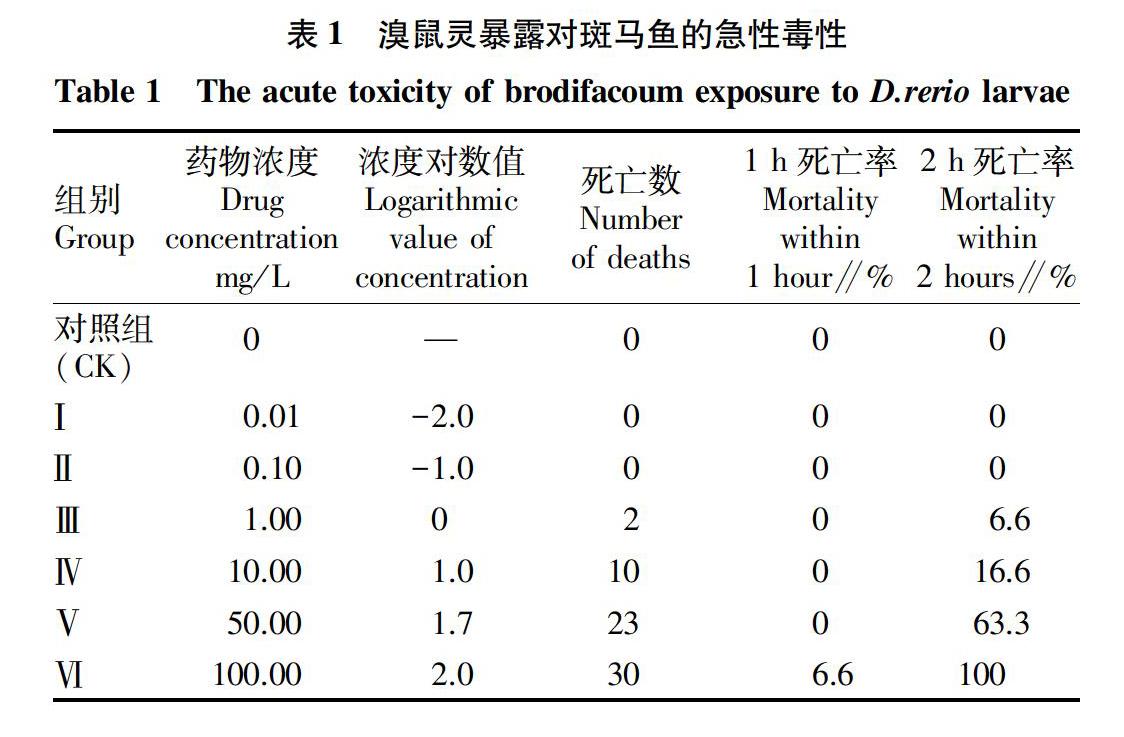
如表1所示,对照组斑马鱼幼鱼在整个试验过程中全部存活,且运动行为无异常。0.01和0.10 mg/L濃度组斑马鱼幼鱼在整个试验过程中均未出现死亡,运动行为无显著异常。1.00 mg/L浓度组斑马鱼在试验进行至92 min出现死亡,2 h最终死亡率为6.6%;10.00 mg/L浓度组斑马鱼在试验进行至74 min出现死亡,2 h最终死亡率为16.6%;50.00 mg/L浓度组斑马鱼在试验进行至62 min出现死亡,2 h最终死亡率为63.3%;100.00 mg/L 浓度组斑马鱼在试验进行至54 min出现死亡,2 h 最终死亡率为100%。根据试验数据计算可知,2 h内溴鼠灵对斑马鱼幼鱼的半数致死浓度(LC50)为13.51 mg/L。
由图1可知,相对于对照组(CK),0.01(Ⅰ)、0.10 mg/L浓度组(Ⅱ)幼鱼均保持存活,且在形态上并无明显变化,从1.00 mg/L(Ⅲ)开始,10.00(Ⅳ)、50.00(Ⅴ)和100.00 mg/L(Ⅵ)浓度组均出现死亡,随着浓度的升高,死亡幼鱼的体形轮廓逐渐不清晰,且体轴出现弯曲。
2.2 溴鼠灵暴露对斑马鱼运动行为的影响
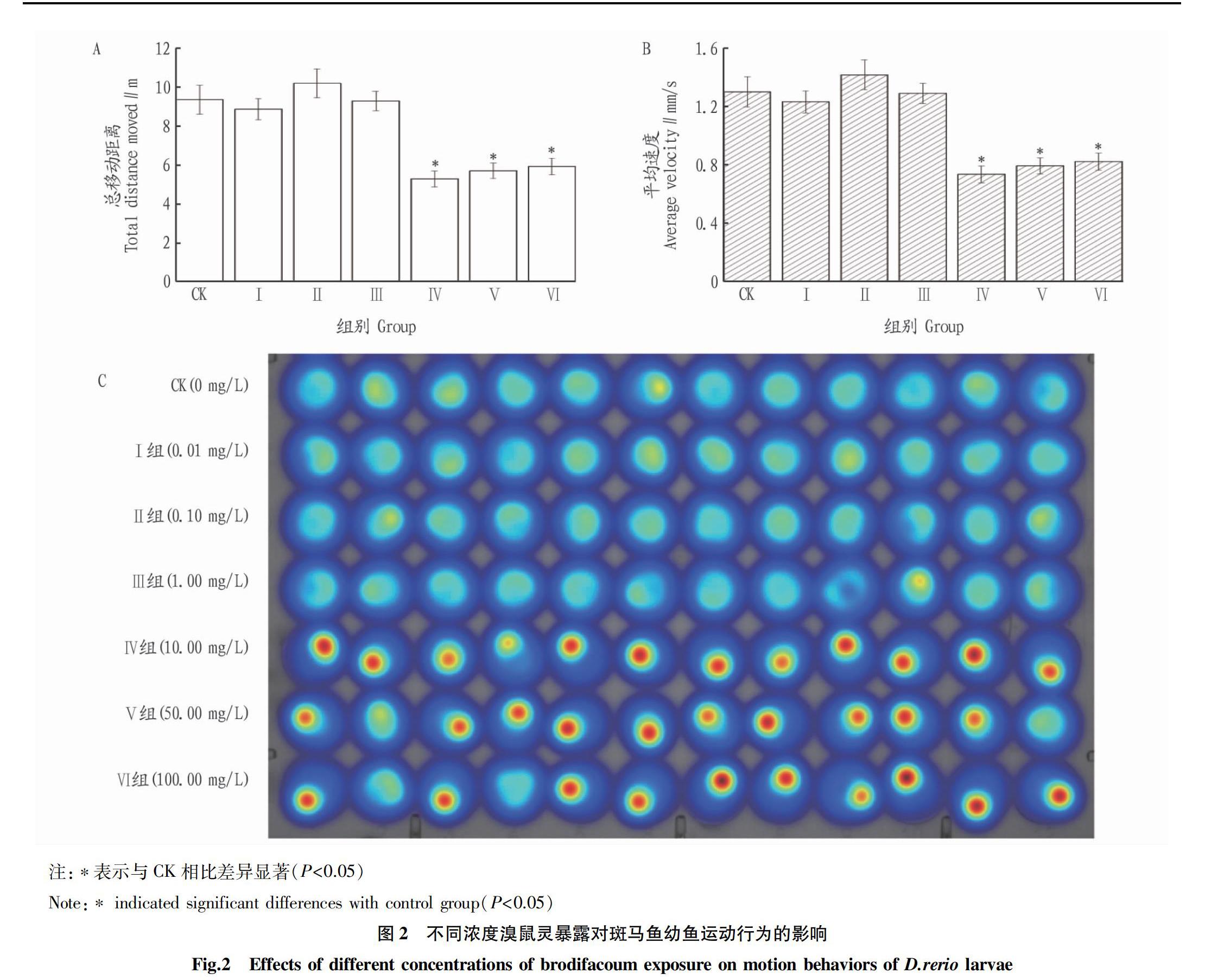
行为学测试记录了在明暗交替刺激条件下不同浓度的溴鼠灵暴露2 h后6日龄斑马鱼幼鱼的总运动距离(图2A)、运动平均速度(图2B)、运动行为热区图(图2C)。如图2所示,与对照组相比,Ⅳ、Ⅴ和Ⅵ组斑马鱼幼鱼的总移动距离、平均运动速度均显著下降(P<0.05),幼鱼的运动行为能力受到显著抑制(图2A、图2B)。在待测浓度范围内,随着溴鼠灵浓度的升高,幼鱼的总移动距离、平均运动速度总体上呈现抑制作用。值得注意的是,Ⅳ、Ⅴ和Ⅵ组斑马鱼幼鱼的移动总距离和平均速度呈现逐渐上升的趋势,这是因为在试验20 min内高浓度组斑马鱼受到溴鼠灵的刺激更为剧烈,因此总移动距离和平均速度的累积值会有一定程度的异常。图2C为斑马鱼幼鱼的运动热图。根据系统设置,幼鱼正常游动轨迹颜色设置为蓝色,随着幼鱼游动轨迹的重复,其颜色不断加深,其轨迹叠加颜色由蓝色逐渐变为黄色,运动轨迹最密集区域则显示红色。该试验结果显示,在2 h内Ⅳ、Ⅴ和Ⅵ组红色区域较为集中,说明高浓度组的斑马鱼幼鱼大部分时间停留在固定区域,高浓度溴鼠灵对斑马鱼幼鱼的行为能力具有显著的抑制作用。
为便于分析染毒时间对斑马鱼幼鱼行为运动的影响,分析了在光暗环境刺激下溴鼠灵染毒后斑马鱼幼鱼运动平均速度随时间的变化情况(图3A)以及前60 min和后60 min平均运动速度的变化情况(图3B)。如图3A所示,对照组(CK)和各浓度组斑马鱼幼鱼的运动平均速度均呈现逐渐下降趋势,其中Ⅰ组(0.01 mg/L)与Ⅱ组(0.10 mg/L)斑马鱼的运动平均速度在试验进行30 min后逐渐趋于平稳,Ⅳ、Ⅴ与Ⅵ组斑马鱼的运动平均速度呈现急剧下降趋势,并在试验进行至大约60 min后,Ⅵ组斑马鱼运动速度首先趋于0,此后Ⅳ、Ⅴ组也逐渐趋于0。为更加直观地研究药物毒性作用,分析了前60 min和后60 min斑马鱼运动平均速度的变化情况。如图3B所示,在试验开始的60 min内各浓度组斑马鱼的运动平均速度变化并不显著,但在后60 min内每个浓度组斑马鱼的运动平均速度与其前60 min相比显著下降,Ⅳ、Ⅴ与Ⅵ组斑马鱼的运动速度与前60 min相比均显著下降,且随着浓度的升高,其下降程度更加显著。
2.3 溴鼠灵暴露对斑马鱼幼鱼强光应激能力的影响
图4为59~61 min不同浓度溴鼠灵染毒对斑马鱼幼鱼强光刺激惊恐应激能力的影响。图4A显示,与59~60 min暗环境下平均速度相比,60~61 min强光刺激环境下平均速度均不同程度下降,随着药物浓度的升高,平均运动速度的下降程度逐渐降低。如图4B所示,相对于CK,Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ和Ⅵ组的运动加速度均大幅度降低,尤其是Ⅵ组其运动加速度较CK下降了600%。单位时间内的速度变化以及加速度的变化表明,斑马鱼幼鱼在强光刺激下的应激能力随着药物浓度的升高呈显著下降的趋势。
3 讨论
第二代抗凝血杀鼠剂是慢性杀鼠剂,主要通过竞争性抑制肝脏中维生素K的转化使凝血功能受损,从而达到毒杀的效果。它们对鼠的毒杀作用虽然高,但作用较为缓慢,投药后死亡高峰期在第3~5天[26]。已报道的人类抗凝血类杀鼠剂中毒案例中,中毒后出现凝血障碍临床表现出血有一定的潜伏期,延迟几小时甚至几天[27]。该研究结果显示,Ⅲ(1.00 mg/L) 组斑马鱼在试验进行至92 min出现死亡,Ⅳ(10.00 mg/L)组斑马鱼在试验进行至74 min出现死亡,Ⅴ(50.00 mg/L)组斑马鱼在试验进行至62 min出现死亡,Ⅵ(100.00 mg/L)组斑马鱼在试验进行至54 min出现死亡。该研究建立的斑马鱼中毒模型可在2 h内对溴鼠灵毒性进行应激反应,表明第二代抗凝血类杀鼠剂对斑马鱼具有显著的急性毒性,2 h内半数致死浓度(LC50)可达13.51 mg/L。相较于前期学者建立的犬类等动物的中毒模型,具有时间更短、敏感性更强等特点[28]。
模式动物的运动行为已被广泛用于测试环境化学品的神经毒性。高浓度溴鼠灵暴露会影响斑马鱼的运动总距离、平均运动速度等运动行为,并对强光刺激的逃避反应也产生一定的影响。此前未见有学者研究溴鼠灵等抗凝血类杀鼠剂对斑马鱼的运动行为产生影响的报道。逯南南等[29]研究表明绝大部分农药类化学品对鱼类具有神经毒性,当暴露浓度达到一定值时鱼类的运动行为受到明显抑制,平均运动速度等受到显著抑制。该研究将染毒后斑马鱼的行为运动能力引入急性毒性考察,在低浓度(0.01和0.10 mg/L)组斑马鱼幼鱼的运动总距离和平均运动速度与对照组相比无显著变化,而10.00、50.00和100.00 mg/L浓度组斑马鱼的运动总距离和平均运动速度及其对强光逃避的应激能力均具有显著的抑制作用。目前,关于溴鼠灵染毒后引起斑马鱼神经损伤的具体机理尚不明确,需进一步研究。
4 结论
以斑马鱼为研究对象,初步建立了短时间内溴鼠灵斑马鱼中毒模型。通过测定2 h内的LC50,评价了溴鼠灵对6日龄斑马鱼幼鱼的急性毒性,溴鼠灵短时间暴露对斑马鱼具有显著的急性毒性作用,2 h对斑马鱼幼鱼的半数致死浓度可达13.51 mg/L。溴鼠灵暴露对斑马鱼的运动总距离和平均运动速度产生显著的抑制作用,并对斑马鱼的强光逃避应激能力也具有显著的抑制作用。该研究建立了基于斑马鱼的溴鼠灵中毒模型,获取了2 h内溴鼠灵对斑马鱼幼鱼的急性毒性、平均运动距离以及对强光刺激的应激反应等指标,可为深入研究第二代抗凝血类杀鼠剂、评价溴鼠灵的急性毒性提供科学依据。
参考文献
[1] 韓奇杰,李凯平,赖跃,等.溴敌隆中毒研究进展[J].中国法医学杂志,2012,27(6):471-473.
[2] 董天义,阎丙申.抗凝血灭鼠剂研究进展[J].医学动物防制,1998,14(4):61-67.
[3] 宋薇,杨柏崇,赵永彪,等.QuEChERS-UPLC-MS/MS测定果蔬中4种残留抗凝血杀鼠剂[J].食品科学技术学报,2014,32(3):65-71.
[4] 茅海琼,应红梅,朱丽波,等.超高效液相色谱串联质谱法测定4种抗凝血灭鼠剂在水环境突发性污染事故中的痕量残留[J].分析化学,2010,38(9):1382.
[5] 宓捷波,张骏,王云凤,等.蔬菜、水果中4种抗凝血灭鼠剂残留的高效液相色谱-串联质谱法测定[J].分析测试学报,2008,27(11):1214-1216,1220.
[6] 郑卫青,陈陵,陈海婴,等.美国灭鼠剂应用概述[J].中华卫生杀虫药械,2013,19(3):255-257.
[7] 肖雪花,陈湛.薄层色谱法快速鉴定中毒样品中的敌鼠钠、溴敌隆、溴鼠隆、杀鼠迷、杀鼠灵[J].中国卫生检验杂志,2010,20(12):3203-3204.
[8] STAFFORD D W.The vitamin K cycle[J].Journal of thrombosis and haemostasis,2005,3(8):1873-1878.
[9] 肖康.466例急性农药中毒病人流行病学分析[D].衡阳:南华大学,2019.
[10] 李敏,王岩,杜艳秋.抗凝血类灭鼠药中毒20例救治及护理[J].中国工业医学杂志,2019,32(6):508-509.
[11] 汪晓华,陈晓军.溴敌隆食物中毒176例诊治分析[J].中国全科医学,2010,13(15):1674-1675.
[12] 邱男,张谦,曾德珍,等.抗凝血灭鼠药中毒救治21例分析[J].浙江临床医学,2009,11(7):714-715.
[13] 王臻,刘忠文,张茵,等.抗凝血灭鼠剂中毒导致获得性维生素K依赖性凝血因子缺乏症——46例临床分析[J].血栓与止血学,2011,17(4):166-168,182.
[14] 朱琳,向平.生物样品中抗凝血类杀鼠剂分析研究进展[J].复旦学报(医学版),2015,42(5):663-669.
[15] 王璞,周丽屏,郭嘉明,等.高效液相色谱法测定全血中5种抗凝血类灭鼠剂[J].中国职业医学,2016,43(2):210-213.
[16] MCGRATH P,LI C Q.Zebrafish:A predictive model for assessing druginduced toxicity[J].Drug discovery today,2008,13(9/10):394-401.
[17] 王成,龚莉虹,郭朝成,等.模式生物斑马鱼在中药药效物质筛选中的应用进展[J].中草药,2019,50(24):6125-6134.
[18] MORBIATO E,BILEL S,TIRRI M,et al.Potential of the zebrafish model for the forensic toxicology screening of NPS:A comparative study of the effects of APINAC and methiopropamine on the behavior of zebrafish larvae and mice[J].NeuroToxicology,2020,78:36-46.
[19] 林涛,陈燕秋,陈卫.水体中磺胺嘧啶对斑马鱼的生态毒性效应[J].安全与环境学报,2014,14(3):324-327.
[20] 贺凯宏,尚楠,陈建平,等.纳米氧化铝对斑马鱼幼鱼早期运动行为的影响[J].生态毒理学报,2018,13(3):165-171.
[21] 周斯芸,张瑛,魏倡,等.四溴双酚A对斑马鱼游动行为的毒性效应研究[J].安全与环境学报,2016,16(1):387-391.
[22] 张雅晶,缪恒锋,张晓夏,等.市政污水处理厂二级出水消毒前后对斑马鱼幼鱼的毒性[J].生态毒理学报,2018,13(5):208-217.
[23] RIHEL J,PROBER D A,ARVANITES A,et al.Zebrafish behavioral profiling links drugs to biological targets and rest/wake regulation[J].Science,2010,327(5963):348-351.
[24] MCGRATH P.Zebrafish:Methods for assessing drug safety and toxicity[M].Hoboken,NJ:John Wiley & Sons,Inc.,2011.
[25] DIPP V R,VALLES S,ORTIZKERBERTT H,et al.Neurobehavioral alterations in zebrafish due to longterm exposure to low doses of inorganic Arsenic[J].Zebrafish,2018,15(6):575-585.
[26] 熊孟韬.第二代抗凝血灭鼠剂应用概况[J].医学动物防制,2001,17(6):327-331.
[27] CARAVATI E M,ERDMAN A R,SCHARMAN E J,et al.Longacting anticoagulant rodenticide poisoning:An evidencebased consensus guideline for outofhospital management[J].Clinical toxicology,2007,45(1):1-22.
[28] 杜志国,王建琳,黄凯,等.犬抗凝血灭鼠药中毒模型的建立及犬新鲜冰冻血浆治疗效果分析[J].中国兽医杂志,2018,54(9):37-39,42.
[29] 逯南南,宋武昌,王明泉,等.马拉硫磷急性暴露对斑马鱼的行为毒性研究[J].生态毒理学报,2017,12(4):249-254.
