入侵植物紫茎泽兰对其根际重金属的富集作用研究
2020-01-04周启武杨国琴张国昌马引娟杨国恩
周启武 杨国琴 张国昌 马引娟 杨国恩

摘要 [目的]研究紫莖泽兰根际重金属元素的分布规律及富集能力,以便更好地利用紫茎泽兰资源。[方法]采用电感耦合等离子体质谱法(ICP-MS)、原子荧光光谱法(AFS)和石墨炉原子吸收分光光度法(GF-AAS)测定4种生境紫茎泽兰的茎、叶及其根际土中8种重金属含量。[结果]在全部紫茎泽兰的茎、叶及根际土中都检测到8种重金属元素,不同生境土壤重金属含量差异显著(P<0.05)且紫茎泽兰茎、叶中重金属含量随生境变化显著(P<0.05),其中Mn、Sr和Pb含量在茎、叶组织和根际土壤中含量均最高;富集作用表现为叶高于茎,且对不同重金属富集能力不同,叶对Cd、Mn、Hg、Sr、Ni显著(P<0.05),茎对Cd、Mn、As显著(P<0.05),茎和叶组织平均富集系数分布规律均为Cd>Mn>Ni>Sr>Hg>Pb>As≈Cr。[结论]紫茎泽兰对土中Cd、Mn、Hg、Sr、Ni、As有明显的富集作用且富集能力呈现选择性,因其适应能力强、生长速度快、生物量大,可作为某些重金属污染地区的一种修复植物,以实现入侵植物紫茎泽兰的利用价值。
关键词 紫茎泽兰;根际土壤;重金属元素;富集作用;植物修复
中图分类号 X173文献标识码 A
文章编号 0517-6611(2020)24-0087-04
doi:10.3969/j.issn.0517-6611.2020.24.024
开放科学(资源服务)标识码(OSID):
Study on the Bioaccumulation Ability of Eupatorium adenophorum to Heavy Metal Ions in Its Rhizosphere Soil
ZHOU Qiwu1,YANG Guoqin1,ZHANG Guochang2 et al (1.College of Biotechnology and Engineering,West Yunnan University,Lincang,Yunnan 677000; 2.Mengding Customs Integrated Technology Center,Lincang,Yunnan 677000)
Abstract [Objective]The distribution and bioaccumulation ability of heavy metals in invasive plant Eupatorium adenophorum and rhizosphere soil were studied to make better use of plant.[Method]8 kinds of heavy mentals in stems,leaves and soil from 4 habitats were measured by inductively coupled plasma mass spectrometry (ICPMS),atomic fluorescence spectroscopy (AFS) and graphite furnace atomic absorption spectrophotometry (GFAAS).[Result]8 heavy metals were detected in the stems,leaves and rhizosphere soil of Eupatorium adenophorum,the contents of heavy metals in different habitats were significantly different (P<0.05) and the content in the stems and leaves changed significantly with the habitats (P<0.05).The average content of Mn,Sr and Pb was the highest in the all samples.Bioaccumulation ability showed the leaf was higher than stem,and ability of different heavy metals varies with different tissues.Leaf had significant effect on Cd,Mn,Hg,Sr and Ni (P<0.05),stem on Cd,Mn and As was significant (P<0.05),and the distribution of average bioaccumulation factor of stems and leaves was Cd > Mn > Ni > Sr > Hg > Pb > As ≈ Cr.[Conclusion]Eupatorium adenophorum has significant bioaccumulation ability on soil heavy metals (Cd,Mn,Hg,Sr,Ni,As) ,and shows selective enrichment.It can be used as a repair plant in some heavy metal polluted areas and realize the utilization value of invasive plant Eupatorium adenophorum because of its strong adaptability,fast growth speed and large biomass.
Key words Eupatorium adenophorum;Rhizosphere soil;Heavy metal;Bioaccumulation ability;Phytoremediation
随着国内农牧、矿业及工商业等迅猛发展加之前期不完善的污染物治理体系,致使我国很多地区出现了较为严重的土壤重金属污染[1-2],特别是耕地土壤的重金属污染问题比较突出[3]。因重金属在环境中具有稳定性和难降解性,易在土壤中长期累积,其污染具有隐蔽性,产生的后果不可逆转[4-5],使得其治理的难度大、过程长、费用高、效果差,若污染长期富集将会改变水土性状和质量,降低自我净化能力,最终影响生态环境、人体健康甚至社会安全和发展[6]。目前,我国治理土壤重金属污染问题主要通过物理、化学和生物修复3种措施[7],其中通过生物修复是充分利用土壤中的生物进行生命活动时吸收富集元素以达到降低或修复土壤重金属污染的目的,相对前2种措施来说操作简单、消耗成本低、环境干扰少,具有原位修复和绿色可持续的优点[1,8],是当前乃至今后研究和利用的主要方向和目标。
紫茎泽兰(Eupatorium adenophora Spreng.)又名飞机草、解放草、霸王草等,是我国当前外来入侵植物中危害最严重之一,已对入侵地的生态、生物多样性、农林渔牧业安全生产以及人畜健康等造成了很大经济损失甚至产生一定威胁,且早被列入首批入侵我国的16种外来物种之首[9],由此各界人士长期通过研究或采取了人工机械、化学或生物防治等措施一味地将其当作害草进行防治[10]。然而,近年来紫茎泽兰的研究方向也逐步从防治转向综合利用,通过生产有机肥料、能源、饲料、染料、纤维原料、生物农药等或用于改良土壤、保持水土流失及维持农业生态系统多样性等[11],企图将紫茎泽兰化害为利,变废为宝。研究表明,紫茎泽兰生长适应能力、繁殖能力、入侵能力、抗逆境能力均较强,传播速度快、生长范围广、生物产量高,具有很多矿区土壤重金属污染修复先锋植物的特征[12-13],对Pb、Cd、Cr、Zn和Hg具有富集能力[14-17],对其他重金属的富集作用及具体应用的深入研究报道较少。
因此,笔者采集云南省临翔区4种不同生境的紫茎泽兰及其根际土壤,通过分析植株茎、叶及根际土壤中的Sr、Cr、As、Cd、Pb、Hg、Mn、Ni含量和富集系数,拟揭示紫茎泽兰茎、叶组织中重金属的分布规律及对其根际土壤重金属的富集能力,以期为紫茎泽兰发挥重金属污染修复价值及其应用推广提供参考。
1 材料与方法
1.1 材料
1.1.1 样品采集与处理。2018年7—9月,根据表观土壤类型不同,随机采集了临沧市临翔区花果山城市森林公园(生境土质疏松且植被種类繁多、腐殖程度高,记为生境A)、忙角社区(生境为垃圾堆、生境群落单一,记为生境B)、西环路边(生境属于砂质土、杂草丛生,记为生境C)和南汀河边(生境湿润、红色疏松土质、植被丰富,记为生境D)4种不同生境生长旺盛的紫茎泽兰植株及根际土壤。植株叶、茎分开于室内自然风干后分别粉碎成粉末;去除根际土壤中的石子、动植物残体等异物后用四分法将混匀土样缩分至约100 g,风干土样研磨过10目(2.0 mm)尼龙筛(除去2 mm以上砂砾)后混匀,再用玛瑙研钵研磨至全部通过100目(直径0.149 mm)尼龙筛后混匀备用。
1.1.2 主要试剂。氩气(≥99.995%)、氦气(≥99.995%)均来自昆明宏发得利气体有限公司;硝酸(ρ=1.42 g/mL,优级纯)、氢氟酸(ρ=1.49 g/mL,优级纯)、高氯酸(ρ=1.68 g/mL,优级纯)均来自美国默克公司;氢氧化钾(优级纯,天津津科);草酸溶液(100g/L)、铁氰化钾溶液(100 g/L)、硼氢化钾(优级纯)均来自国药集团;硫酸(分析纯)、盐酸(ρ=1.19 g/mL,优级纯)、磷酸氢二铵(5%,优级纯)、硫脲(分析纯)、抗坏血酸(分析纯)、三氧化二砷(优级纯)均来自阿拉丁试剂(上海)有限公司;铅标准储备液(0.500 mg/mL)、镉标准储备液(0.500 mg/mL)、铅标准液(250 g/L)、镉标准液(50 pg/L)均来自国家标准物质研究中心;王水(1+1)。
1.1.3 主要仪器。
ICP-MS(Agilent7800,美国安捷伦);AFS(AFS-8330,日本岛津公司);GF-AAS(ICE-3300GF,日本岛津公司);手动进样器(10 μL);万分之一天平(BSA224S1,赛多利斯);高压微波消化器(Anton Paar MW PRO-T50,奥地利安东帕有限公司);50~300℃恒温干燥箱(DHG-9070A,上海浦东荣丰科学仪器有限公司);50~200 ℃控温电热板(EG35A-PLVS,常州国华电器);高速粉碎机(FW100,武汉海纳电器);超纯水系统(ELGA-classic uvF,英国ELGA公司);水性微孔滤膜(0.22 μm);25 mL容量瓶。
1.2 方法
1.2.1 试样液制备。
1.2.1.1 植株样品消解液制备。
称取植株粉末0.2 g(精确至0.001 g),加入5 mL硝酸,加盖放置1 h,于100 ℃电热板预消解30 min,再于120 ℃维持5 min、150 ℃维持10 min、190 ℃维持20 min,冷却后取出缓慢排气,洗净内盖,继续于100 ℃电热板上赶酸120~150 min排出棕色气体,将消化液转移至25 mL容量瓶中,用少量超纯水分3次洗涤内罐,洗涤液合并于容量瓶中并定容至刻度,混匀备用;同时作空白试验。
1.2.1.2 土壤样品消解液制备。
参照《土壤质量铅、镉的测定 石墨炉原子吸收分光光度法》(GB/T 17141—1997)[18]制备土样消解液,先于50 mL坩埚中称取土样0.2 g(精确至0.000 2 g),超纯水润湿后加入5 mL盐酸,电热板低温加热分解2 h,加入10 mL硝酸继续加热至余3 mL,依次加入5 mL 硝酸、4 mL氢氟酸和2 mL高氯酸后加盖后中温加热1 h,开盖除硅至冒白烟,反复操作至内容物黏稠状,用1 mL硝酸高氯酸混合液(V硝酸∶V高氯酸=5∶1)温热溶解残渣后转移至25 mL 容量瓶,加磷酸氢二铵溶液定容,摇匀待测。
1.2.2 试样测定。
1.2.2.1 植物试样测定。取“1.2.1.1”消解液和空白样液,参照国标GB 5009.268—2016测定紫茎泽兰植株样品中锰(Mn)、镍(Ni)、锶(Sr)、铬(Cr)、镉(Cd)、铅(Pb)、汞(Hg)和砷(As)8种重金属含量[19]。ICP-MS检测条件为循环水48~50 ℃、氦气0.05 MPa、氩气0.6~0.7 MPa、载气1.2 L/min、雾化室温度2 ℃、引入样品时间70 s、稳定70 s、蠕动泵速度0.3 s,积分时间除Cd 0.5 s和As 1 s外其他均为0.1 s。通过公式(1),根据空白检测值、试液检测值、样品称样量、稀释倍数和试液体积计算样品中重金属含量,结果以mg/kg表示,保留2位小数。
X=(p-p0)×v×fm×1 000(1)
式中,X为待测元素含量(mg/kg);p为试样溶液中被测元素质量浓度(μg/L);p0为空白检测值(μg/L);v为试样消化液体积(mL);f为试样稀释倍数;m为试样称取质量(g);1 000为换算系数。
1.2.2.2 土壤试样测定。
(1)石墨炉原子吸收分光光度法。取“1.2.1.2”消解液和空白样液,参照国标GB 5009.17—2014测定土壤样品中铬(Cr)、镉(Cd)、锰(Mn)、锶(Sr)和镍(Ni)5种重金属含量[18]。检测结果是处理后试样浓度,然后按公式(2)计算试样中重金属含量,结果以mg/kg表示,保留2位小数。
W =C×Vm×(1-f)(2)
式中,W为试样中重金属含量(mg/kg);C为试液的吸光度减去空白试验的吸光度,然后在标准曲线上查得重金属的含量(μg/L);V为试液定容的体积(mL);m为称取试样的重量(g);f为试样中水分的含量(%)。
(2)原子荧光光谱法。取“1.2.1.2”消解液和空白样液,参照国标GB/T 22105.3—2008测定土壤中砷(As)、铅(Pb)和汞(Hg)3种重金属含量[20]。检测结果是处理后试样浓度,然后按公式(3)计算出样品中某元素的具体含量,结果以mg/kg表示,保留2位小数。
W=(c-c0)× vm×(1-f)×1 000× 10(3)
式中,W为试样中重金属含量(mg/kg);c为试液元素含量(ng/mL);c0为试剂空白液测定浓度(ng/mL);v为样品消解后定容体积(mL);m为试样质量(g);f为土壤含水量(%);1 000 为换算系数;10为稀释倍数。
1.2.3 数据处理。试验每个样品重复测定3次,通过Microsoft Office 2010求算平均值、标准偏差并绘图比较分析,测定结果数值表示形式为平均值±标准偏差(±SD);利用SPSS 22.0中文版进行单因素方差分析。
生物富集系数(bioconcentration factor,BCF)是指植物某特定组织中重金属含量与土壤相应元素含量的比值,该比值能够衡量植物将土壤中某重金属吸收转移到特定组织内部的能力,BCF值越大表示富集能力越强,该研究用其反映紫茎泽兰对重金属的富集能力,按以下公式计算[21-23]:
BCF=ω1ω2(4)
其中,BCF为富集系数,ω1为紫茎泽兰茎或叶中某重金属含量(mg/kg),ω2为土壤中相应重金属含量(mg/kg)。
2 结果与分析
2.1 各样品中重金属含量分析
对4个不同生境紫茎泽兰的茎、叶及其根际土壤中Mn、Ni、Sr、Cr、Cd、Pb、Hg和As共8种元素进行测定,结果如表1所示。由表1可知,不同生境的紫茎泽兰茎、叶和根际土壤均检测到8种重金属,但同一元素在不同生境土壤中的含量差异均显著(P<0.05),且紫茎泽兰茎、叶中的Mn、Sr、Pb 3种元素因生境不同表现差异显著(P<0.05),而Ni、Cr、Cd、Hg 4种元素含量随生境变化不明显(趋向一致),As元素变化无规律。Mn、Sr含量在4种生境全部植株的茎、叶和根际土壤中含量均较高,Pb在根际土壤中含量均较高但植物的茎、叶中含量较低,其余元素含量因生境不同变化无规律,此结果与汪文云等[24]对紫茎泽兰茎、叶中重金属元素含量测定分析结果一致。说明紫茎泽兰茎、叶组织中的重金属来自于根际土壤,但各组织对不同重金属的吸收富集能力不同。
此外,4种生境紫茎泽兰根际土壤中的Ni、Cr、Pb、As含量均低于我国土壤环境质量(农用地土壤污染风险管控标准)一级标准值,A、C、D 3个生境土壤中Cd含量低于一级标准值(0.30 mg/kg),而B采样点(忙角社区垃圾堆旁)低于三级标准值(0.60 mg/kg)(表1),且均未超出我国农用地土壤污染风险筛选值[25],说明重金属含量与生境土壤有关且该研究的4种生境生态环境土壤重金属污染风险低。
2.2 紫茎泽兰中重金属元素分布规律
植物在細胞和亚细胞水平上对重金属有区隔化作用,这可能是植株的不同组织器官或部位的重金属含量或分布不同的主要原因[26-27],不同重金属在4种生境紫茎泽兰茎和叶中的含量有一定差异,但均表现为Mn含量最高、Hg含量最低,且叶中的8种重金属平均含量均为高于茎(表1)。
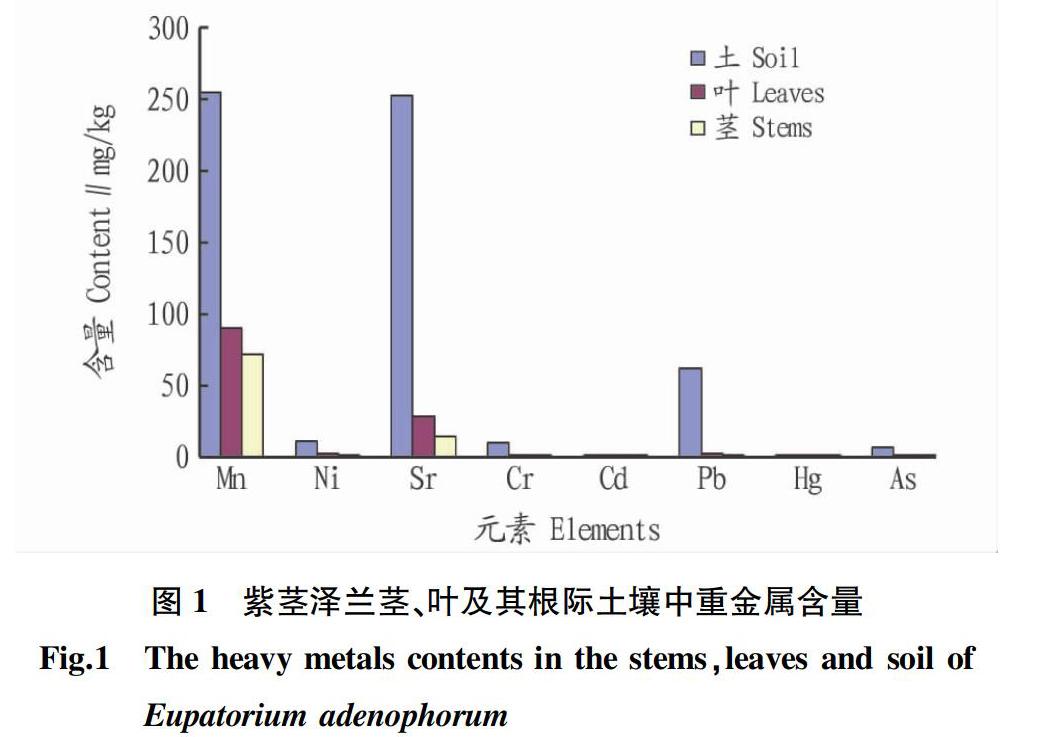
结合图1可知,紫茎泽兰的茎和叶中所含8种重金属平均含量变化与根际土壤中对应元素含量高低一致。根际土壤中平均含量较高的3种元素依次为Mn(254.33 mg/kg)、Sr(252.62 mg/kg)和Pb(61.35 mg/kg),紫茎泽兰茎组织中对应元素含量依次为Mn(71.16 mg/kg)、Sr(13.57 mg/kg)和Pb(0.64 mg/kg),叶组织中依次为Mn(89.57 mg/kg)、Sr(27.74 mg/kg)和Pb(6.03 mg/kg),说明紫茎泽兰吸收富集元素含量的多少与该元素在根际土壤中的含量高低成正比,这可能与土壤中一定范围内高浓度的重金属胁迫而促进了植物体吸收相应元素有关,且该研究的结论与刘小文等[15]的研究结论一致 。另外,虽然土壤中具有较高的Pb含量,但紫茎泽兰的茎和叶组织中含量都明显偏低,其余5种重金属在土壤和植株中的平均含量均较低,说明紫茎泽兰对土壤中重金属的富集作用具有元素选择性。
2.3 紫茎泽兰对重金属富集能力分析
从表2可以看出,紫茎泽兰对重金属的富集系数因组织部位和生境不同而存在一定差异。其中A和D生境的紫茎泽兰的叶、茎对Cd的富集能力均表现较强(大于1.2),而其他生境紫茎泽兰茎和叶对重金属的富集作用各不一致,如A位点的紫茎泽兰茎和叶分别对Mn、Ni、Cr、Cd、Pb的富集能力差异显著(P<0.05),B位点的茎和叶分别对8种重金属的富集能力差异均显著(P<0.05),C位点的茎和叶分别对Mn、Ni、Cr、Pb、Hg、As的富集能力差异显著(P<0.05),而D位点的茎和叶只有对Hg的富集能力不显著,这分别与李冰等[28]、王厚杰等[29]、刘月莉等[30]研究紫茎泽兰对Cr、Cd、Pb、Ni、Mn富集能力的结论相一致。说明生境对紫茎泽兰富集重金属能力影响较大,而对其富集重金属种类(选择性)影响小,这可能与不同生境条件下各紫茎泽兰植株的新陈代谢水平差异及生长状态有关。
结合表1和表2发现,紫茎泽兰茎、叶对重金属的富集作用与生境土壤该元素含量情况无关,如Mn在D生境土壤中含量最高而在C生境中最低,但富集系数最大的是B生境的茎和C生境的叶;Cd在B生境土壤中含量最高而在A生境中最低,但B生境的茎、叶富集系数却最小而A生境的茎、叶富集系数均较高;4个生境土壤中含量较高的是Mn、Sr和Pb,但富集系数最高的元素是Cd,且Pb在B生境中含量最高而富集系数相对较低;B生境土壤Hg含量最低,但该生境植株叶片的富集系数又最大;A和C生境土壤As含量均较高,富集系数均很小。
重金属作为根际土壤的元素组成部分,在植物生长代谢过程中会将特定元素吸收为自身利用,但从表2可以看出,该研究的4种生境植株样品茎和叶对8种重金属元素吸收富集系数明显不同,所有的茎和叶对Cd具有较大的富集系数,其次是Mn,对其他6种元素的富集系数很小,这可能是导致植物地上部分各组织中元素分布存在差异的原因之一,其根本原因还可能与不同生境紫茎泽兰的茎、叶组织生长速度快、生物量大的生物学特性有关。
紫茎泽兰茎、叶对重金属富集能力大小可能与植物组织生长状态有关。4种生境土壤中Cr含量相当,此时所有植株对其富集系数均呈现叶明显高于茎(表2)。该研究采集的紫茎泽兰植株为生长旺盛期,表现为所有叶片组织对重金属(除As外)的平均富集能力均比茎组织高(图2),这与汪文云等[24]研究发现紫茎泽兰对As富集系数最小相吻合;不同的是,此次研究的植株茎和叶组织的富集系数规律均为Cd>Mn>Ni>Sr>Hg>Pb>As≈Cr,这可能与采样时紫茎泽兰叶片生长迅速、新陈代谢快、生物量大的生物学特性相关,由此特点可很好地将紫茎泽兰利用于特定重金属污染土壤的植物修复。
3 结论
紫茎泽兰茎、叶组织中的8种重金属均来自于根际土壤,不同生境土壤中重金属含量差异显著(P<0.05),导致紫茎泽兰茎和叶中重金属元素含量随生境变化显著(P<0.05),该研究的4种生境茎、叶和根际土壤中的Mn、Sr和Pb含量均为较高且含量规律一致。紫茎泽兰叶对Cd、Mn、Hg、Sr、Ni,茎对Cd、Mn、As的富集作用均显著(P<0.05),对其他元素富集能力小可能与此次采样植株生境缺乏适当高含量元素胁迫有关,但茎、叶组织平均富集系数分布规律均为Cd>Mn>Ni>Sr>Hg>Pb>As≈Cr,且富集能力叶大于茎。因此,入侵植物紫茎泽兰在一定生境条件下对根际土壤中特定重金属具有不同能力的富集作用,在紫茎泽兰长期防治无果的情况下,转变思路将紫茎泽兰由入侵植物转化为有用植物,利用其特性发挥生态-经济型的土壤重金属修复植物值得应用推广。
参考文献
[1]王瑞兵,叶转兄,金新港,等.土壤污染植物修复的研究进展[J].绿色科技,2019(22):109-110.
[2] 卢信,罗佳,高岩,等.畜禽养殖废水中抗生素和重金属的污染效应及其修复研究进展[J].江苏农业学报,2014,30(3):671-681.
[3] 蔡美芳,李开明,谢丹平,等.我国耕地土壤重金属污染现状与防治对策研究[J].环境科学与技术,2014,37(S2):223-230.
[4] 唐世荣,黄昌勇,朱祖祥.污染土壤的植物修复技术及其研究进展[J].上海环境科学,1996,15(12):37-39,47.
[5] 陈兴兰,杨成波.土壤重金属污染、生态效应及植物修复技术[J].农业环境与发展,2010,27(3):58-62.
[6] 刘少文,焦如珍,董玉紅,等.土壤重金属污染的生物修复研究进展[J].林业科学,2017,53(5):146-155.
[7]周际海,黄荣霞,樊后保,等.污染土壤修复技术研究进展[J].水土保持研究,2016,23(3):366-372.
[8] PADMAVATHIAMMA P K,LI L Y.Phytoremediation technology:Hyper-accumulation metals in plants[J].Water,air & soil pollution,2007,184(1):105-126.
[9] LU Z J,MA K P.Spread of the exotic croftonweed (Eupatorium adenophorum) across southwest China along roads and streams[J].Weed science,2006,54(6):1068-1072.
[10] 李霞霞,张钦弟,朱珣之.近十年入侵植物紫茎泽兰研究进展[J].草业科学,2017,34(2):283-292.
[11] 周启武,于龙凤,王绍梅,等.入侵植物紫茎泽兰的危害及综合防控与利用[J].动物医学进展,2014,35(5):108-113.
[12] 王霞霞,李,李君,等.种龄、种内竞争及环境因子对紫茎泽兰种子萌发影响的研究[J].生态环境学报,2013,22(9):1471-1475.
[13] 朱文达,曹坳程,颜冬冬,等.除草剂对紫茎泽兰防治效果及开花结实的影响[J].生态环境学报,2013,22(5):820-825.
[14] ZU Y Q,LI Y,CHEN J J,et al.Hyperaccumulation of Pb,Zn and Cd in herbaceous grown on leadzinc mining area in Yunnan,China[J].Environment international,2005,31(5):755-762.
[15] 劉小文,齐成媚,欧阳灿斌,等.Pb、Cd及其复合污染对紫茎泽兰生长及吸收富集特征的影响[J].生态环境学报,2014,23(5):876-883.
[16] 侯洪波,杨鸾芳,刘忆明,等.紫茎泽兰对重金属锌富集特性研究[J].安徽农业科学,2012,40(35):17273-17274.
[17] 侯洪波,刘忆明,杨保海,等.紫茎泽兰对煤渣污染土壤重金属的富集·修复特性[J].安徽农业科学,2013,41(1):106,109.
[18] 中国环境监测总站.中华人民共和国国家标准 土壤质量 铅、镉的测定 石墨炉原子吸收分光光度法:GB/T 17141—1997[S].北京:中国标准出版社,1997.
[19] 中华人民共和国国家卫和计划生育生员会,国家食品药品监督管理总局.食品安全国家标准 食品中多元素的测定:GB 5009.268—2016[S].北京:中国标准出版社,2016.
[20] 农业部环境保护科研监测所.土壤质量 总汞、总砷、总铅的测定 原子荧光法 第3部分:土壤中总铅的测定:GB/T 22105.3—2008[S].北京:中国标准出版社,2008.
[21] 时宇,冉珊珊,黄黄,等.黄石国家矿山公园草本植物重金属富集能力研究[J].生态环境学报,2018,27(4):769-775.
[22] 孙清斌,尹春芹,邓金锋,等.矿区农田土壤小麦体系中重金属污染特征研究[J].河南农业科学,2013,42(4):80-84.
[23] FRANKOWSKA A,ZIKOWSKA J,BIELAWSKI L,et al.Profile and bioconcentration of minerals by King Bolete (Boletes edulis) from the Plocka Dale in Poland[J].Food additives and contaminants:Part B,2010,3(1):1-6.
[24] 汪文云,张朝晖.贵州水银洞金矿紫茎泽兰重金属元素测定与分析[J].植物研究,2008,28(6):760-763.
[25] 生态环境部,国家市场监督管理总局.中华人民共和国国家标准 土壤环境质量 农用地土壤污染风险管控标准(试行):GB 15618—2018[S].北京:中国标准出版社,2018.
[26] KPPER H,ZHAO F J,MCGRATH S P.Cellular compartmentation of zinc in leaves of the hyperaccumulator Thlaspi caerulescens[J].Plant Physiol,1999,119(1):305-311.
[27] HALL J L.Cellular mechanisms for heavy metal detoxification and tolerance [J].J Exper Bot,2002,53(366):1-11.
[28] 李冰,张朝晖.烂泥沟金矿区紫茎泽兰对重金属的富集特性及生态修复分析[J].黄金,2008,29(8):47-50.
[29] 王厚杰,彭培好,贝荣塔,等.三岔河沿岸植物铅、镉富集特性的研究[J].环境科学导刊,2012,31(2):11-15.
[30] 刘月莉,伍钧,唐亚,等.四川甘洛铅锌矿区优势植物的重金属含量[J].生态学报,2009,29(4):2020-2026.
