SOX-9通过调控ADAMTS保护椎间盘
2020-01-03徐敏铭温子欢王绪君黄常盛
徐敏铭,温子欢,官 伟,王绪君,黄常盛
1.上饶惠阳医院骨科,上饶 334000
2.上饶市立医院骨科,上饶 334000
3.上饶清水医院骨科,上饶 334000
椎间盘位于椎体之间,司职脊柱旋转、屈曲和背伸活动的密闭性结构,包括中央髓核、外围纤维环以及上下两端软骨终板[1-2]。髓核位于椎间盘核心位置,在椎间盘发挥功能时起着至关重要的作用。椎间盘发生退行性变时,髓核变化最为明显,表现为以细胞外基质代谢紊乱为主的多种病理生理反应[3]。含Ⅰ型血小板反应蛋白的解聚蛋白样金属蛋白酶(ADAMTS)是一种Zn2+依赖的基质降解酶[4]。研究表明,ADAMTS家族成员中的ADAMTS-4和ADAMTS-5可大量降解细胞外基质成分中的蛋白聚糖(ACAN),在退行性疾病中发挥重要作用[5]。SOX-9是软骨分化和早期睾丸发育过程中的关键调节因子,可调节ACAN和胶原纤维等细胞外基质成分的表达[6]。研究表明,SOX-9单倍体功能不全可引起严重的软骨发育不良、长骨弯曲等骨骼畸形,表明SOX-9对软骨细胞具有重要的调控作用[7]。然而,关于SOX-9在椎间盘中的表达情况以及SOX-9与ADAMTS-4、ADAMTS-5相互作用对椎间盘退行性变的影响,目前研究较少。因此,本研究拟探讨SOX-9和ADAMTS-4、ADAMTS-5在椎间盘退行性变中的作用及其相互之间的调控关系。
1 材料与方法
1.1 试剂和仪器
ADAMTS-5抗体(a6727)购自Sigma-Aldrich公司;ADAMTS-4抗体(sc-25582)、Ⅱ型胶原(COL2A1)抗体(sc-28887)、ACAN抗体(sc-25674)、β-actin抗体(sc-47778)和SOX-9抗体(sc-20095)购自Santa Cruz Biotechnology公司;软骨寡聚物基质蛋白(COMP)抗体(ab128893)购自Abcam公司;反转录试剂盒(RR047A)、SYBR Green premix(RR420A)购自TaKaRa公司。GeneAmp 9700型荧光定量PCR仪为Applied Biosystems公司产品。
1.2 临床标本采集和处理
组织标本来源于40例因椎间盘退行性变或外伤后需行椎间盘摘除术的患者,标本收集均获得患者知情同意。对收集的标本采用Pfirrmann分级[8]系统进行退行性变等级界定,将一部分标本用10%中性福尔马林固定,通过HE染色、Masson染色和番红O-固绿染色鉴定椎间盘组织退行性变程度,其中Ⅱ级7例,Ⅲ级13例,Ⅳ级15例,Ⅴ级5例;一部分标本采用免疫组织化学染色观察ADAMTS-4、ADAMTS-5的表达;一部分标本组织用于分离髓核细胞;其余组织用于提取总蛋白及RNA。
1.3 人髓核细胞分离和培养
根据Risbud等[9]报道的髓核细胞提取方法从髓核组织中分离人髓核细胞。人髓核细胞采用含10%胎牛血清并添加抗生素的DMEM高糖培养基在37℃、5%CO2条件下进行培养,72 h后观察细胞贴壁情况并进行换液,以后每3 d换液1次,待细胞生长至约80%汇合时进行传代或冻存,取2 ~ 6代的细胞进行实验。
1.4 小干扰RNA(siRNA)转染和腺病毒感染
siSOX-9、siADAMTS-4、siADAMTS-5和FAM-siRNA均购自上海吉玛制药技术有限公司,转染前1 d将髓核细胞均匀铺于6孔板中,将siRNA和Lipofectamine 3000混合液加入细胞中,转染后24 ~ 48 h收集细胞进行后续实验。SOX-9过表达腺病毒购自上海汉恒生物科技有限公司,摸索最佳感染复数后直接加入细胞中,完成腺病毒感染。
1.5 蛋白质印迹分析
组织蛋白提取:组织标本离体后立即冻存于液氮,然后使用机械研磨将组织磨成粉末,加入含有蛋白酶抑制剂混合液的RIPA裂解液冰上裂解;细胞蛋白提取:髓核细胞从培养箱取出立即放在冰上冷却,用预冷PBS洗涤3次,加入含有蛋白酶抑制剂混合液的RIPA裂解液,用细胞刮收集细胞及细胞裂解液。收集的裂解液于4℃条件下12 000 r/min(离心半径8 cm)离心15 min取上清,采用BCA法测定蛋白浓度;加入蛋白上样缓冲液,95℃加热5 min,然后进行电泳、转膜、封闭,加入相应的一抗、二抗进行孵育,显色后观察,计算目的蛋白相对表达量。
1.6 实时荧光定量PCR
采用RNeasy mini spin columns(Qiagen公司)提取总RNA,测定浓度后取2 μg反转录合成cDNA。实时荧光定量PCR反应体系:cDNA模板、目的基因特异性正向和反向PCR引物、灭菌水和SYBR Green premix(TaKaRa公司)。反应条件 :95℃ 30 s;95℃5 s、60℃ 10 s、72℃ 25 s,40个循环。采用2-△△Ct法计算目的基因的相对表达量。
1.7 统计学处理
采用SPSS 17.0软件对数据进行统计学分析,计量资料以表示,组间比较采用Student’st检验,多组间比较采用单因素方差分析;以P< 0.05为差异有统计学意义。
2 结 果
2.1 椎间盘组织病理学观察
根据Priffmann分级系统,将Ⅱ级退行性变组织设为对照,通过HE染色、Masson染色和番红O-固绿染色观察椎间盘组织退行性变程度,结果显示,正常组织(Ⅱ级)内髓核细胞数量较多,为大小较为均一的类圆形软骨样细胞,胶原纤维排列规整,层次清晰,细胞外基质ACAN含量丰富;而发生退行性变组织(Ⅳ级)内细胞数目少,散在稀疏,胶原纤维排列紊乱,各层之间出现断裂、崩解,ACAN含量明显减少,符合椎间盘退行性变的组织学变化(图1)。

图1 椎间盘组织病理染色Fig. 1 Histopathological staining of intervertebral disc tissues
2.2 椎间盘组织中ADAMTS的表达
免疫组织化学染色结果显示,ADAMTS-4、ADAMTS-5主要位于胞质中(图2a),发生退行性变的组织中二者的表达水平均高于Ⅱ级组织,且差异有统计学意义(P< 0.05,图2b)。实时荧光定量PCR(图2c)和蛋白质印迹分析(图2d)结果显示,发生退行性变的组织中ADAMTS-4、ADAMTS-5的表达在mRNA和蛋白水平均上调,与Ⅱ级组织相比差异有统计学意义(P< 0.05)。
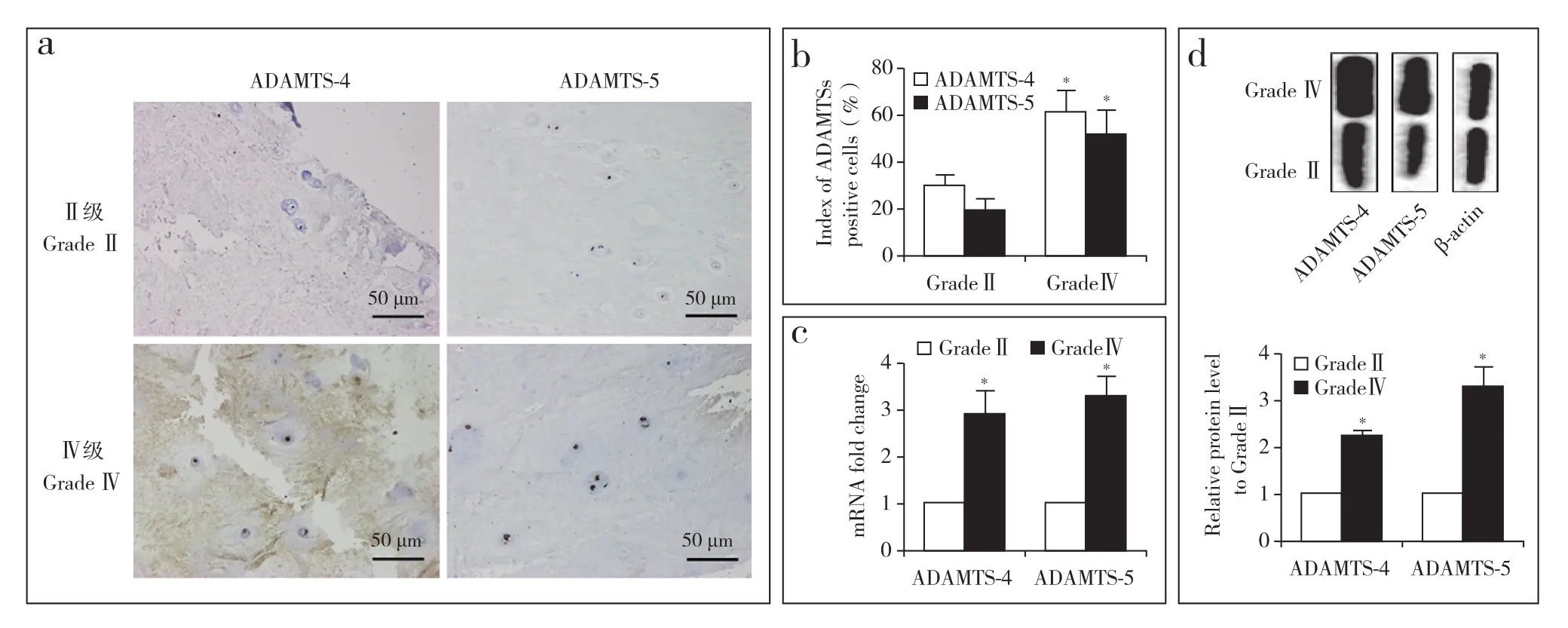
图2 椎间盘组织中ADAMTS的表达Fig. 2 Expression of ADAMTS in intervertebral disc tissues
2.3 椎间盘组织中SOX-9和细胞外基质成分的表达
通过免疫组织化学染色及半定量分析(图3a,b)、实时荧光定量PCR(图3c)和蛋白质印迹分析(图3d)检测椎间盘组织中SOX-9和细胞外基质成分(COL2A1、ACAN和COMP)的表达,结果显示,发生退行性变的组织中SOX-9、COL2A1、ACAN和COMP的mRNA及蛋白表达均低于Ⅱ级组织,且差异有统计学意义(P< 0.05)。

图3 椎间盘组织中SOX-9和细胞外基质成分的表达Fig. 3 Expression of SOX-9 and extracellular matrix component in intervertebral disc tissues
2.4 SOX-9对人髓核细胞ADAMTSs、COL2A1、ACAN和COMP表达的影响
提取正常椎间盘组织中髓核细胞进行原代培养(对照组),利用siRNA干扰或腺病毒过表达载体调节髓核细胞内SOX-9表达,通过siRNA阴性携带FAM[SOX-9(-)]及腺病毒携带GFP荧光[SOX-9(+)]表达可见转染效率达80%(图4a),同时蛋白质印迹分析证实干扰和过表达效率可靠(图4b)。蛋白质印迹分析(图4b)和实时荧光定量PCR(图4c)结果显示,干扰SOX-9表达后,细胞外基质成分COL2A1、ACAN和COMP表达下调,同时基质降解酶ADAMTS-4、ADAMTS-5表达上调;而SOX-9过表达可抑制基质降解酶ADAMTS-4、ADAMTS-5表达,并促使细胞外基质成分COL2A1、ACAN和COMP表达上调。上述结果提示,SOX-9在髓核细胞中可促进细胞外基质成分合成,并抑制降解反应。

图4 SOX-9对人髓核细胞ADAMTS、COL2A1、ACAN和COMP表达的影响Fig. 4 Effect of SOX-9 on expression of ADAMTS,COL2A1,ACAN and COMP
2.5 SOX-9通过ADAMTS调节细胞外基质成分的表达
蛋白质印迹分析(图5a)和实时荧光定量PCR检测(图5e)结果显示,抑制ADAMTS-4、ADAMTS-5表达后,COL2A1、ACAN和COMP表达均上调,表明COL2A1、ACAN和COMP的表达受到ADAMTS-4、ADAMTS-5调控。蛋白质印迹分析(图5b,c)结果显示单一抑制SOX-9活性可下调COL2A1、ACAN和COMP表达,而同时抑制SOX-9和ADAMTS-4/ADAMTS-5后,COL2A1、ACAN及COMP表达相较于单一抑制SOX-9后上升,表明SOX-9通过ADAMTS-4、ADAMTS-5影响细胞外基质成分的表达。双荧光素酶报告基因检测(图5d)结果显示,SOX-9可下调ADAMTS-4、ADAMTS-5启动子活性,表明SOX-9可直接调控ADAMTS-4、ADAMTS-5表达。

图5 SOX-9通过ADAMTS影响细胞外基质成分的表达Fig. 5 SOX-9 affects expression of extracellular matrix components through ADAMTS
3 讨 论
有研究表明,ADAMTS家族中的ADAMTS-4和ADAMTS-5可通过酶切位点Glu373、Glu1545、Glu1714、Glu1819和Glu1919等降解ACAN,引发细胞外基质合成与分解代谢失衡,在骨关节炎中发挥重要作用[5,10]。Tian等[11]证实上述2种酶在椎间盘退行性变中的作用主要表现为促进细胞外基质,如ACAN、COMP、COL2A1等的降解。本研究结果显示,抑制髓核细胞内ADAMTS-4和ADAMTS-5的表达可引起ACAN、COMP、COL2A1在蛋白及mRNA水平的整体上调,提示ADAMTS-4和ADAMTS-5不仅在蛋白水平发挥降解作用,同时在mRNA水平抑制转录活性,表明ADAMTS-4和ADAMTS-5促进ACAN、COMP、COL2A1降解的同时抑制合成,在细胞外基质成分的代谢中发挥双重作用,协同促进椎间盘退行性变的发生。
转录因子SOX-9已被证实在软骨细胞中发挥多重作用,其表达失调与骨关节炎息息相关[12]。鉴于关节炎与椎间盘退行性变发生机制类似,且髓核细胞与软骨细胞具有一定同源性,本研究组推测SOX-9在椎间盘中具有同等地位。有研究报道,SOX-9可促进ACAN、COMP、COL2A1等细胞外基质成分表达,而ADAMTS显著抑制ACAN、COMP、COL2A1表达[13-14],与本研究结果一致,表明SOX-9和ADAMTS在调节细胞外基质表达层面存在一定竞争关系。关于SOX-9和ADAMTS之间是否存在调控关系目前尚未有统一观点,Kadaja等[15]通过染色质免疫沉淀测序(CHIP-seq)发现转录因子SOX-9可结合ADAMTS家族成员,而后通过转录组测序(RNA-seq)证实ADAMTS在SOX-9基因敲除小鼠中表达明显上调,表明ADAMTS表达受到SOX-9调控,但具体机制仍不明确。本研究直接在细胞层面通过基因过表达和干扰技术探索SOX-9对ADAMTS的调控作用关系,结果发现抑制SOX-9表达促使ADAMTS表达上调,而过表达SOX-9后ADAMTS表达明显下调。结合Kadaja等[15]的研究结果,推测转录因子SOX-9可能通过结合ADAMTS启动子位点进而影响启动子活性的方式调节ADAMTS转录水平。为此,本研究开展双荧光素酶报告基因检测试验,证实SOX-9确实被募集到ADAMTS启动子位点,降低了启动子活性,表明SOX-9可通过直接作用方式抑制ADAMTS的表达。
综上所述,本研究发现,发生退行性变的椎间盘组织中ADAMTS对细胞外基质成分的表达调控具有双重作用,表现为促进降解并抑制合成。SOX-9在椎间盘内通过直接作用的方式影响ADAMTS表达,进而调节细胞外基质成分的表达,最终发挥保护椎间盘的作用。关于椎间盘发生退行性变时SOX-9表达减少及功能紊乱的机制仍需进一步研究。
