吡非尼酮对大鼠坐骨神经损伤后瘢痕形成及功能恢复的实验研究
2020-01-02王华伟薛金伟董洪亮凌丽焦建宝韩翠玉
王华伟薛金伟*董洪亮凌丽焦建宝韩翠玉
周围神经损伤后,在神经修复的过程中会形成神经瘢痕,而瘢痕的形成会使神经外膜与周围组织粘连,对神经束造成物理性卡压。长期的卡压存在,造成神经缺血,引起髓鞘变性坏死,阻碍受损神经与远端效应器建立有效连接[1-2],影响神经的正常形态结构及功能恢复。因此,如果能减少瘢痕的形成,减轻对神经的物理压迫和阻挡,便能够在一定程度上改善神经功能恢复情况[3]。胶原蛋白的沉积是瘢痕形成的基本环节,成纤维细胞是合成胶原的主要细胞,成纤维细胞合成与分泌胶原能力的增强或成纤维细胞的大量增殖,将导致胶原沉积量增加,从而形成瘢痕[4]。近年来研究发现,细胞因子抑制剂(cytokine inhibitors)吡非尼酮(pirfenidone,PFD)能明显抑制成纤维细胞胶原蛋白的分泌,抑制瘢痕形成[5]。PFD已经在治疗其他组织瘢痕和纤维化疾病的研究中取得了丰硕的成果[6-7],而对神经瘢痕的形成有无抑制作用目前国内外未见相关报道。研究发现,神经瘢痕同其他组织修复时的瘢痕在组织学上很相近,也是以Ⅰ型胶原蛋白为主的细胞外基质在损伤处的异常沉积为特征[8]。所以笔者推测,PFD同样能够抑制神经瘢痕的形成,促进功能恢复。本实验应用这一研究模型和方法,观察PFD对神经吻合口处瘢痕形成及神经功能恢复的影响,为治疗神经损伤提供依据。
1 材料与方法
1.1 材料
选用健康2月龄雄性SD大鼠60只,体重(200±20)g,由河北医科大学实验动物中心提供。主要实验药品和试剂:吡非尼酮胶囊(艾思瑞),由北京康蒂药业有限公司生产;Ⅰ型胶原单克隆抗体和免疫组化SABC法试剂盒,均由武汉博士德生物制剂公司提供;VikingQuest型肌电诱发仪(Nicolet公司,美国)。
1.2 方法
1.2.1 模型制作与分组
SD 大鼠5%氯胺酮肌内注射麻醉,用量100 mg/kg[9],俯卧位固定大鼠,无菌条件下暴露右侧坐骨神经,于梨状肌下缘1 cm无明显分支处横断坐骨神经,随后行神经外膜端端吻合术,以吻合口工整、神经干无扭转、神经外膜稍外翻、神经束无膨出为吻合标准。同一组实验人员操作。术后1 d随机分为对照组、低剂量组和高剂量组,每组20只。
1.2.2 给药方法
准确称取定量PFD,溶于等量生理盐水中,对照组、低剂量组、高剂量组分别按0mg/kg、25 mg/kg、100mg/kg剂量给予吡非尼酮混悬液灌胃[10-11]。PFD在水溶液中易析出,故均现用现配。检验符合方差齐性,采用Tukey法进行统计学处理。<0.05为差异有统计学意义。
2 结果
2.1 坐骨神经功能指数(SFI)
术后第4周,三组之间两两比较差异均无统计学意义(P>0.05);术后第 12周,低剂量组优于对照组(P<0.01),高剂量组优于低剂量组(P<0.01)。相关数据见表1。
1.3 观察指标
1.3.1 坐骨神经功能指数
坐骨神经功能指数(sciaticnervefunctionalindex,SFI)是评价坐骨神经损伤后神经再生与功能恢复的可靠指标。采用自制长60 cm、宽20 cm、高10 cm 的大鼠足印行走箱,盒底铺等长等宽的白纸。大鼠双后肢用墨汁染色,范围双踝关节至双足。使大鼠自行在行走箱两端行走,清晰记录双后肢留下的足印(4~5个即可)。对于每只大鼠的正常足足印(Z)和损伤足足印(S),选择清晰的印迹测量3个指标:A(足印长度);B(足印宽度);C(中间三趾宽度)。通过Bain 公 式:SFI=109.5(SB ZB)/ZB 38.3(SA ZA)/ZA+13.3(SC ZC)/ZC 8.8。计算得出实验数据,SFI=0代表功能正常,SFI= 100代表功能完全丧失[12]。
1.3.2 神经电生理检测动作电位
测定 SFI后,分别于术后第4、12周通过肌电图记录仪记录大鼠坐骨神经动作电位波幅、传导速度、潜伏期。于肌腹中插入记录电极,在损伤神经段的近端及远端分别放置电极,且远、近端放置电极的距离大于5 mm,参考电极距记录电极5 mm,用Viking Quest型肌电诱发仪进行复合肌肉动作电位检测,刺激量为5 mA,刺激时间0.2 ms,刺激频率为1 Hz,连接计算机记录动作电位波幅、传导速度、潜伏期。
1.3.3 Ⅰ型胶原蛋白免疫组织化学染色
术后第4、12周,过量麻醉处死大鼠并暴露右侧坐骨神经。以吻合口为中心切取坐骨神经1.5cm,经标本固定—乙醇梯度脱水—二甲苯透明—石蜡包埋,切片厚4m,采用SABC法,染色方法按照试剂说明书步骤进行,DAB显色,脱水封片,光学显微镜下观察。
采用美国 Image-pro plus 6.0软件对Ⅰ型胶原蛋白免疫组化切片进行图像分析。
1.4 统计学分析
采用 SPSS 25.0软件进行统计学分析,数据以均数±标准差表示。各组实验数据经K-S检验符合正态分布,Levene
表1 术后第4、12周各组SFI()
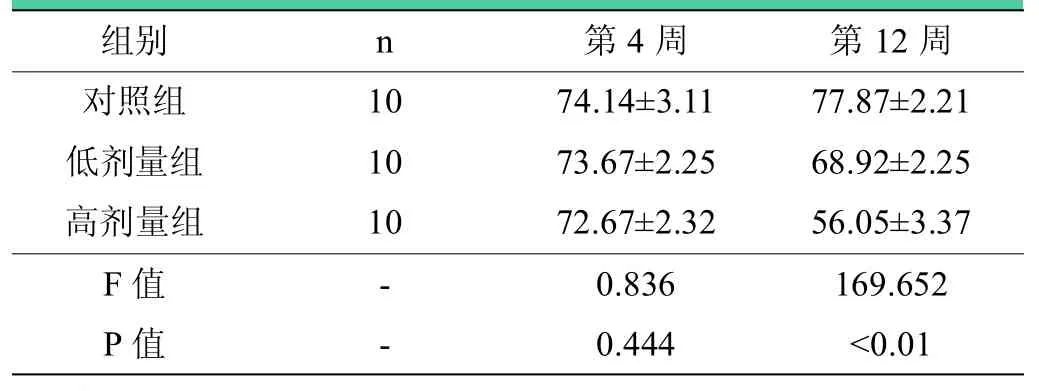
表1 术后第4、12周各组SFI()
注:术后第4周,三组之间两两比较差异均无统计学意义(P>0.05);术后第12周,三组之间两两比较,差异有统计学意义(P<0.01)。
组别 n 第4周 第12周对照组 10 74.14±3.11 77.87±2.21低剂量组 10 73.67±2.25 68.92±2.25高剂量组 10 72.67±2.32 56.05±3.37 F值 - 0.836 169.652 P值 - 0.444 <0.01
2.2 神经电生理检测
术后第4周,三组之间神经传导速度、波幅、潜伏期两两比较,差异均无统计学意义(P>0.05),见表2;术后第12周,与对照组相比,低剂量组和高剂量组神经传导速度显著增快(P<0.05),潜伏期缩短(P<0.05),波幅升高(P<0.05),且高剂量组优于低剂量组(P=0.016),见表3。
表2 术后4周各组大鼠坐骨神经电生理分析结果()
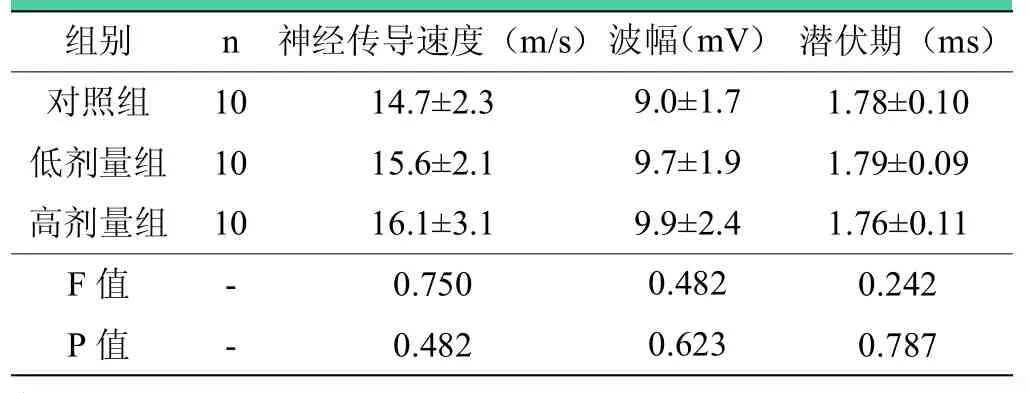
表2 术后4周各组大鼠坐骨神经电生理分析结果()
注:术后4周,三组之间神经传导速度、潜伏期、波幅两两比较,差异均无统计学意义(>0.05)。
组别 n 神经传导速度(m/s) 潜伏期(ms)对照组 10 14.7±2.3 1.78±0.10低剂量组 10 15.6±2.1 1.79±0.09高剂量组 10 16.1±3.1 1.76±0.11 F值 - 0.750 0.242 P值 - 0.482 0.787波幅(mV)9.0±1.7 9.7±1.9 9.9±2.4 0.482 0.623
表3 术后12周各组大鼠坐骨神经电生理分析结果()
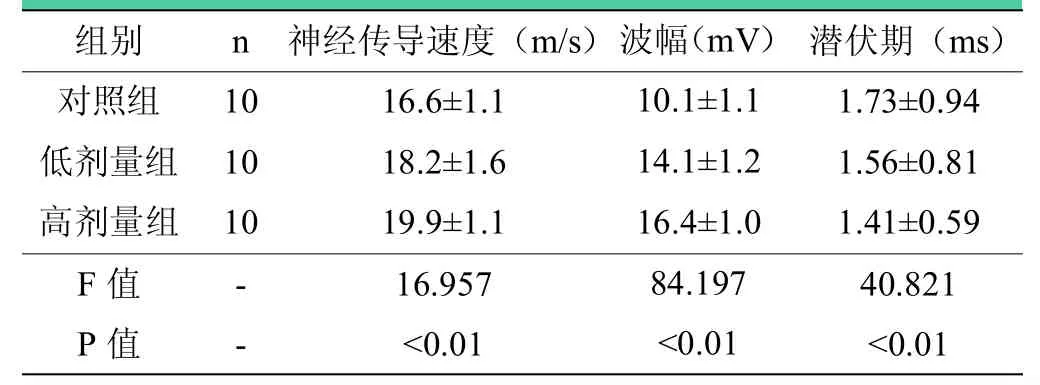
表3 术后12周各组大鼠坐骨神经电生理分析结果()
注:术后12周,三组之间神经传导速度、潜伏期、波幅两两比较,差异均有统计学意义(P<0.05)。
组别 n 神经传导速度(m/s) 潜伏期(ms)对照组 10 16.6±1.1 1.73±0.94低剂量组 10 18.2±1.6 1.56±0.81高剂量组 10 19.9±1.1 1.41±0.59 F值 - 16.957 40.821 P值 - <0.01 <0.01波幅(mV)10.1±1.1 14.1±1.2 16.4±1.0 84.197<0.01
2.3 Ⅰ型胶原蛋白免疫组织化学染色及图像分析
镜下可见胶原纤维被染成棕黄色,低剂量组(见图1)和高剂量组(见图2)吻合口处Ⅰ型胶原蛋白增生少,神经纤维排列整齐,空泡变性少见,且高剂量组更显著;对照组Ⅰ型胶原蛋白在吻合口处有明显增生,有的甚至形成胶原团块,神经纤维稀疏,组织间存在广泛空泡变性(见图3);图像分析表明,术后第4周,与对照组相比,低剂量组和高剂量组神经吻合口处Ⅰ型胶原蛋白沉积量明显减少(P<0.01),低剂量组与高剂量组相比,差异无统计学意义(P=0.893);术后第12周,与对照组相比,低剂量组和高剂量组神经吻合口处Ⅰ型胶原蛋白沉积量明显减少(P<0.01),且高剂量组比低剂量组减少更明显(P=0.011)(见表4)。
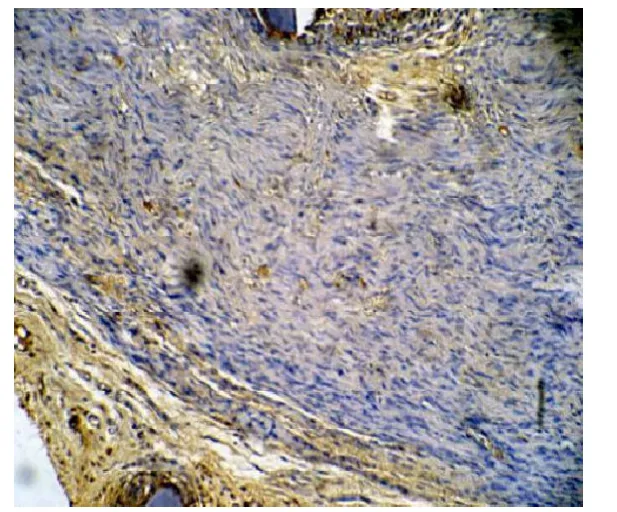
图1 Ⅰ型胶原纤维免疫组化染色:低剂量组(×100,纵切)
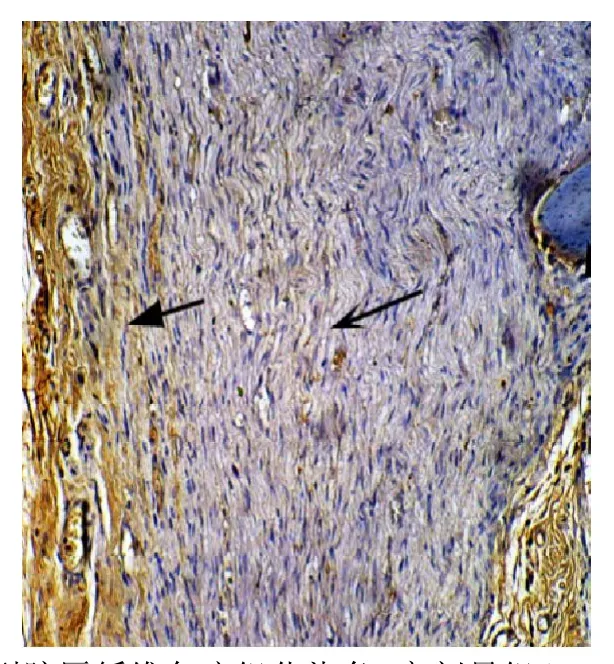
图2 Ⅰ型胶原纤维免疫组化染色:高剂量组(×100,纵切)

图3 Ⅰ型胶原纤维免疫组化染色:对照组(×100,纵切)
表4 术后第4、12周各组Ⅰ型胶原蛋白在损伤处面积百分比(,%)
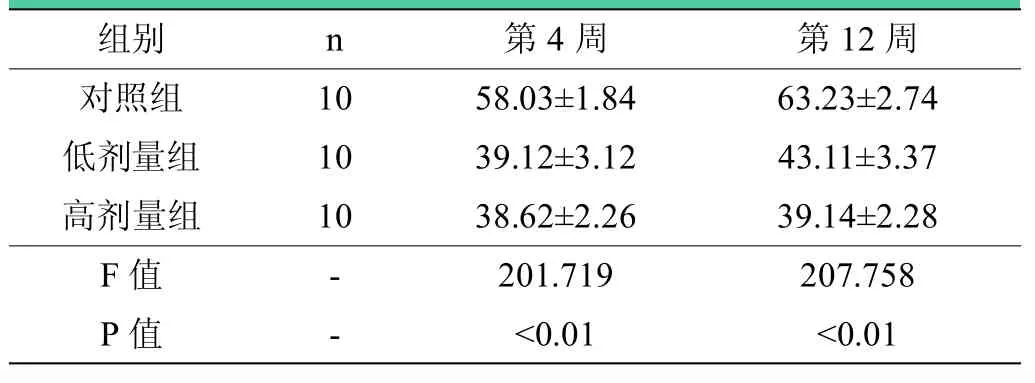
表4 术后第4、12周各组Ⅰ型胶原蛋白在损伤处面积百分比(,%)
注:术后第4周,低剂量组和高剂量组与对照组比较<0.01;高剂量组与低剂量组比较=0.893;术后第12周,三组之间两两比较,差异有统计学意义(P<0.05)。
组别 n 第4周 第12周对照组 10 58.03±1.84 63.23±2.74低剂量组 10 39.12±3.12 43.11±3.37高剂量组 10 38.62±2.26 39.14±2.28 F值 - 201.719 207.758 P值 - <0.01 <0.01
3 讨论
各种原因引起的周围神经损伤,在神经修复的过程中神经吻合口处不可避免会形成瘢痕。局部微环境中存在的细胞因子(growthfactor,GF)等生物活性物质在瘢痕的形成中扮演着重要角色,该过程中有多种生长因子的参与,其中转化生长因子 1(transforming growth factor1,TGF 1)是最强有力的促纤维化细胞因子之一[13-14],与瘢痕形成过程关系最密切,它通过促进成纤维细胞活化增殖,影响以Ⅰ型胶原蛋白为主的瘢痕组织的形成[15-16]。研究发现,TGF 1在瘢痕疙瘩组织中呈高表达[17],TGF 1抗体能降低 TGF 1水平,减少I型胶原蛋白沉积,从而抑制瘢痕形成[18]。本实验结果表明,低剂量组和高剂量组Ⅰ型胶原蛋白沉积量与对照组相比明显减少(P<0.01),且随着用药时间的延长,术后12周,高剂量组Ⅰ型胶原蛋白沉积量少于低剂量组(P=0.011)。笔者通过对大鼠的神经电生理和足迹分析发现,低剂量组和高剂量组大鼠神经功能恢复情况明显优于对照组(P<0.01)。这与前人通过利用抗TGF 1抗体抑制TGF 1减少神经瘢痕中胶原蛋白沉积的结果相符合[4]。蓝蔚等[5]也证实,PFD对人增生性瘢痕成纤维细胞胶原蛋白的分泌有明显的抑制作用。周乾坤利用地塞米松、曹鹏利用羊膜等通过减少瘢痕形成从而促进神经功能恢复也取得了满意效果[19-20]。
PFD作为一种有效的细胞因子抑制剂[21-22],通过抑制TGF 1使成纤维细胞增殖受抑制,减少I型胶原的合成[23-24],最终促进神经功能的恢复。需要注意的是,瘢痕形成是创伤修复过程中重要的一环,适量的 TGF 1有利于损伤修复和伤口愈合,过多的 TGF 1则会影响瘢痕增生和纤维化,在周围神经损伤后不利于神经的再生[4],影响功能恢复。本实验仅是证明了PFD能够通过抑制TGF 1减少成纤维细胞增值,最终减少瘢痕形成,关于PFD如何能在即不影响伤口的愈合,又能促进神经功能恢复的最适浓度,我们还需要在未来的研究中进一步探讨。
临床工作中,常遇到神经卡压综合征的患者,如腕管、肘管综合征,术中发现神经周围瘢痕形成越严重的患者,临床症状越严重,术后恢复越缓慢。有些尺神经前置术后半年小鱼际萎缩返院手术的患者,术中发现尺神经前置后,神经周围瘢痕增生严重,严重卡压尺神经,导致神经水肿。一些外伤病人,即使做了神经吻合术后,由于瘢痕的大量增生卡压神经,神经功能的恢复也不甚理想,严重影响患者生活质量。如何减少瘢痕形成是困扰医学界的难题,目前主要的治疗方式有中药制剂、放射疗法、手术治疗、激素疗法、物理压迫等,但效果欠佳。PFD抗纤维化疗效肯定,本实验为利用细胞因子抑制剂PFD抑制神经瘢痕形成,促进神经功能恢复提供了动物实验依据,为药物治疗周围神经损伤提供了更多思路。下一步笔者将深入分析其信号传导通路,建立更多动物模型与现有治疗方法优劣进一步比较,为PFD临床治疗周围神经损伤提供更充实的依据,为因神经瘢痕增生而影响功能恢复的患者提供更多有效治疗方法。
