过表达SlMYB75 对番茄幼苗、果实及种子的影响
2020-01-01徐志璇王丽娜陈春花任仲海
张 振,徐志璇,王丽娜,李 强,陈春花,任仲海
山东农业大学园艺科学与工程学院,山东果蔬优质高效生产协同创新中心/农业部黄淮地区园艺作物生物学与种质创制重点实验室,作物生物学国家重点实验室,山东 泰安271018
番茄(Solanum lycopersicum)是世界范围内的重要经济作物之一。MYB 转录因子参与植物的生长调节、对生物和非生物胁迫的响应等。在拟南芥和水稻中,MYB 家族已被鉴定和研究[1,2]。拟南芥R2R3-MYB 转录因子MYB15 参与ABA 信号转导,MYB15过表达株系对ABA 的敏感性增强,抗逆性增强[3]。生长素作为一种重要的激素,在顶端优势、调控生长及向性等方面有重要作用,拟南芥转录因子MYB77 响应生长素信号,在MYB77突变体中生长素应答基因的表达量显著下降[4]。研究表明,拟南芥AtMYB33 蛋白能够结合在花分生组织特性基因LEAFY启动子8 bp 的序列上,在开花时调控GA 信号[5]。拟南芥R2R3MYB 蛋白FLP 与MYB88 共同调控生长素输出载体基因PIN从而来影响根系的向重力性[6]。已有研究证明番茄中MYB74、MYB92、MYB78、MYB102、MYB62、MYB2、MYB64、MYB116、MYB113、MYB11能够被NaCl 所诱导[7]。番茄SLFSM1 是果实特异的MYB 类转录因子,它可以与FSB1和另一个MYB 转录因子形成三重复合物共同调控细胞的扩增,在SLFSM1高量表达番茄株系中,果实小、中果皮薄、中果皮细胞较小,且还抑制了下胚轴子叶细胞的伸长[8]。有研究报道,拟南芥AtMYB30 转录因子,可以影响ANNs 蛋白介导的特异的胞内钙信号的产生,从而调控植物响应氧化胁迫和热胁迫[9]。拟南芥AtMYB97,AtMYB101和AtMYB120能够调控花粉管接受花粉,从而影响受精作用[10]。过表达菊花CmMYB2植株较野生型开花延迟,叶片数目增多,在拟南芥中过表达CmMYB2,能够增强转基因拟南芥对干旱和盐胁迫的耐受性[11]。
在番茄中过表达MYB75能够增强番茄的抗热性,在烟草中过表达MYB75能够增强烟草抗冷性[12],且MYB75在烟草中异源表达和番茄中过表达都能够分别增加烟草和番茄花青苷的合成,并增强植株的非生物胁迫能力[13]。前人研究表明,在番茄中过表达MYB75能改变果实颜色,Kiferle 等在Ailsa Craig(AC)中过表达MYB75使果实颜色变为紫色;孟夏等在中蔬6 号中过表达MYB75能使果实颜色由红色变为橙黄色,类胡萝卜素含量显著提高。
本文发现在AC 中过表达SlMYB75能够改变果实颜色和大小,种皮以及幼苗下胚轴颜色也亦明显变化,且能够提高果实含糖量以及果实硬度等。这为进一步研究SlMYB75基因的功能奠定了基础。
1 材料与方法
1.1 试验材料
以AC 和AC 为背景过表达SlMYB75的转基因番茄为实验材料,分别培养于山东农业大学园艺试验站、山东农业大学本部科技创新大楼植物培养室以及光照培养箱中。本研究所使用的的烟草为实验室保存的本生烟,培养于山东农业大学本部科技创新大楼植物培养室。
本试验所用的大肠杆菌(E.Coli)菌株为DH5α,购自北京全式金生物技术有限公司;农杆菌菌株为LBA4404,由本实验室自行保存。本实验所用的载体为克隆载体pEASY-Blunt,购自北京全式金生物技术有限公司;表达载体pBI121 由本实验室自行保存。
1.2 总RNA 的提取以及实时荧光定量PCR 分析
采用TRIZOL 法来进行转基因番茄各组织的RNA 提取,以提取的总RNA 为模板,按照北京全式金生物技术有限公司EasyScript One-Step gDNA Removal and cDNA Synthesis Super mix 试剂盒说明书进行。PCR 反应体系为:1 μL Anchored Oligo(dT)18Primer(0.5 μg/μL),10 μL 2×ES Reaction Mix,1 μLEasyScriptRT/RI Enzyme Mix,1 μL gDNA Remover,水与RNA 共7 μL。PCR 反应程序为:42 ℃15 min,85 ℃5 s;PCR 产物1%琼脂糖凝胶电泳。荧光定量PCR 使用的仪器为BIO-RAD IQ5,所有PCR 反应都设3 次重复。PCR 反应体系为:2×Realtime PCR Super mix 10 μL,上、下游引物浓度为0.5 μmol·L-1,模板1 μL,加去离子水至20 μL。PCR 反应程序为:95 ℃预变性1 min,95 ℃15 s,60 ℃15 s,72 ℃30 s 40 个循环[14]。
1.3 转基因番茄果实可溶性糖含量的检测
取成熟期转基因和非转基因果实各30 个,用糖度计进行检测果实含糖量并进行统计,记录每个果实含糖量。本文所有多重比较分析方法均为LSD 单因素方差分析,P<0.05 为显著性差异,P<0.01为极显著性差异。
1.4 过表达载体的构建
克隆的含有BamHI 和SalI 酶切位点的SlMYB75的CDS 片段连接到pEASY 克隆载体上,连接后进行大肠杆菌DH5α的转化、用PCR 技术进行阳性克隆菌落的筛选、加入相应抗性激素进行摇菌、之后送铂尚公司进行序列测序、再提取质粒、用限制性内切酶BamHI 和SalI 分别酶切测序正确的克隆载体质粒和pBI121 表达载体质粒。通过琼脂糖凝胶电泳,在紫外灯下切去胶片段,用试剂盒进行目的条带的回收,用T4连接酶将载体与目的片段25 ℃连接并转化大肠杆菌。进行PCR 检测后选阳性菌点、进行质粒提取,再进行酶切验证,根据测序结果与已知序列比对确认,然后用电击转化法转入农杆菌。
1.5 亚细胞定位
选取BamHⅠ和XhoⅠ两个限制性内切酶酶切位点,将SlMYB75基因从peasy-Blunt 载体切下,并用试剂盒进行回收,对pROKⅡ表达载体用相同的酶切位点进行酶切后回收,再用T4连接酶在25 ℃将两者进行连接,之后转化大肠杆菌,鉴定阳性克隆。构建pROKⅡ-SlMYB75-GFP 载体完成后通过冻融法将质粒pROKⅡ-SlMYB75-GFP 和p19 转入农杆菌LBA4404。在进行本生烟的侵染时,我们采用农杆菌注射法。挑取阳性克隆接种到含卡那霉素的LB 液体培养基(25 mg·L-1Rif,50 mg·L-1Kan),以每分钟220 rpm 在28 ℃振荡培养培养箱震荡培养12 h。之后将以上两种农杆菌菌液在4000×g 的水平离心机中离心10 min,悬浮(悬浮缓冲液:10 mmol·L-1MgCl2,10 mmol·L-1MES,150 μmol·L-1As)。p19 的菌液与pROKⅡ-SlMYB75-GFP 菌液等体积混合成一管溶液,在分光光度计仪器中测定OD600值,并使其在在0.6~0.8 之间。室温黑暗处静置3 h 后用去针头针管注射长势较好的烟草叶片,48~96 h 内观察结果。进行荧光观察时,要撕取出较薄的下表皮进行观察。GFP 经488 nm 激光激发,通过550~590 nm 滤镜后获得荧光信号[15]。
2 结果与分析
2.1 SlMYB75 蛋白结构域分析
为了解SlMYB75蛋白的功能结构域,利用SMART[16]工具分析,发现SlMYB75含有275 个氨基酸,包含两个典型的SANT 结构域,构成了经典的R2R3MYB 结构[17]。且含有两个简单的未知功能结构域,根据以上分析结果,利用IBS.1.0 软件绘制如图1 所示SlMYB75结构:
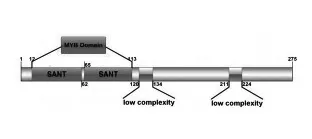
图1 SlMYB75 蛋白结构域Fig.1 SlMYB75 protein domain
2.2 SlMYB75 的亚细胞定位
为了明确SlMYB75蛋白在细胞中的作用部位,利用农杆菌介导的瞬时转化法,将培养好的带有SlMYB75与GFP 融合蛋白载体的农杆菌注射到烟草叶片,培养两天后在显微镜下观察融合蛋白在烟草叶片细胞中的分布部位情况。以空载体注射烟草的结果作为对照。结果显示:SlMYB75蛋白定位在细胞核中,说明该蛋白主要在细胞核中表达(图2)。

图2 SlMYB75-GFP 在烟草叶片细胞中的定位(标尺长度=20 μm)Fig.2 Localization of SlMYB75-GFP in tobacco leaf cells(Ruler length=20 μ m)
2.3 SlMYB75 基因的遗传转化、过表达株系表达量检测以及组织表达特异性分析
为了探究SlMYB75基因在番茄中的功能,我们构建了过表达载体,并在番茄中进行遗传转化。取野生型(wild type,WT)和转基因植株两个株系OE1 和OE2 的嫩叶,通过Trizol 法提取RNA,反转录为cDNA,再通过荧光定量检测SlMYB75表达量。在两个转基因株系中,该基因表达量均显著高于WT(图3a);另外,为了检测SlMYB75基因在各组织中表达情况,分别取WT 与过表达SlMYB75株系幼根、嫩茎、幼叶、花(开花当天)、绿熟期果实,通过Trizol 法提取RNA,反转录为cDNA,通过荧光定量检测过表达株系中SlMYB75基因在各个组织中的表达量,发现SlMYB75基因在果实中表达量较高,在花中表达量较低(图3b)。
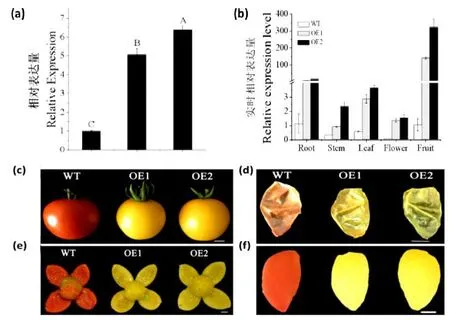
图3a SlMYB75 在WT 和过表达株系中的表达量(P<0.01);图3 b SlMYB75 基因的组织表达分析;图3 c 果实整体颜色观察;图3 d 果实外果皮颜色观察;图3 e 过表达与WT 果实解剖观察;图3 f 果实果肉颜色观察(标尺=1 cm)Fig.3a Expression analysis of SlMYB75 in wild type and transgenic lines (P<0.01);Fig.3 b Tissue-specific expression profiles of SlMYB75;Fig.3 c Observation of the overall fruit color;Fig.3 d Observation of fruit outer skin color;Fig.3 e Overexpression and WT fruit anatomical observation;Fig.3 f Observation of fruit pulp color(Bars=1 cm)
2.4 过表达SlMYB75 改变果实颜色
通过观察表型发现,过表达SlMYB75株系与WT 相比,完全成熟果实颜色发生明显变化,解剖并分离果皮、果肉,发现过表达株系果实的果皮和果肉颜色均由红色变为橙黄色(图3c-f)。
2.5 过表达SlMYB75 对果实重量以及含糖量影响
通过对果实重量测量统计,过表达株系完全成熟果实单果平均重量与WT 相比显著下降(图4a)。利用果实糖度计检测成熟期转基因与WT 番茄果实的含糖量,结果显示:转基因株系与WT 果实含糖量相比显著上升,可溶性糖含量提高约18%,且具有显著性差异(图4b)。利用硬度计检测成熟期转基因与WT 番茄果实的硬度,结果显示:转基因株系与WT 果实硬度相比显著上升。结果显示:转基因株系与WT 果实硬度相比显著上升,硬度提高约42%,且具有显著性差异(图4c)。
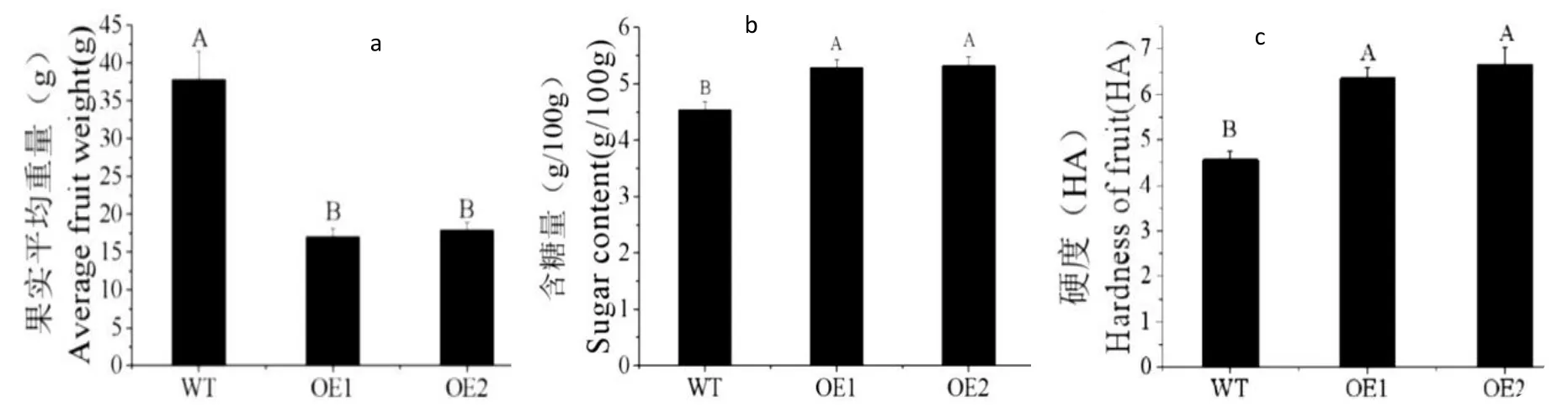
图4(a) SlMYB75 过表达株系与WT 完全成熟果实平均重量比较(P<0.01);图4 (b)SlMYB75 过表达株系与WT 完全成熟果实平均可溶性糖含量比较(P<0.01);图4 (c)SlMYB75 过表达株系与WT 完全成熟果实平均硬度比较(P<0.01);Fig.4(a) Average weight comparison between SlMYB75 overexpression lines and the total mature fruit of WT(P<0.01);Fig.4 (b)Average soluble sugar content comparison between SMYB75 overexpression lines and the total mature fruit of WT(P<0.01);Fig.4 (c)Average firmness comparison between SlMYB75 overexpression strain and WT fully mature fruit(P<0.01)
2.6 过表达SlMYB75 使果实外果皮细胞变小
通过扫描电镜观察发现,相同发育时期(完熟期)的过表达SlMYB75株系果实外果皮细胞的平均面积与WT 相比明显变小,通过扫描电镜拍照、Image.J 软件统计,表皮细胞面积显著下降(图5)。

图5a WT果实外果皮细胞,标尺=100 μm;图5 b,c SlMYB75 过表达转基因果实外果皮细胞标尺=100 μm;图5d 面积大小统计(P<0.01)Fig.5a:Scanning electron micrographs of wild-type fruit exocarp cells,bars=100 μm;Fig.5b-c: SlMYB75 over-expressed transgenic fruit outer rind cells,scanning electron microscope,Bars=100 μm;Fig.5d:picture shows area size statistics.(P<0.01)
2.7 过表达SlMYB75 株系种皮颜色与WT 存在明显差异,种子千粒重没有变化
将同时期收取的转基因与非转基因种子烘干后,通过观察发现,过表达株系种皮颜色明显深于WT 种皮。为了检测种子千粒重是否发生变化,随机挑选OE1、OE2 和WT 种子进行测重,结果显示:过表达SlMYB75并没有使种子千粒重发生改变(图6)。
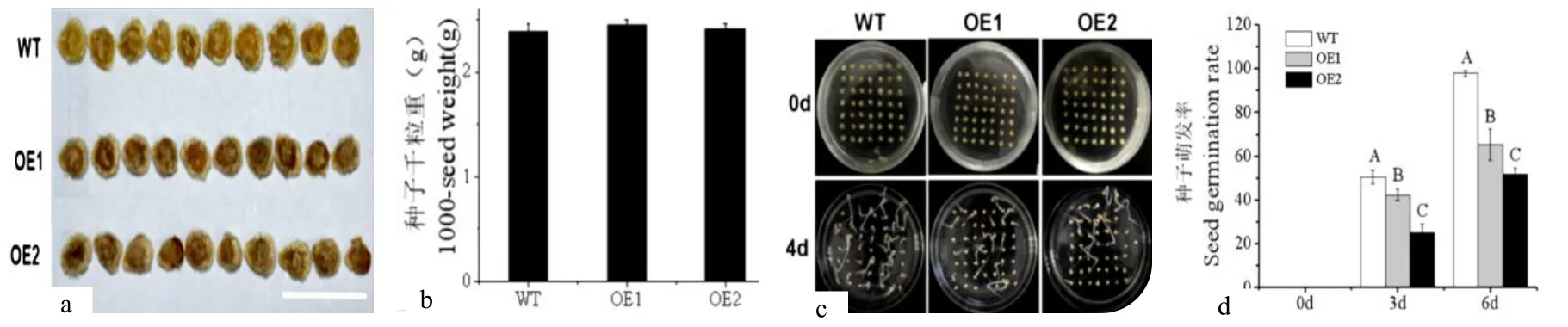
图6a 转基因与非转基因种子的颜色比较。标尺=1 cm;图6 b 转基因与非转基因烘干后的种子千粒重量化图;图6 c,d 转基因与WT 种子萌发率统计(P<0.01)Fig.6a:Color comparison between transgenic and non-transgenic seeds.(Bar=1 cm);Fig.6 b:Thousand seed weight after transgenic and non-transgenic drying;Fig.6 c,d:Germination rate statistics of transgenic and wild-type seeds(P<0.01).
2.8 过表达SlMYB75 株系种子萌发率降低
为了检测过表达株系种子萌发能力,取WT、OE1 与OE2 三个株系的种子,分别用75%酒精和4%次氯酸钠彻底消毒后,均匀播种于MS 固体培养基表面,放置于恒温培养箱(28 ℃)进行暗培养,每天观察拍照并统计种子萌发情况,统计结果如图6c,d,图6(c)为0~4 d 种子萌发情况,图6(d)为萌发率量化统计。结果显示:过表达株系种子萌发率显著低于WT,第6 d 时,WT 种子基本完全萌发,但转基因两个株系种子萌发率不超过70%,因此,过表达SlMYB75使种子萌发率显著下降。
2.9 过表达SlMYB75 株系幼苗下胚轴紫色消失
转基因与WT 幼苗下胚轴颜色有明显差异,WT 子叶下胚轴呈现紫色,而过表达转基因株系下胚轴没有紫色物质积累,紫色物质应是花青素,说明过表达SlMYB75抑制了花青素的合成或积累(图7)。
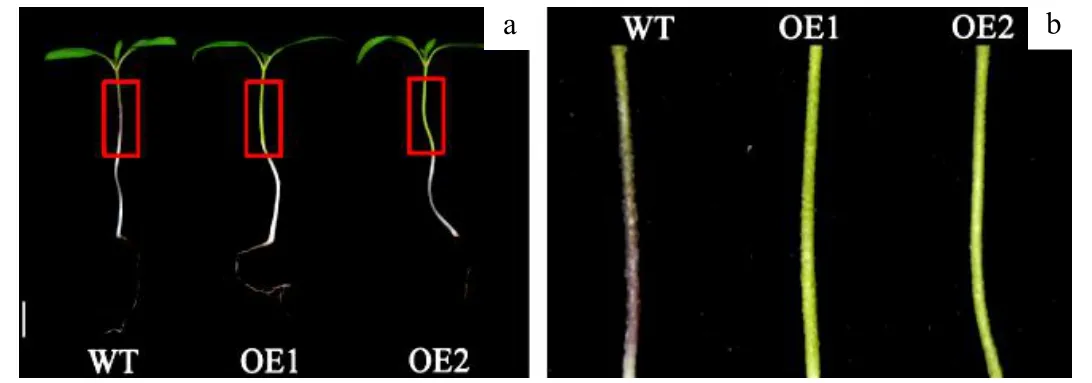
图7 转基因与WT 株系子叶下胚轴对比Fig.7 Comparison of cotyledon hypocotyls between transgenic and WT strains
3 讨论
MYB 作为植物转录因子中最大家族之一,主要参与调控植物激素的应答[18]、植物的非生物胁迫响应[19]、调控植物的形态建成[20]、调控植物次生代谢反应[21,22]等过程。本文通过组织表达特异性分析发现,SlMYB75基因在WT 番茄的根、叶和果实中表达量较高,在根和果实中最高;检测过表达株系各组织中SlMYB75的表达量,发现转基因株系植株的根、叶和果实表达量升高较显著,其中果实中表达量最高。另外,结合表达量(图3)与种子萌发率(图6c,d)发现,基因表达量越高种子萌发率越低。这说明SlMYB75基因可能在番茄种子萌发以及幼苗和果实的生长发育中起着重要的调控作用。
类黄酮物质的合成是由一系列转录因子包括MYB、bHLH和WD重复蛋白组成的三重复合物共同调节的[23]。目前,已有拟南芥AtMYB75/PAP1的研究报道,拟南芥中PAP1能够促进愈伤组织中花青苷的合成。在拟南芥中通过RNAi的方法沉默PAP1基因导致幼苗中花青苷的积累减少,另外,沉默PAP1基因的同源基因PAP2,MYB113和MYB114也会降低花青素的合成[24]。在啤酒花中异源表达AtPAP1/MYB75会显著增加啤酒花幼叶和花中花青素的积累[25]。研究表明,在番茄(AC)中过表达拟南芥At/PAP1/MYB75同源基因SlMYB75,会导致番茄花和果实等器官中花青素的积累,果实颜色由红色变为紫色[26]。孟夏等在中蔬六号中过表达SlMYB75使果实颜色由红色变为黄色,且花雄蕊中花青素积累增多。在本文中,在AC过表达SlMYB75使果实颜色由红色变为黄色,且幼苗子叶下胚轴中花青素积累减少(图7),该表型与之前研究不同。因此,SlMYB75基因在番茄中的功能有待进一步研究。
番茄果实内可溶性葡萄糖和果糖的合成是在果实的发育和成熟过程中进行的,蔗糖浓度在开花后会不断下降,在果实成熟期由于转化酶的作用使其持续保持较低水平[28,29,30]。我们利用糖度计检测成熟期转基因与WT 果实含糖量,结果显示(图4b),WT 番茄含糖量在4.53 g/100 g 鲜重,过表达SlMYB75转基因株系果实可溶性糖含量在5.31 g/100 g 鲜重,两者之间存在显著性差异。这说明过表达SlMYB75能够提高成熟番茄果实可溶性糖含量。通过种子萌发实验发现过表达SlMYB75株系种皮颜色变深(图6a),幼苗期子叶下胚轴与WT 相比紫色物质积累消失(图7),且种子萌发率降低(图6c,d)。这说明SlMYB75能够影响番茄种子和幼苗的发育。但是SlMYB75基因影响番茄果实含糖量以及对种子和幼苗发育的机理尚不清楚需进一步研究。
4 结论
番茄SlMYB75编码275 个氨基酸,该蛋白定位在细胞核中。过表达番茄SlMYB75能够改变成熟番茄果实颜色和大小,果实含糖量显著升高。种皮颜色加深,种子萌发率下降,且幼苗下胚轴颜色消失。这说明番茄SlMYB75基因能够在番茄种子、幼苗和果实中发挥作用。
