白藜芦醇对小鼠溃疡性结肠炎的影响*
2020-01-01吴亚俐刘凯丽崔香丽都新新张文琴
刘 鑫, 吴亚俐, 刘凯丽, 崔香丽, 都新新, 张文琴
(山西医科大学生理学系, 太原 030001)
溃疡性结肠炎(ulcerative colitis,UC)是一种慢性,特发性的炎症性疾病,其发病率在全球范围内呈上升趋势[1]。溃疡性结肠炎的炎症特点是发作和缓解反复进行,并引起粘膜溃疡。目前临床治疗溃疡性结肠炎的目标主要是缓解疾病症状和防止疾病复发[2]。研究表明,溃疡性结肠炎的患者患结直肠癌(colorectal cancer,CRC)的风险约比正常人群高数倍[3]。Wnt/β-catenin信号通路的激活是一种与损伤相关的反应,在结肠粘膜损伤修复中起着重要作用。溃疡性结肠炎损伤的粘膜中可检测到活跃的Wnt信号激活[4,5]。然而,Wnt通路长期、持续的激活对溃疡性结肠炎发展为溃疡性结肠炎相关结肠癌具有促进作用,这个过程可能经历炎症性不典型增生到肿瘤的进展过程[5]。Wnt信号通路的激活虽然是伤口愈合所必须的,但需要被平衡[5]。抑制过度活跃的Wnt信号有助于防止溃疡性结肠炎恶变。
溃疡性结肠炎的常规治疗药物有5-氨基水杨酸类,糖皮质激素类,免疫抑制剂类等。但是这些药物具有不同程度的副作用[6-10]。如治疗溃疡性结肠炎的一线药物美沙拉嗪可能引起腹泻、过敏、肾毒性反应和急性胰腺炎等[6-8]。糖皮质激素长期应用会导致全身不良反应[9]。硫锉嘌呤(免疫抑制剂类)长期应用可能会伴有感染、胰腺炎、头痛发热、肝损伤等不良反应的发生,甚至引发肿瘤[10]。因此,患者希望寻找成分更加天然和副作用小替代药物的研究备受关注。白藜芦醇(resveratrol,Res)是在葡萄、蔓越莓、桑树和花生等多种植物中发现的一种多酚类化合物,具有抗氧化、抗炎、抗肿瘤等多种生理效应[11]。作为一种成分天然的抗炎物质,白藜芦醇近年来被广泛应用于溃疡性结肠炎预防和治疗的研究[12,13]。然而,现有的白藜芦醇对于Wnt信号通路作用的研究大多是在结肠癌中进行的[14,15],白藜芦醇在溃疡性结肠炎中调控Wnt通路机制的研究仍然较少。
MicroRNA(miRNA)是进化上保守的短链非编码RNA,其在多种疾病的发生发展中发挥重要作用[16,17]。目前对于miRNA-31在溃疡性结肠炎中的研究相对较少。我们前期的基因芯片技术测定结果表明,miRNA-31在溃疡性结肠炎病人肠炎组织和正常组织中有差异性表达。此外,我们的前期动物实验苏木精-伊红染色法(hematoxylin-eosin staining,HE)染色结果表明,miRNA-31过表达小鼠葡聚糖硫酸钠盐(dextran sulfate sodium salt, DSS)诱发溃疡性结肠炎较control组小鼠严重(数据待发表)。此外,白藜芦醇能够下调HCT 116细胞miRNA-31的表达[18]。基于本课题组前期研究结果,本研究把miRNA-31作为靶点进一步研究其在溃疡性结肠炎中的表达并首次探讨其与经典Wnt信号通路关系。本研究使用DSS诱导的溃疡性结肠炎小鼠观察白藜芦醇对溃疡性结肠炎的作用,并初步观察白藜芦醇对溃疡性结肠炎的效应与Wnt/β-catenin信号通路及miRNA-31的关系,为白藜芦醇应用于溃疡性结肠炎的治疗提供新的思路。
1 材料与方法
1.1 动物与材料
无特定病原体(specific pathogen free,SPF级)雄性C57BL/6小鼠28只,6-8周龄,体质量为19~21 g,购自山西医科大学实验动物中心。人结直肠腺癌细胞系HCT 116细胞购自于中国科学院细胞库。DSS购自美国MP公司。白藜芦醇(纯度≥98%)购自美国sigma公司。羧甲基纤维素钠(carboxymethylcellulose sodium,CMC-Na)购自天津恒兴试剂公司。高铁饲料购自北京华阜康生物公司。转染试剂,RNA提取、反转录及扩增相关的试剂盒购自德国Qiagen公司。鼠、兔二步法免疫组化试剂盒购自北京中杉金桥生物公司。β-catenin兔单克隆一抗、低密度脂蛋白受体相关蛋白6(LDL receptor related protein-6,LRP-6)兔单克隆一抗、CyclinD1兔单克隆一抗、兔抗小鼠IgG二抗均购自于美国 Cell Signaling公司。c-Myc兔多克隆一抗、β-actin鼠单克隆一抗购自于武汉Proteintech公司,卷曲蛋白3(Frizzled-3,FZD3)兔单克隆一抗购自于美国Abcam公司,HRP 标记羊抗兔 IgG 二抗购自北京全式金公司。
1.2 小鼠DSS诱导溃疡性结肠炎模型的建立
28只6~8周龄的C57BL/6雄性小鼠随机分为4组(n=7):control组,DSS组,DSS+Res组,Res组。小鼠自由饮用无菌水或1% DSS 水,实验期3周,各组小鼠均进食高铁饲料。实验开始前进行称重并标记所有小鼠。其中control组和Res组小鼠每天饮用正常无菌水,饮用3周;DSS组和DSS+Res组小鼠第一日饮用1%DSS水,且每隔2 d换一次新鲜的1%DSS水,在第八日换为正常无菌水,一周后继续重复上述的1%DSS水喂养一周。在造模最后一周给予各组小鼠灌胃,其中control组和DSS组每天每只小鼠给予0.2 ml的0.5%CMC-Na灌胃,DSS+Res组和Res组小鼠每天每只给予0.2 ml的0.5%CMC-Na 溶解的8 mg/ml浓度的白藜芦醇灌胃。处理过程中,每天测小鼠体重,观察小鼠活动,粪便情况。处理结束后,小鼠称重,安乐死。取脾脏测量重量,摘取小鼠结肠测小鼠结肠长度,用1×磷酸盐缓冲液(phosphate buffer saline,PBS)冲洗,纵切,测量长度后放入4%多聚甲醛中浸泡24 h,卷成瑞士卷,之后进行石蜡包埋,切片,进行HE染色。其余结肠组织组织立即置-80℃超低温冰箱中保存待用。
1.3 细胞培养和转染
HCT 116 细胞系用含有10%的胎牛血清及1%双抗的高糖DMEM培养基于37℃及5%CO2孵箱中培养。细胞转染取对数生长期细胞以每孔6×105个细胞接种于六孔板,同时进行瞬时转染hsa-miR-31-5p的mimic和inhibitor,转染完成后把六孔板放入孵箱孵育48 h。细胞加药取对数生长期细胞以每孔5×105cells/ml细胞接种密度接种于六孔板,接种后把六孔板放入孵箱孵育,24 h后加药组每孔加入10 mg/ml白藜芦醇2 μl,再将六孔板放入孵箱孵育24 h。
1.4 小鼠结肠组织HE染色
结肠组织石蜡包埋后切5 μm片,依次将切片置于苏木素和伊红染液中染色,脱水透明,中性树胶封片。显微镜下观察各组小鼠结肠组织形态学改变。
1.5 小鼠结肠组织病理学评分
将结肠组织切片进行HE染色后,在显微镜下观察并进行组织损伤程度评分。此评分总共涉及四部分:炎症程度,炎症深度,隐窝损伤程度及炎症范围。组织损伤程度评分是通过以下前三项组织学特征中的每一项对应评分相加乘以病变范围百分比对应评分来确定的。炎症程度(0,无;1,轻度;2,中度;3,重度),炎症深度(0,无;1,黏膜;2,黏膜和黏膜下层;3,浆膜层)以及隐窝损伤程度(0,无;1,基底三分之一的隐窝受损;2,基底三分之二的隐窝受损;3,隐窝消失,仅有完整的表面上皮;4,全部隐窝及上皮破坏)。炎症范围百分比对应评分定义为:0,0%;1,1%~25%;2,26%~50%;3,51%~75%;4,76%~100%。因此,最小得分为0,最大得分为40分。
1.6 实时荧光定量PCR(quantitative real-time PCR,qPCR)检测小鼠结肠组织miR-31的表达
按miRNeasy MiniKit说明书提取小鼠结肠组织总RNA。用NanoDrop2000c分光光度计(Thermo,美国)测定RNA浓度和稳定性。应用miScript II RT Kit反转录试剂盒(Qiagen,德国),以200 ng总RNA反转录为cDNA。然后使用miScript SYBR Green PCR Kit扩增以mmu-miRNA-31为引物的miR-31的表达以及内参RNU6B(U6)的表达,反应体系在CFX96上机对miR-31和U6进行实时荧光定量PCR检测。根据miR-31和U6的阈值(CT)测定miR-31表达与U6表达的相对倍数变化。
1.7 Western blot检测组织和细胞蛋白的表达
采用Western blot测定小鼠结肠组织β-catenin和CyclinD1蛋白、 HCT 116细胞β-catenin、c-Myc、FZD3、LRP-6蛋白的表达。 取小鼠结肠组织约50 mg,用RIPA裂解缓冲液裂解蛋白;收集细胞转染六孔板和细胞加药六孔板的HCT 116细胞,用RIPA裂解缓冲液裂解蛋白。Bicinchoninic acid(BCA)法测定蛋白质总浓度;取含总蛋白 20 μg的结肠组织/HCT 116细胞匀浆液10 μl,聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,SDS-PAGE)后,用半干法将蛋白分子转移至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF)上; 5%脱脂奶粉( 0.25 g脱脂奶粉+5 ml TBST)封闭2 h,洗膜后分别注入羊抗兔β-catenin一抗(1∶1 000)、羊抗兔Cyclin D1一抗(1∶1 000)、羊抗兔c-Myc一抗(1∶1 000)、羊抗兔FZD3一抗(1∶1 000)、羊抗兔LRP-6一抗(1∶1 000)、羊抗小鼠 β-actin 一抗(1∶1 000)。2 h后回收一抗,洗膜后注入HRP标记羊抗兔IgG(1∶2 000)或兔抗小鼠IgG(1∶2 000)二抗,室温孵育1 h。之后化学发光法(Electro-Chemi-Luminescence,ECL)显影,Bio-RadImageLab凝胶成像系统显影,并对Western blot条带进行定量分析,确定目的条带的灰度值。
1.8 统计学处理

2 结果
2.1 小鼠一般反应及体重变化
与control组相比,DSS组小鼠造模期间体重下降明显,于第2周开始显著下降(P<0.05)。活动减少,于第2周开始出现稀便,第3周开始出现血便并持续不良状况。给予白藜芦醇后,小鼠体重下降较DSS组改善,于第3周开始具有显著性差异(P<0.05)。精神良好,活动一般,稀便减轻,大便成形(图1)。
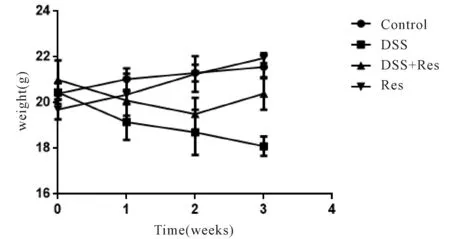
Fig.1Changes in body weight of mice during the establishment of mouse colitis model
DSS: Dextran sulfate sodium salt; Res: Resveratrol
2.2 小鼠结肠长度/体重比值变化
所有小鼠取结肠后,将结肠纵行切开,用大头针固定前端和后端使用直尺测量长度。以结肠长度/小鼠体重比值进行统计学分析。表1结果显示与control组相比,DSS组小鼠结肠长度/体重比值下降(P<0.05);而与DSS组相比,DSS+Res组小鼠结肠长度/体重比值趋于正常(P<0.05)。Res组小鼠结肠长度/体重比值与control组相比无显著差异(表1)。
2.3 小鼠脾脏重量/体重比值变化
切除小鼠脾脏并称重,初步观察小鼠免疫功能的变化。以脾脏重量/小鼠体重比值进行统计学分析。表1结果显示与control组相比,DSS组小鼠脾脏重量/体重比值上升(P<0.01);与DSS组相比,DSS+Res组小鼠脾脏重量/体重比值趋于正常(P<0.05)。Control组和Res组小鼠脾脏重量/体重比值无显著差异(表1)。
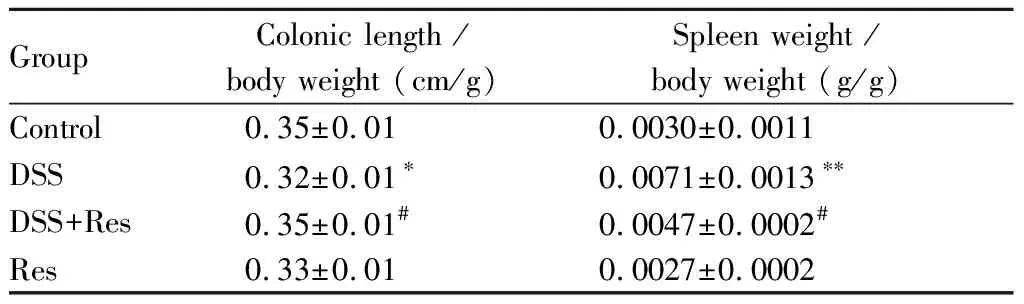
GroupColonic length / body weight (cm/g) Spleen weight / body weight (g/g)Control0.35±0.010.0030±0.0011DSS0.32±0.01∗0.0071±0.0013∗∗DSS+Res0.35±0.01#0.0047±0.0002#Res0.33±0.010.0027±0.0002
DSS: Dextran sulfate sodium salt; Res: Resveratrol
*P<0.05,**P<0.01vscontrol group;#P<0.05vsDSS group
2.4 小鼠结肠HE染色结果
四组小鼠的 HE 染色结果显示,DSS组小鼠肠炎炎症最严重,镜下可见黏膜和黏膜下层明显的中性粒细胞等炎性细胞的浸润,肠壁增厚,隐窝结构严重破坏,杯状细胞减少(图2B);给予白藜芦醇后,小鼠肠炎炎症较DSS组明显减轻,上皮结构基本完整,炎症细胞浸润减少(图2C)。通过计算各组的结肠组织损伤评分总分可以得出,DSS组小鼠组织损伤评分总分(14.40±4.45)较control组小鼠(1.09±0.99)高(P<0.01),给予白藜芦醇后,小鼠组织损伤评分总分(3.40±1.50)明显降低(P<0.01)。Res组(1.43±0.90)和Control组小鼠组织损伤评分总分无显著差异(图2D)。
2.5 小鼠结肠组织miRNA-31的表达
四组小鼠结肠组织qPCR结果显示:与control组相比,DSS组小鼠结肠组织中miRNA-31表达增多(P<0.05);与DSS组相比,DSS+Res组小鼠结肠组织miRNA-31表达减少(P< 0.05);与control组相比,Res组小鼠结肠组织miRNA-31表达减少(P<0.05)。说明溃疡性结肠炎小鼠结肠miRNA-31表达上调,而白藜芦醇可以下调小鼠结肠组织中miRNA-31的表达(表2)。

Fig.2HE staining of mouse colon
A: Colon of control group; Left is 100 ×; Right is 200 ×; B: Colon of DSS group; Left is 100 ×; Right is 200 ×; C: Colon of DSS+Res group, Left is 100 ×; Right is 200 ×; D: Colon of the Res group; Left is 100 ×; Right is 200 ×
2.6 小鼠结肠组织β-catenin、Cyclin D1蛋白的表达
我们检测了小鼠结肠组织wnt/β-catenin信号通路核心蛋白分子β-catenin以及Wnt通路靶蛋白Cyclin D1的表达。Western blot结果显示,与control组相比,DSS组小鼠结肠组织β-catenin(P<0.05)(图3A,表2),Cyclin D1(P<0.05,图3B,表2)蛋白表达增多;给予白藜芦醇后,DSS+Res组小鼠结肠组织β-catenin(P<0.05,图3A,表2),Cyclin D1(P< 0.05,图3B,表2)蛋白表达减少。Res组小鼠结肠组织β-catenin,Cyclin D1蛋白表达与control组相比无显著差异(图3A,B,表2)。
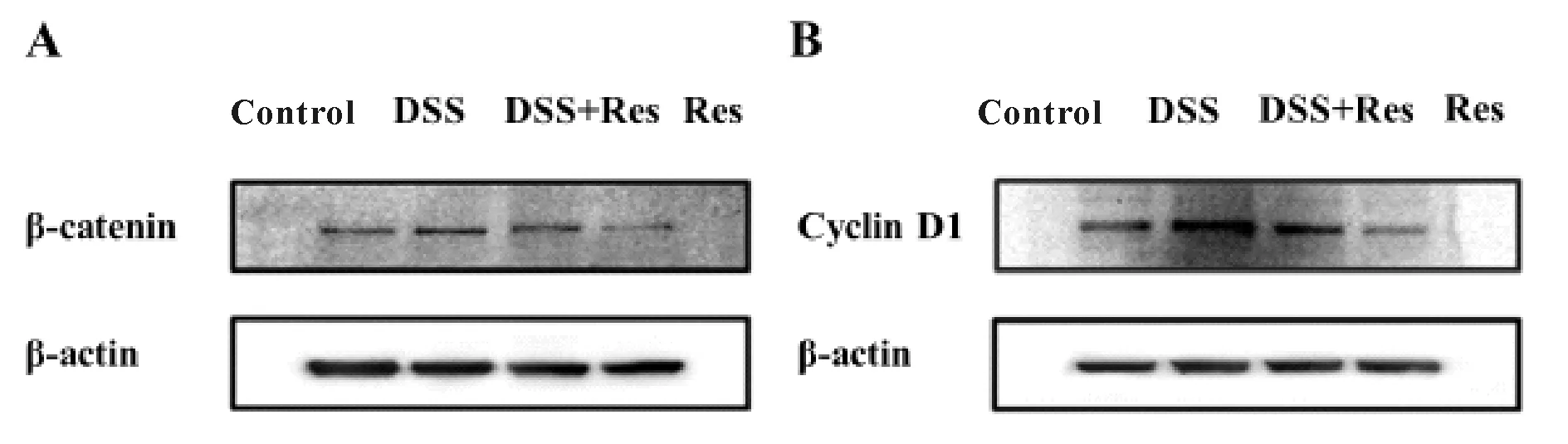
Fig.3Relative expressions of β-catenin, Cyclin D1 in mouse colon
A: Western blot results of β-catenin expression; B: Western blot results of Cyclin D1 expression; DSS: Dextran sulfate sodium salt; Res: Resveratrol

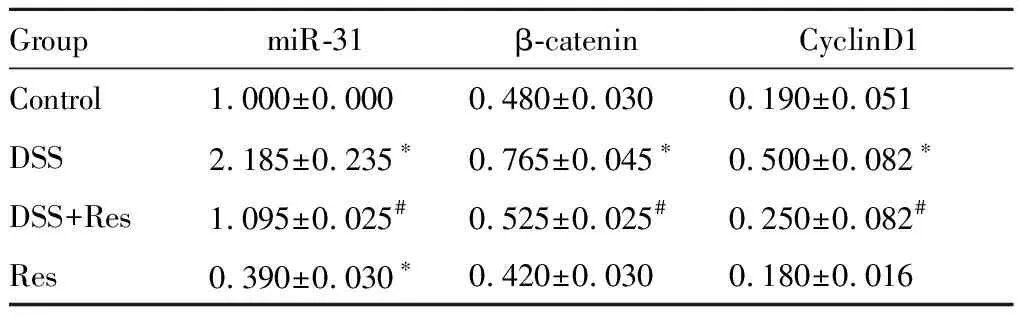
GroupmiR-31β-cateninCyclinD1Control1.000±0.0000.480±0.0300.190±0.051DSS2.185±0.235∗0.765±0.045∗0.500±0.082∗DSS+Res1.095±0.025#0.525±0.025#0.250±0.082#Res0.390±0.030∗0.420±0.0300.180±0.016
DSS: Dextran sulfate sodium salt; Res: Resveratrol
*P<0.05vscontrol group;#P<0.05vsDSS group
2.7 白藜芦醇对β-catenin、LRP-6、FZD3、c-Myc表达的影响
我们用HCT 116细胞研究了白藜芦醇对Wnt信号通路相关蛋白表达水平的影响。Western blot结果显示,与对照组Wnt信号通路核心蛋白β-catenin(0.623±0.189)、Wnt信号通路上游蛋白LRP-6(0.937±0.207)、FZD3(0.938±0.257)、以及Wnt信号通路靶蛋白c-Myc(0.767±0.071)表达相比,给予白藜芦醇后,β-catenin(0.268±0.078,图4A)、LRP-6(0.300±0.172,图4B)、FZD3(0.518±0.234,图4C)以及Wnt信号通路靶蛋白c-Myc(0.293± 0.026,图4D)的表达均显著受到抑制(P<0.05或 0.01),说明白藜芦醇下调了Wnt信号通路是通过LRP-6/β-catenin/c-Myc途径。为了观察这种调节与miR-31的关系,我们将HCT 116细胞敲低和过表达miR-31来观察Wnt信号的作用有何变化。结果表明细胞转染miRNA-31 inhibitor后,β-catenin蛋白表达(0.190±0.164)较control组(0.570±0.282)减少(P<0.05,图5),转染miR-31-mimic后,β-catenin蛋白表达(0.660±0.270)增加(图5)。说明β-catenin蛋白的表达与miRNA-31的表达相关。
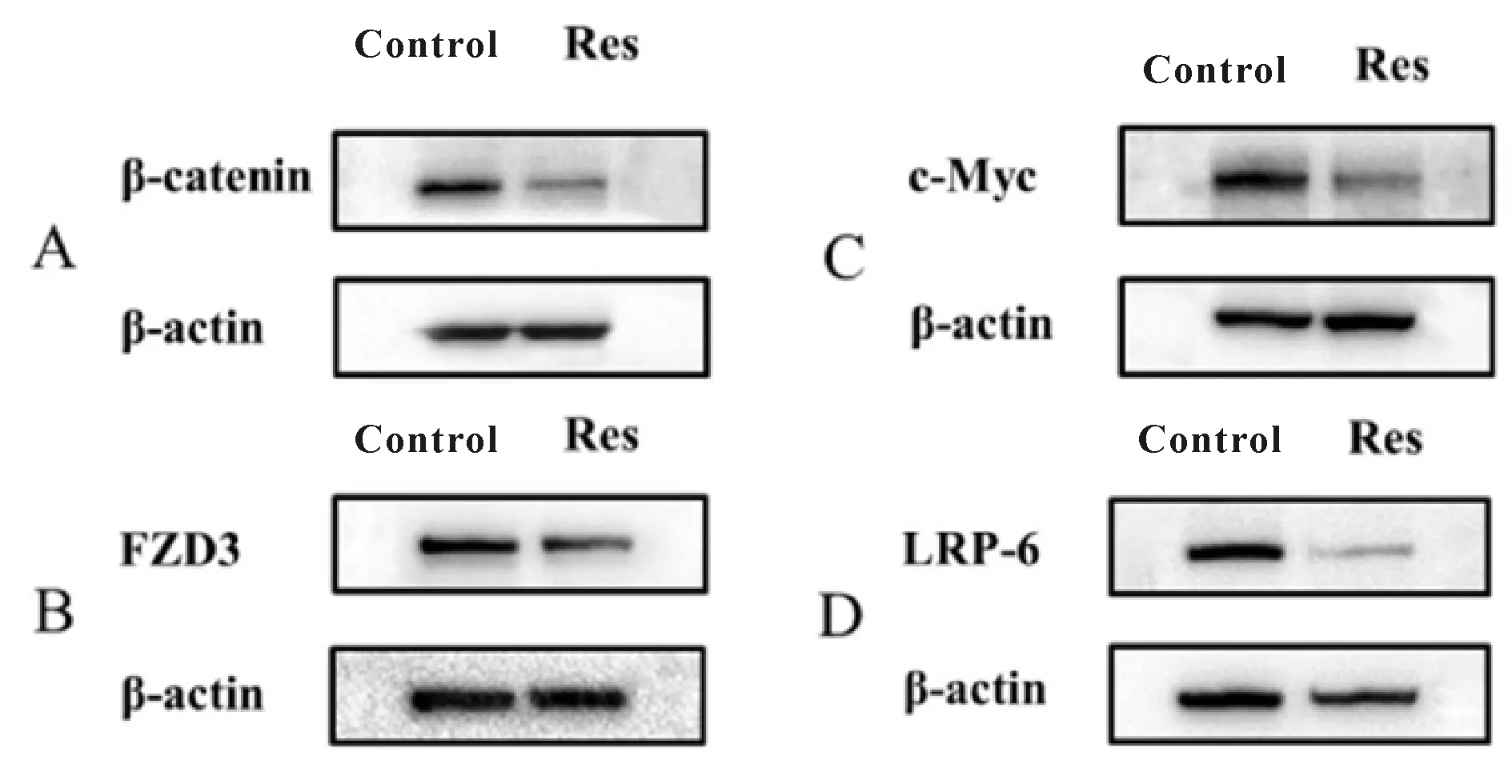
Fig.4Relative expressions of β-catenin, FZD3, c-Myc, LRP-6 in presence of resveratrol
A: Western blot results of β-catenin expression; B: Western blot results of FZD3 expression; C: Western blot results of c-Myc expression; D: Western blot results of LRP-6 expression; Res: Resveratrol
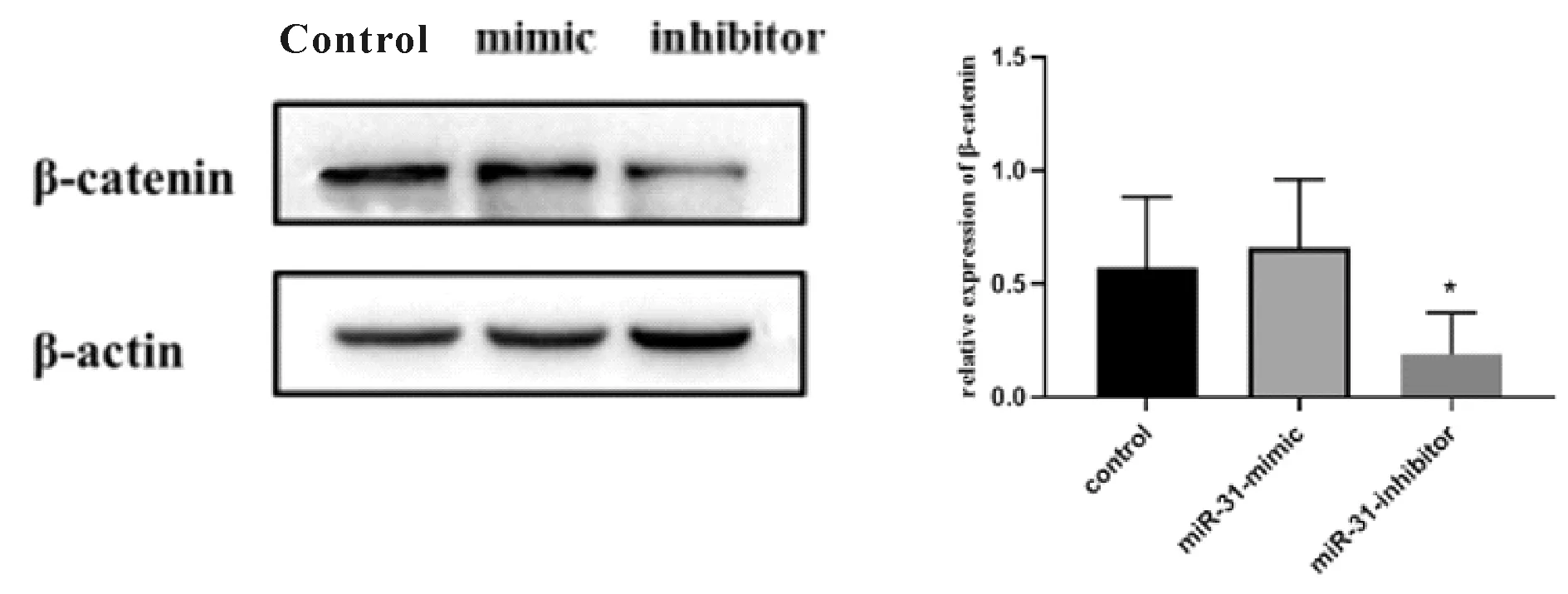
Fig.5MiR-31 inhibit β-catenin expression
Left: Effect of overexpression and inhibition of miRNA-31 on the expression of β-catenin; Right: Statistical result of the expression of β-catenin in presence and absence of miR-31; mimic: miR-31-mimic; inhibitor: miR-31-inhibitor
*P<0.05vscontrol group
3 讨论
白藜芦醇是一种天然多酚,具有抗氧化,抗炎,抗再灌注性心律失常和抗肿瘤的作用[11,19]。近年来被广泛应用于溃疡性结肠炎预防和治疗的研究[12,13,20-23]。临床研究表明,口服500 mg白藜芦醇6周后,至少部分通过减轻溃疡性结肠炎患者的炎症反应从而提高患者的生活质量和减轻临床疾病活动[20]。在溃疡性结肠炎的实验模型中,白藜芦醇能改善疾病活动指数,降低氧化应激和炎症生物标志物,提高组织抗氧化酶的活性[21-23]。本研究表明白藜芦醇能够减轻DSS诱导小鼠结肠炎模型的炎症症状及组织损伤。提示其可成为一个良好的抗结肠炎药物成分。
影响典型Wnt通路的关键因素是转录辅因子β-catenin的调控[24]。在不含Wnt配体的情况下,胞质β-catenin通过蛋白酶体降解而被去除。Wnt受体激活后,β-catenin的破坏复合物被迅速抑制,从而使β-catenin在胞质中积累并随后转移到细胞核。在这里,它与TCF/LEF家族转录因子合作,驱动各种靶基因如c-myc、cyclin D1的表达,这些基因调控细胞周期进程和细胞增殖[25]。Wnt信号促进正常结肠粘膜上皮细胞的定期更新,维护肠道粘膜屏障,帮助肠道抵抗恶劣的环境[26,27]。当肠道发生炎症时,除了TNF-α、NF-κB p65等表达增高外[28],Wnt信号在肠道上皮中强烈激活,从而促进上皮细胞增殖,修复受损区域[26]。然而,虽然Wnt信号通路的激活是粘膜上皮修复所必须的,但是溃疡性结肠炎患者肠上皮因慢性炎症而经历反复的损伤和修复。上皮屏障功能的反复破坏可能导致β-catenin活性和上皮增生的长期升高[24],从而有助于促进溃疡性结肠炎相关结肠癌的发展[27,29]。因此,在溃疡性结肠炎过程中平衡Wnt信号通路的过度激活有助于防止溃疡性结肠炎恶变[27-30]。本研究表明,在DSS诱导结肠炎小鼠的结肠组织和HCT 116细胞中,白藜芦醇能够减少Wnt/β-catenin信号通路核心蛋白分子β-catenin的表达。本研究还检测了白藜芦醇对经典Wnt信号通路其他相关蛋白表达的影响。LRP-6、FZD3是wnt/β-catenin信号通路的上游蛋白分子,正调控Wnt信号通路的激活。c-Myc 、Cyclin D1(细胞周期蛋白D1)是Wnt信号通路的靶蛋白,对增殖具有调控作用[31]。本研究发现在白藜芦醇的作用下,Wnt信号通路上游蛋白和靶蛋白均表达减少,进一步说明了白藜芦醇对经典Wnt信号通路的抑制作用。白藜芦醇的这一效应提示其可能有助于降低溃疡性结肠炎恶变的风险。
miRNA在多种人类疾病中发挥重要作用[16,17]。研究表明,miRNA-31在一些人类癌症包括结肠癌中上调[32,33],但其在溃疡性结肠炎中的作用目前研究较少。基于本课题组前期已有的实验结果[18],本研究在各组小鼠的结肠组织中测定miRNA-31的表达。结果表明miRNA-31在溃疡性结肠炎小鼠的结肠组织中表达上调,且白藜芦醇能够下调miRNA-31的表达。为了进一步研究miRNA-31的表达与Wnt信号的关系,本研究在HCT 116细胞中转染miRNA-31 mimic和inhibitor并检测Wnt信号核心蛋白分子β-catenin的表达。结果表明转染miRNA-31 inhibitor后,HCT 116细胞中β-catenin蛋白表达减少。这一结果至少提示β-catenin蛋白的表达与miRNA-31的表达有关,而进一步提示白藜芦醇对经典Wnt信号的抑制作用可能与其对miRNA-31表达的下调作用有关。
综上所述,本研究表明白藜芦醇能够改善溃疡性结肠炎炎症和组织损伤,下调结肠炎组织miRNA-31的表达和结肠Wnt信号,且白藜芦醇对Wnt信号的抑制作用可能与下调miRNA-31的表达有关。本研究为白藜芦醇应用于溃疡性结肠炎的治疗提供了新的思路。
