胰后入路拖出清扫与原位清扫脾门淋巴结在D2全胃根治术中的对比分析
2019-12-30彭孟寅刘世呈杨晓波
彭孟寅,刘 见,刘世呈,杨晓波,吴 淼
(宜宾市第二人民医院,四川 宜宾,644000)
近年,日本、韩国及我国等亚洲地区近端胃癌发病呈现上升趋势,在我国多数病例初诊已是进展期,进展期近端胃癌脾门淋巴结转移率高达5.8%~27.9%[1-3]。如何安全、有效地清扫脾门淋巴结一直是探讨的热点。目前已报道多种腹腔镜脾门淋巴结清扫方式,2008年Hyung首次报道中间入路法在胃癌根治术中原位清扫脾门淋巴结的应用[4],平均清扫脾门淋巴结2.7枚,但因不满足整块切除原则而应用较少。2012年李国新提出胰后入路法[5],但此法仅借助胰尾处后间隙,扩大胰腺与脾门之间的空间,以暴露脾门区视野进行原位清扫。2016年王伟提及多向清扫方式以完成脾血管及脾门部淋巴结的清扫[6],但因血管后方淋巴结清扫的争议及难度较大而较少应用。黄昌明提出的左侧入路法[7],平均清扫脾门淋巴结2.9枚,对于有固定手术团队且配合良好的医疗中心可控制副损伤的发生。不论哪种原位清扫方式均受限于脾门空间狭窄、部分视野不全,术中副损伤难以避免,且团队学习曲线较长。对于脾门血管后方淋巴结清扫的意义尚缺乏高质量循证医学证据[8],但依据肿瘤根治性手术原则,应尽可能清扫所有潜在转移风险的淋巴结。因此,我们基于上述难点与争议,对手术进行总结、膜解剖深层学习、结合既往开腹经验,提出胰后入路拖出式清扫脾门淋巴结:在保证手术根治性前提下,简化清扫步骤,有效控制脾门淋巴结清扫的副损伤。本文现对比分析此术式与原位清扫的短期疗效。
1 资料与方法
1.1 临床资料 2016年1月至2018年1月共纳入49例满足纳入标准的进展期近端胃癌患者。手术由同一术者完成。纳入标准:病理活检为腺癌;病灶位于上1/3;病理分期yT2~T4a;达根治性切除(R0)。排除标准:中转开腹;临床数据资料不全;残胃癌;精神类疾病。术前基本资料、手术数据、术后信息通过病历系统进行收集,基线资料包括年龄、BMI、ECOG评分、营养风险评分(NRS2002评分)、合并症等。术中资料包括手术时间、术中出血量、切缘等。临床数据资料的统计获得患者及家属同意,本项目获四川省宜宾市第二人民医院伦理委员会审核批准。
1.2 手术方法 全麻,患者取平卧位。脐下1 cm处建立10 mm观察孔,气腹压力维持在12 mmHg,常规探查肝、胆囊、脾脏、腹膜、盆腔等情况,无远处转移等情况后采取五孔法施术。术者立于左侧,助手立于右侧,扶镜手立于双腿之间。在胰腺下缘与肠系膜上血管交点打开融合筋膜(图1),进入胰后间隙(图2),向左侧及头侧进行拓展;助手以肠钳上抬胰腺、辅助维持适宜张力,保证走行在Gerota筋膜前方,跨层易损伤肾上腺、肾脏及其血管、生殖血管、输尿管等结构。正确层面内无血管、神经等重要结构,且助手在辅助视野显露过程中无需多余的动作转变,更不易损伤重要组织结构,可安全、高效地完成内侧至膈下动脉、头侧至贲门后、外侧至脾脏的游离,至此完成胰体尾、脾脏、小网膜囊完全游离。经腹小切口拖出游离的脾脏、胰体尾部、胃及网膜。此时脾脏、脾血管与胰腺相对位置保持原位(图3);直视下清扫脾门、脾血管及后方淋巴结(图4)。清扫后将脾脏放回脾窝(图5),注意避免术中脾血管扭转。术后切口见图6。
1.3 统计学处理 采用SPSS 24.0进行数据分析。服从正态分布的连续变量资料以均数±标准差表示。分类资料以构成比(%)表示。分类资料组间比较采取Pearson卡方检验或Fisher确切概率法;连续变量资料组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 基线资料的比较 两组患者性别、年龄、BMI及营养状况等基线资料差异无统计学意义,具有可比性,见表 1。

图1 胰腺下缘肠系膜上血管处打开融合筋膜 图2 沿后间隙游离

图3 腹壁小切口拖出胰腺体尾部及脾脏 图4 直视下完成脾门及脾血管远端淋巴结清扫

图5 脾脏放回腹腔 图6 术后愈合切口状况
2.2 手术相关指标的比较 两组病灶大小、腹壁切口长度、分期等差异无统计意义。11例腹腔探查见明显腹水,但脱落细胞检查均为阴性。纳入49例患者,共清扫1 425枚淋巴结;阳性377枚(26.5%),39例(79.6%)患者证实存在淋巴结转移。淋巴结总数 [(24.6±8.2) vs.(26.4±8.9),P=0.462]组间差异无统计学意义。与原位组比,拖出组脾门及脾血管淋巴结数量更多,阳性率更高。两组患者手术相关指标见表2。
2.3 术后短期结局 两组患者术后排气时间、进食时间、总费用等差异无统计意义,见表3。术后30 d内并发症依Clavin-Dindo进行分级[10]。住院总时间两组间差异无统计意义,但较以往报道长[5,7,11-12]。


组别性别[n(%)]男女年龄(岁)BMI吸烟[n(%)]饮酒[n(%)]NRS2002评分[n(%)]小于3分大于3分原位组21(84.0)4(16.0)61.0±10.121.2±4.018(72.0)10(40.0)17(68.0)8(32.0)拖出组18(75.0)6(25.0)60.2±10.522.5±3.113(54.2)17(70.8)14(58.3)10(41.7)t/χ2值0.6110.2961.2151.6760.6340.492P值0.4350.6240.8560.1960.4260.483
NRS 2002评分[9]于入院24 h内进行评分

组别手术时间(min)出血量(mL)病灶最大径(cm)切口长度(cm)腹水(n)淋巴结总数(n)脾门淋巴结总数(n)脾门淋巴结阳性(n)原位组248.0±71.0189.6±160.24.8±1.86.4±1.0524.6±8.22.0±1.30.8±0.8拖出组190.6±49.798.8±25.04.6±1.36.7±1.5626.4±8.93.8±2.61.4±1.2t/χ2值3.2632.7460.3030.9750.1760.7412.4920.933P值0.0020.0090.7630.3340.6750.4620.0070.028
续表2

组别脾血管淋巴结阳性(n)分化程度(n)中/高分化低分化T分期(n)T1T2T3T4N分期(n)N0N1N2N3TNM分期(n)aⅠ期Ⅱ期Ⅲ期原位组0.6±0.78171331845882617拖出组1.3±1.151912417622141617t/χ2值1.3250.7830.3518.6020.313P值0.010.3760.950.0650.852
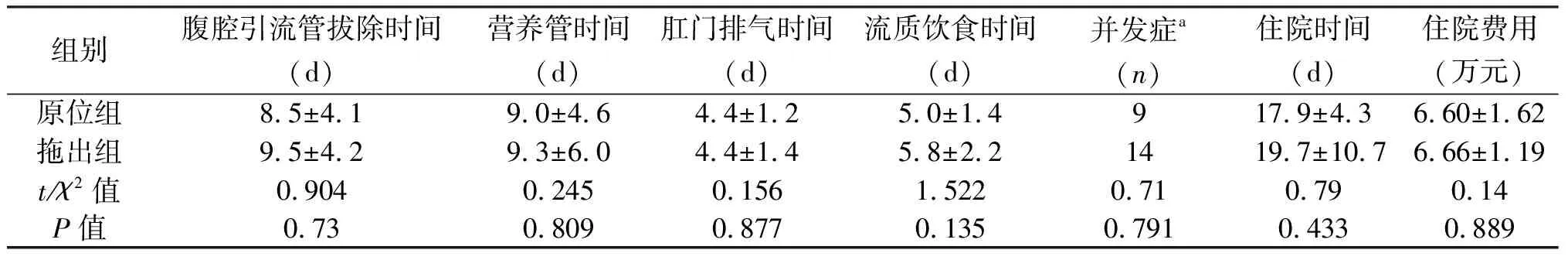
组别腹腔引流管拔除时间(d)营养管时间(d)肛门排气时间(d)流质饮食时间(d)并发症a(n)住院时间(d)住院费用(万元)原位组8.5±4.19.0±4.64.4±1.25.0±1.4917.9±4.36.60±1.62拖出组9.5±4.29.3±6.04.4±1.45.8±2.21419.7±10.76.66±1.19t/χ2值0.9040.2450.1561.5220.710.790.14P值0.730.8090.8770.1350.7910.4330.889
a术后30 d内并发症,Clavin-Dindo分级Ⅱ级及以上
3 讨 论
我国作为胃癌高发病率国家,进展期近端胃癌比例逐步上升[1],而淋巴结转移是胃癌生存预后独立危险因素[13],对于可切除的进展期近端胃癌,日本指南提出D2淋巴结清扫是控制局部复发、改善生存的基础[14-16]。手术方式的选择方面,达芬奇机器人系统可降低手术难度,但操作复杂且费用高,应用范围受限[17];腹腔镜胃癌根治术仍是主流选择,其中脾门淋巴结清扫是D2全胃根治术中探讨的热点与难点。
3.1 全胃切除术中脾门淋巴结清扫的发展历程 为保证淋巴结彻底清扫及微创手术理念的不断推行,手术方式不断改进。最初采取联合脾脏及胰腺尾部切除的方式,以达到清扫目的,因较高的术后并发症发生率、死亡率,以及近、远期疗效相较保脾清扫并无获益[18-19],此术式适应证逐步缩小。腹腔镜下保脾脾门淋巴结清扫术逐渐得到推广,与开腹手术相比,腹腔镜原位清扫短期疗效明显获益,长期结局不受影响,且无需游离脾脏与胰尾部,可避免术后可能发生的脾扭转,但多项研究均未提及脾脏放回后有扭转风险发生[11-12,20]。Hyung首次报道中间入路法用于原位清扫淋巴结[4],脾门淋巴结平均清扫2.7枚,因不满足整块切除原则而逐步被取缔。黄昌明采用左侧入路法[21],平均清扫脾门淋巴结2.9枚,短期预后较好,对于配合密切团队可较好地控制副损伤的发生。但不论采用哪种入路,腹腔镜下原位清扫受限于脾门区的狭窄空间、视野部分缺失、无触感等因素,术中副损伤不可避免。
3.2 全胃切除术中对血管后方淋巴结清扫的认知 依据日本胃癌处理规约,脾门与脾血管淋巴结分为前、后两亚组[22],即No.10a、No.10p、No.11da、No.11dp。腹腔镜原位清扫血管后方淋巴结时易遗漏,且易造成血管损伤,以及诸多限制因素,使得脾门区淋巴结的清扫方式备受争论。林建贤等[23]回顾分析404例D2全胃术后患者的生存资料,提出清扫血管后方淋巴结并无生存获益,甚至后方淋巴结清扫伴随着更高的术后并发症发生率。王伟提出脾血管后方淋巴结阳性率仅1.9%,清扫意义有待进一步考察[8]。但以上回顾性分析结果均因腹腔镜原位清扫难度过大,镜下清扫后方淋巴结难以控制血管、脏器副损伤的发生。我们提出胰腺后入路拖出式清扫脾门淋巴结,不仅保证手术安全,简化手术步骤,且可高效完成血管后方淋巴结的清扫,具有探索价值。
3.3 全胃切除术中主要参考平面 胰腺作为胃周间隙的中心枢纽[24],可参照位置较固定的胰腺,以寻找胰后入路拖出清扫术式的解剖标志。胚胎发育时期,前肠与体壁之间形成天然间隙即左膈下腹膜外间隙与胰腺后间隙,是胃癌手术重要的解剖层面。本文提出胰后入路的关键在准确判定后间隙切入点,即胰腺下缘与肠系膜上血管交界处。沿此交界打开融合筋膜进入胰腺后间隙及肠系膜与肾前筋膜之间的Toldt间隙向头侧拓展。胰后间隙内无重要神经、血管等结构,游离时需准确判断在正确层面内进行,避免跨层,即可控制副损伤发生。游离胰后间隙时需关注左膈下动脉的位置,因向内侧游离至该矢状面时已可经腹壁切口顺利拖出脾脏、胰体尾部,无需过度游离。
3.4 经胰后入路拖出清扫脾门淋巴结的短期预后
3.4.1 胰后入路拖出清扫脾门淋巴结的可行性 区域淋巴结转移为影响胃癌患者生存预后的独立危险因素[13],彻底清扫、避免遗漏是胃癌根治术的基本原则。但如何评判淋巴结清扫彻底性,暂无明确标准,目前指南推荐尽可能完全清扫潜在转移的淋巴结,且保证清扫数量≥15枚。本研究两组淋巴结清扫总数差异无统计学意义,平均淋巴结清扫数量达29.1枚,但拖出组脾门淋巴结清扫数量更多(P=0.007),且脾门淋巴结阳性率高(P=0.028)。笔者认为,拖出组脾门部淋巴结高清扫数量、高阳性率与血管后方的彻底清扫密切相关。血管后方淋巴结仍是胃癌淋巴转移的通路,不可避免地存在肿瘤细胞种植可能。清扫血管后方淋巴结可避免部分阳性淋巴结的残留,给患者带来生存获益。
3.4.2 胰后入路拖出清扫脾门淋巴结的安全性 与原位组相比,拖出组手术时间更短,这与提出此清扫术式的初衷一致。经腹壁小切口拖出清扫脾门淋巴结,不仅两组间切口长度差异无统计学意义,而且拖出清扫可保证清扫的安全性、彻底性,还可高效完成后方淋巴结的清扫。拖出后脾脏、脾血管、胰腺之间的结构位置关系未发生变化,直视下清扫对结构判断更精确,操作精准,术中出血减少(P=0.009)。两组术后住院时间较既往报道长[5-7];与病例分期晚(Ⅲ期占69.4%)且术前部分患者(36.7%)进行营养支持治疗有关。术前存在营养风险的患者因免疫功能受抑制,不仅影响术后短期康复,且与生存预后呈负相关[25]。因此营养风险评估及必要的术前营养支持治疗均不可缺。
我们的初步结果显示,胰腺后入路拖出清扫脾门淋巴结安全、可行,步骤相对简化,淋巴结清扫更高效,其是否对术后辅助治疗更具价值、生存预后是否获益尚缺乏充分证据。由于本文为回顾性单中心小样本量对比分析,对于结果的阐释尚需大样本量、多中心研究。本研究会继续累积样本量,并分别收集清扫的脾门及血管后方淋巴结,期待以更多数据作为基础,评价此术式的应用价值。
