自驱动健康监测及生理功能调节器件的研究进展
2019-12-28李虎赵璐明李喆倪凡刘卓刘儒平樊瑜波李舟
李虎,赵璐明,李喆,倪凡,刘卓,刘儒平,樊瑜波,李舟
生物工程与大健康

李舟 中国科学院北京纳米能源与系统研究所研究员,博士生导师,纳米能源与生物系统实验室负责人,获得国家万人计划“青年拔尖”、教育部“新世纪优秀人才”、北京市“高创计划”青年拔尖人才和北京市“科技新星”。发表学术论文70余篇,其中在和的子刊上共发表5篇,以第一或通讯作者在IF>10的国际学术期刊上发表论文37篇,被引次数超过3 000次。获得2017年北京市科学技术二等奖 (第一完成人)、国际医学与生物工程联合会 (IFMBE) 青年科学家奖、中国发明协会金奖(排名第一) 和生物医学工程大会青年论文竞赛一等奖等奖励。担任(影响因子15.621)、等期刊的Guest Editor-in-Chief,以及期刊的编委。
樊瑜波 教授,博士生导师。我国生物医学工程、医疗器械、康复辅具领域领军人物。国家杰出青年基金获得者(2009),国家首批“万人计划”入选专家,长江学者特聘教授(2012),科技部重点领域创新团队带头人(2014),北京市生物医学工程高精尖中心主任、北京航空航天大学医工交叉创新研究院院长、民政部国家康复辅具研究中心主任 (2015至今),曾任中国生物医学工程学会理事长 (2008–2015)、世界华人生物工程联合会 (WACBE) 主席。担任、、、、、等SCI期刊编委,主编,《生物医学工程学杂志》和《医用生物力学》杂志副主编。发表SCI论文近300篇 (H指数44),发明专利90余件,以第一完成人获教育部自然科学一等奖、黄家驷生物医学工程一等奖。
自驱动健康监测及生理功能调节器件的研究进展
李虎1,赵璐明2,李喆2,倪凡3,刘卓1,刘儒平3,樊瑜波1,李舟2
1 北京航空航天大学 生物与医学工程学院,北京 100083 2 中国科学院北京纳米能源与系统研究所 中国科学院大学纳米科学与技术学院,北京 100083 3 北京印刷学院 印刷与包装工程学院,北京 102600
纳米发电机 (摩擦纳米发电机和压电纳米发电机) 技术自被提出以来得到了迅速发展,该技术可将人体动能、风能、声波能、海洋能等各种机械能转化为电能,并应用于自驱动健康监测及生理功能调节,如脉搏传感、神经电刺激、心脏起搏等。文中综述了纳米发电机的结构、工作原理、输出性能及其在循环系统、神经系统、生物组织、睡眠及水下救援等方面的最新研究进展,并在此基础上进一步分析了纳米发电机技术应用到临床治疗所面临的挑战。未来纳米发电机有望成为辅助电源,甚至取代传统电池类电源用于驱动医疗电子器件,实现人体自驱动健康监测及生理功能调节。
自驱动,健康监测,生理功能调节,纳米发电机
植入式医疗器件(Implantable medical devices, IMDs) 在过去几十年取得了巨大进步,在提高患者生活质量、延长患者寿命方面起着举足轻重的作用。IMDs可被植入到人体的不同部位对疾病进行诊断和治疗,常见的IMDs包括胃刺激器、心脏起搏器、心脏除颤器、人工耳蜗及深脑刺激器[1-2]。这类IMDs可用于胃、心脏、脑及其他重要器官相关的疾病诊断 (如心率、血压及温度监测) 及辅助治疗 (如肌肉和神经系统的刺激)。例如,心脏起搏器可通过电刺激病人心肌纠正心律失常,减轻心脏堵塞或病窦综合征[3-4]。此外,IMDs对人体生理过程的认知也具有重要意义,包括复杂的神经通讯、记忆及控制机理,这些过程会加深人们对不同疾病及治疗过程的理解[5-6]。
虽然IMDs制备工艺及应用场景近年来不断获得进步,但是当前IMDs的应用依然面临着诸多挑战[7-8]。IMDs需要更加小型化和轻量化,以减小其对人体日常活动的影响,增加用户舒适度。IMDs中的电池占据了自身的主要重量和尺寸,但是由于当前的技术限制,电池很难做到小型化及轻量化。除此之外,电池寿命也是一个需要克服的挑战,因为从出厂时电池寿命就已固定 (例如深脑刺激电池寿命为3–5年)。当电池产生电脉冲进行深脑刺激和心脏起搏时,电池使用完毕后需要进行二次手术将其取出,这意味着病人需要再次花费高额费用,经历身心病痛,并占用社会医疗资源[9]。
近几年科学家提出将人体动能及生理环境中的化学能转化为电能,用于驱动植入式医疗电子器件,无需外部电源就能实现器件正常运行。纳米发电机的提出为上述问题提供了解决方案,在过去十年,纳米发电机在自驱动系统方面的发展取得了巨大进步。研究人员开发了各种结构及性能的纳米发电机,将机械能转化为电能并成功应用于各种生活场景[10-13]。
随着越来越多可植入可穿戴电子器件被用于人体,基于纳米发电机的自驱动电子器件越来越展示出其自身独特的优势。由于动物体内和体外环境存在很大差异,因此将纳米发电机用到人体或动物体内,需要考虑很多因素。首先,要保证纳米发电机材料和电路具有良好的生物相容性[14];其次,纳米发电机的结构设计需要适应动物体内狭窄无规则的空间特点[15];第三,动物体内的运动幅度很小,纳米发电机的灵敏度及能量转化效率要求非常高。文中我们首先对纳米发电机的结构及工作原理进行了简要描述;其次,我们总结了纳米发电机在健康监测及生理调节方面的主要研究进展。未来纳米发电机有望成为辅助电源,甚至取代传统电池类电源用于驱动医疗电子器件。
1 压电纳米发电机
压电纳米发电机(Piezoelectric nanogenerator,PENG) 器件结构精细,一般由压电材料、柔性基底及外部连接电路组成[16-18]。通过自身形变将外部机械能转化电能,并为外部电子器件供能。
压电效应是一种产生内部电势的效应,在外部压力作用下产生电偶极矩,材料内部产生电势差。以纤锌矿结构的氧化锌(Zinc oxide, ZnO) 晶体为例,Zn2+和O2-沿c轴层层排列成正四面体 (图1A)。在没有压力作用时,正负电荷中心位于同一位置。当外力施加到四面体的任意一个顶点时,由于正负电荷中心发生移位形成电偶极子 (图1B)。晶体中所有的偶极矩单元共同产生一个压电场,导致晶体沿张力方向产生电势差[19-20]。该电势差即为PENG压电势 (图1C)。当该晶体外接负载,晶体内部电势差驱动外部电路中的电子移动屏蔽一部分压电势,在外部电路中产生电流。因此,当施加周期性压力于晶体时,该晶体产生周期性压电势,并输出交流电脉冲 (图1D)[21]。生物相容性材料选择、器件结构设计及封装是PENG应用于生物医疗领域时应主要考虑的因素。

图1 压电纳米发电机工作机理[19-21]
2 摩擦纳米发电机
摩擦纳米发电机(Triboelectric nanogenerator,TENG) 工作原理是基于摩擦起电和静电感应之间的耦合,当不同材料相互接触时,由于材料对电子束缚能力不同,电荷会从一种材料转移到另一种材料。电荷种类包括电子、离子或者分子。当外部作用力使两种材料界面发生分离时,接触产生的摩擦电荷产生电势差,该电势差驱使电子在材料背电极之间来回流动,形成交流电输出,外部机械能被转化为电能[22]。在该工作原理的基础上,TENG的工作模式可分为以下4类。
2.1 垂直接触分离模式
垂直接触分离模式是TENG首次被提出的工作模式 (图2A),两种介电性质不同的摩擦材料面对面叠加到一起,然后在材料背面通过磁控溅射等方法沉积一层金属背电极。当两种材料发生物理接触时,由于材料电子亲和势不同,在两种介电材料接触表面会带有等量的相反电荷。当撤去外部作用力时,两种摩擦材料被中间垫片隔开,在垂直方向被分开一定距离,原先带电摩擦界面产生电势差,驱使自由电子在外部电路中流动。当摩擦材料再次接触时,材料间隙消失,摩擦电效应产生的电势差消失,电子反方向流回[23]。该工作模式瞬时功率密度高,结构简单,封装方便。
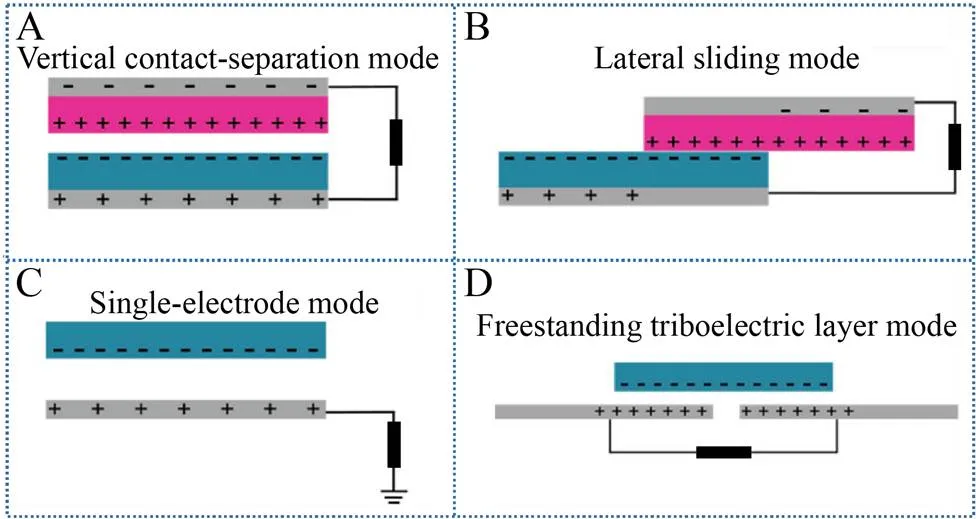
图2 摩擦纳米发电机的4种工作模式[13]
2.2 横向滑动模式
如图2B所示,横向滑动模式的结构和垂直接触分离模式类似。当摩擦电极性不同的材料表面相互接触时,由于摩擦效应两种材料表面产生电性不同的等量电荷。当两种材料沿滑动方向产生位移时,位移部分的电荷得不到完全补偿,导致材料表面产生电荷。当摩擦材料周期性地前后滑动时,电子沿顶部及底部电极交替移动以屏蔽摩擦电荷产生的电势差,当外部连接负载时,该电势差驱动外部电路电子周期性运动,产生周期性电流,外部机械能被转化为电能。与垂直接触分离模式相比,横向滑动模式电荷转移更充分。此外,研究人员还发明了其他多种滑动模式[23],例如二维面内滑动[24]、圆盘面内滑动及滚筒滑动等[25],这类滑动模式被广泛应用于运动传感。
2.3 单电极模式
上述两种工作模式包含两个背电极,通过外部负载相互连接,这一结构限制了其从自由移动物体上收集能量。而单电极模式可自由移动,独立工作,该模式为收集自由移动物体的能量提供了有效的解决方案。该模式是由一个自由移动物体和接地电极组成。当顶部的物体接近或从底部电极离开,局部电场分布会发生变化,该过程使得电子在大地和底电极之间发生流动以屏蔽电势变化 (图2C)。垂直接触分离模式、横向滑移模式以及二者的复合都可用于单电极工作模式收集外部机械能[26-27]。
2.4 自由摩擦层模式
自由摩擦层模式是由两个带背电极的介电摩擦层及一个自由移动摩擦层组成 (图2D)。自由移动摩擦层和下部介电摩擦层之间保留有一个小间隙。假如上部自由移动摩擦层进行摩擦电预带电处理,当其接近或离开下部摩擦层时,导致电荷非对称分布,该过程使得电子从一个电极流向另一个电极,以屏蔽不平衡的电势分布。背电极之间电子的前后移动使得TENG产生交流电。在该工作模式下,摩擦层之间没有产生直接的物理接触,该特点可以延长TENG的使用寿命,适用于自驱动振动传感[28-29]。
在过去10年中,压电纳米发电机的设计从氧化锌纳米线(ZnO)、纳米复合物 (ZnSnO3或BaTiO3) 到聚偏氟乙烯(Polyvinylidene fluoride, PVDF) 薄膜,再到Pb(ZrxTi(1–x))O3(PZT)、(1–x)Pb(Mg1/3Nb2/3) O3–xPbTiO3(PMN-PT) 和NaKNbO3之间不断演 变[30-34]。这些发展为高输出、结构稳定、小型化、安全化的PENG铺平了道路,为自驱动医疗器件在生物体内的应用提供了新方案。此外,TENG也具有自身的独特优势,例如输出电压高、质量轻、价格低廉、制备简单等。任何两种电子亲和势不同的材料都可用于制备TENG。从这一方面讲,TENG在输出性能、生物相容性、灵敏度及器件成本方面更具优势[35-38]。最近,研究人员发明了生物可降解的TENG及复合TENG用于机械能及热能的收 集[39-40]。随着研究的不断深入,TENG和PENG还将为自驱动生物医疗系统提供更多新选择。
3 纳米发电机在循环系统中的应用
循环系统是分布于全身各部的连续封闭管道系统,包括心血管系统和淋巴系统。心血管系统是由心脏、血管及血液组成。心脏将富氧血运送给动物体各个部位,乏氧血运输到肺部。心脏包含4个腔室:左心房、左心室、右心房及右心室。乏氧血返回到右心房,通过右心室,压入肺动脉到达肺部再次与氧结合,去除二氧化碳。然后新的富氧血从肺部压入左心房,通过左心室,压入主动脉到达身体不同器官。心房心室及血管之间的周期循环供血使得血液循环及肺循环不断进行,该过程对维持人体生命非常重要。心血管系统可作为纳米发电机的能量源,也可作为纳米发电机的调节对象。因此,心血管系统是纳米发电机应用场景中研究最多的系统。大量实验结果证明了利用纳米发电机收集循环系统中生物机械能的可行性,例如心跳、肌肉拉伸及主动脉收缩等,收集的能量可用于驱动植入式及穿戴式医疗器件。
3.1 自驱动心脏起搏
心脏起搏器利用电脉冲刺激心肌,调节心跳为病窦综合征及心肌梗塞病人提供了有效治疗方案。心率失常可导致晕厥、心绞痛、头晕、甚至心力衰竭等症状,在临床上使用心脏起搏器,可有效控制心律失常[41]。但是由于心脏起搏器电池寿命限制,7–10年后病人需要接受二次手术将其取出更换新的心脏起搏器[42]。该过程给病人带来很多不便,包括手术风险、愈合时间及感染风险等。自驱动能量供给技术可将生物机械能转化为电能,并应用于生理功能调节,该技术无需电池,大大延长了植入式医疗器件的工作时间,为上述问题提供了解决方案。
PENG和TENG二者均可将心跳机械能转化为电能,并用于心脏起搏,二者各有其自身优势,又有各自缺点。PENG可以经受长期的弯折,但是输出较低。TENG具有相对较高的输出电压,但是TENG需要封装以保护其在水中或液体中摩擦层的正常工作,这一步骤降低了TENG的能量输出及使用灵活性。以下两部分进行详细介绍。
2010年Li等首次将基于氧化锌(ZnO) 纳米线的PENG植入到活体动物体内收集生物机械能 (图3A)[43]。实验使用的ZnO纳米线直径为100–800 nm,长度为100–500 μm。纳米线两端用银浆固定在聚酰亚胺基底表面,并与两根导线连接,由此制备的器件一端为肖特基接触,另一端为欧姆接触。整体器件使用柔性高分子封装与周围组织液隔离,提高器件整体强度。将该PENG植入到大鼠体内,贴于隔膜腹侧。大鼠呼吸引起ZnO纳米线弯曲,将呼吸机械能转化为电能。PENG开路电压、短路电流及峰值功率分别达到了3 mV、30 pA和0.09 pW。
2014年Hwang等利用单晶0.72 Pb(Mg1/3Nb2/3)O3- 0.28PbTiO3(PMN-PT)薄膜制备了一种柔性PENG (图3B)[44]。PMN-PT (Lead zirconate titanate) 通过改进布里奇曼方法直接从熔融物中生长而得,通过施加1 h 1.8 kV/mm的强电场进行极化。在PMN-PT两侧溅射金,形成金属-绝缘体-金属(Metal-insulator-metal, MIM) 结构,器件总厚度为8.6 μm。将MIM PMN-PT转移至聚对苯二甲酸乙二醇酯(Polyethylene terephthalate, PET) 基底上,器件有效面积1.7 cm×1.7 cm,在周期性弯曲释放过程中,器件最大输出电压、电流及峰值功率分别为8.2 V、145 μA和1.19 mW。整流后的最大输出分别为8 V和100 μA,该输出可为3 V和100 μA的心脏起搏器供能[45]。整流后的输出可直接用于刺激麻醉状态下的大鼠心跳。当该PMN-PT PENG周期弯曲释放时,可观察到除自然心跳曲线以外的峰值。Dagdeviren等利用锆钛酸铅压电材料(PZT) 也制备了一种压电纳米发电机[46]。该PZT能量收集器件具有很好的适形性,能够很好地贴附于心脏、肺及隔膜,并将这些器官收缩和舒张的机械能转化为电能。
2014年Zheng等制备了一种可植入的TENG,并将其首次应用于活体动物中收集生物机械能 (图3C)[47]。将PDMS (Polydimethylsiloxane)膜贴附在Kapton基底表面,厚度为100 μm,表面带有金字塔阵列结构,作为其中一个摩擦层。金电极沉积在Kapton膜的另一面,作为背电极。PDMS膜及Kapton膜非常柔软,当有微弱的呼吸运动产生时,这些膜很容易发生变形。表面带有微结构的铝箔既作为摩擦层又作为电极层。这两个摩擦层由400 μm厚度的PET垫片隔开,再由50 μm厚度的PDMS封装。TENG的工作面积为0.8 cm×0.8 cm,整体尺寸1.2 cm×1.2 cm×0.2 cm。输出电压电流分别为12 V和0.25 μA,输出功率为3 μW。将TENG植入到大鼠左胸皮下,大鼠的吸气和呼气使得Kapton膜和铝箔产生周期性的接触和分离,进而使得TENG产生电输出。动物体内产生的电压、电流及输出功率分别为3.73 V、0.14 μA和0.52 μW (图3C)。电压电流波峰频率和大鼠呼吸频率一致,大约每分钟50次。TENG产生的电能被储存在一个电容器中,然后被用于心脏起搏器调节心脏跳动速率。在不同的工作频率 (2 Hz、3 Hz及5 Hz)下,心跳速率被成功调节至和心脏起搏器频率一致。
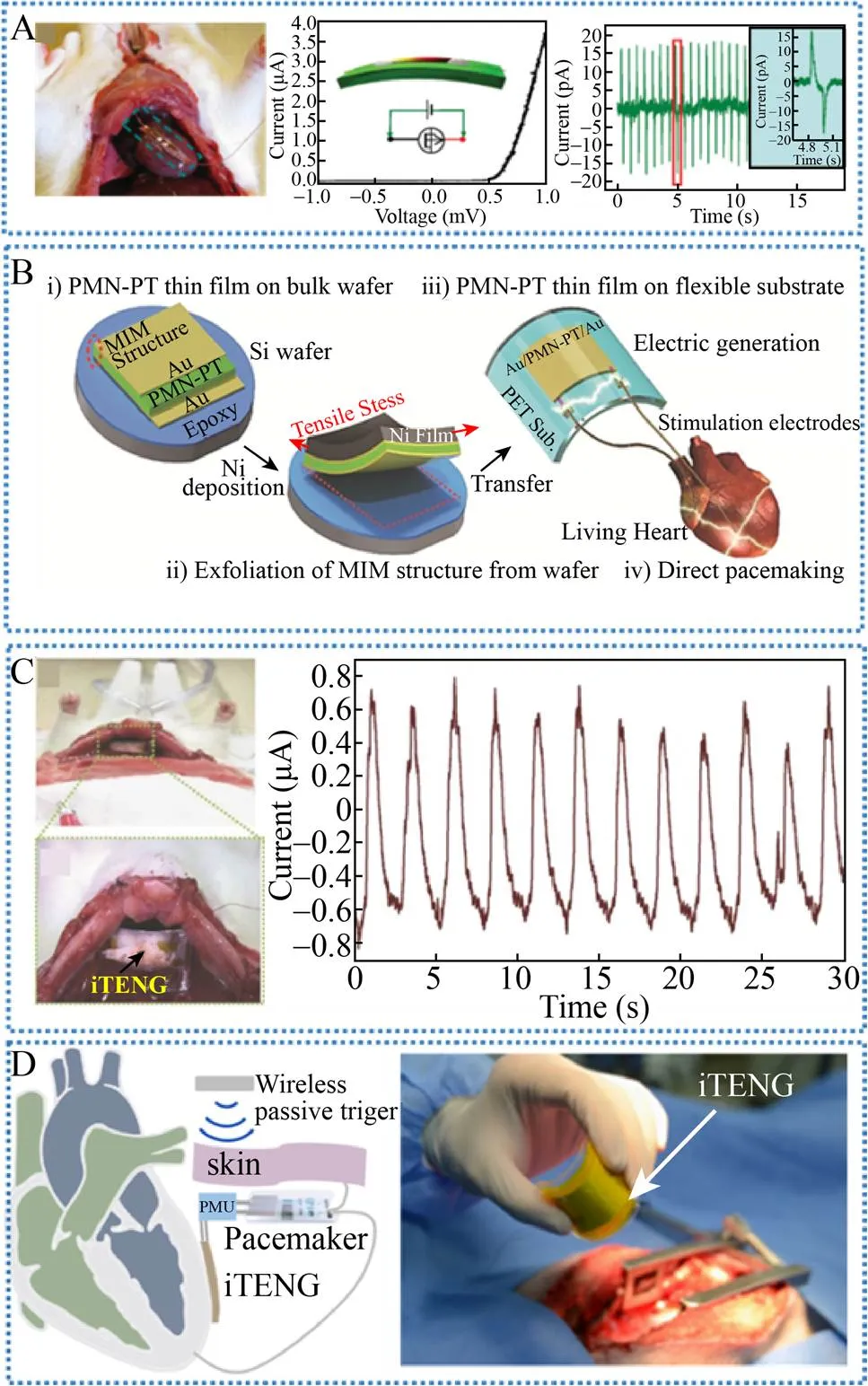
图3 基于压电及摩擦电的自驱动心脏起搏器[43-44,47-48]
2019年Ouyang等受生物共生现象的启发 (例如根瘤菌与植物间的共生),他们提出了基于植入式摩擦电纳米发电机(Implantable TENG,iTENG) 的共生型心脏起搏器(Symbiotic pacemaker,SPM) (图3D)[48]。SPM可将心跳的能量收集起来驱动起搏电路发出脉冲;这些脉冲同时又刺激心脏,使出现异常的心脏恢复正常。这样SPM与心脏之间就达到了“相互依存、相互受益”的“共生”状态。目前SPM已成功在大型动物 (猪) 体内实现了“全植入”的自驱动运行,并成功进行了心律不齐的治疗。采用电晕放电极化技术处理PTFE (Polytetrafluoroethylene) 摩擦层表面,iTENG结构采用记忆合金龙骨和三维海绵间隔层有效地提升了发电机性能。体内开路电压、短路电流及输出功率分别为65.2 V、0.5 μA和32.6 μW,创造了植入式能量采集器件的最高电压输出记录。每一个心脏运动周期,SPM可获得的能量高达0.495 μJ,高于心脏起搏阈值能量 (通常为0.377 μJ)。也就是说,SPM可实现“一次心跳,一次起搏”,这对自驱动心脏起搏器迈向临床和产业化具有重要意义。同时,SPM的实现也为新型自驱动医疗电子设备提供了一条崭新的演化途径。
3.2 自驱动心血管监测
纳米发电机可以作为心脏起搏器调节心跳速率,而且可以用作心血管传感器检测血液流动及压力。这类纳米发电机被植入到心脏内直接监测心跳情况,无需其他能源供给。植入式心血管传感器可以监测多种心律不齐相关的病症,并及时给出反馈[49]。与穿戴式生物医学监测系统相比,植入式传感系统可以带来更高精度的监测,避免病人局部移动及户外活动带来的不便[49]。
2016年Zheng等设计了一款植入式TENG作为心脏传感器,输出性能高及稳定性好[50]。该TENG由内摩擦层及封装层组成 (图4A)。纳米结构聚四氟乙烯(n-PTFE) 薄膜作为摩擦层,Kapton膜及带有铜背电极的柔性基底作为另一个电极。铝箔既作为摩擦层又作为电极层。高弹性钛片作为龙骨结构,有效保证了n-PTFE膜与Al膜的接触和分离。PDMS和聚对二甲苯分别用作封装层增加TENG的结构稳定性,避免体液及组织带来的侵蚀。TENG封装前,开路电压约90 V,短路电流约7.5 μA。最大功率密度为107 mW/m2。植入式TENG被植入到30 kg成年雄性约克郡猪的心脏和心包之间。当Kapton面被放置到左心室下壁位置,体内开路电压及短路电流分别为14 V和5 μA,输出功率为 70 μW,该处值是所有测试位置中输出最高的位置,其他测试位置包括右心室的流出道、左心耳、心脏底部、左心室游离壁、左心室下壁。电压输出的波峰和心电图(Electrocardiographs,ECGs)中的对应波高度同步,相关性2= 0.983。TENG输出信号强度和心跳强度密切相关,实验通过肾上腺素药物注射对这一特点进行了进一步验证。将TENG收集的能量整流后储存在电容器中驱动无线发射器,将输出信号转移到接收端。利用该方法,实验成功构建出无线传输心脏传感器。整个系统在关闭胸腔72 h后依然可以很好地工作,2周后结构依然完整,且生物相容性良好。

图4 基于压电及摩擦电的自驱动心血管传感器[50-53]
2016年Ma等采用上述结构设计的纳米发电机,开发了自驱动多功能摩擦电有源传感器(Implantable triboelectric active sensor,iTEAS) 并获得了心脏及血管的特定信息 (图4B)[51]。该iTEAS被放置到成年猪的心外膜和心包之间,通过缝合线固定在心包膜上。iTEAS总尺寸30 mm× 20 mm×1 mm,开路电压约为10 V,短路电流约为4 μA,输出功率约40 μW。这些电信号和心跳速率高度一致,精确度达到了99%。此外,iTEAS输出信号和呼吸频率高度相关。吸气(2.9 s) 时电压峰值从4.8 V增加至6.3 V,呼气(2.0 s) 时电压减小至3.8 V。两个连续最高峰值的时间间隔为4.9 s,和人工呼吸机每分钟12个循环高度一致。植入两周后,将该成年猪麻醉进一步检测器件性能。iTEAS器件结构完整,没有任何腐蚀和破裂出现。H&E (Hematoxylin and eosin) 染色结果证实实验组心肌组织和对照组组织相比没有发现淋巴球渗透现象。这些结果证实纳米发电机在自驱动心脏传感方面具有广阔的应用前景。
2017年Kim等使用包含0.5 mol%锰(Mn) 的0.4Pb(Mg1/3Nb2/3)O3-0.6Pb(Zr,Ti)O3单晶参杂(PMN-PZT-Mn) PENG作为自驱动心脏传感器 (图4C)[52]。开胸手术后,将该PENG器件手术缝合到成年猪的心外膜上。器件弯曲刚度为9.95×10–5Nm,该刚度值比医用心肌补片刚度(2.52×10–3Nm)小;因此,PENG不会影响到心脏的正常生理活动。成年猪心脏收缩和舒张可使PNEG产生17.8 V的开路电压,1.75 μA的短路电流,输出功率为31.15 μW (图5C)。开路电压、短路电流和各个心跳频率下的ECG的峰值对应。在100 000次弯曲实验中,PENG输出信号稳定没有衰减。使用HEK293、H9C2及HL-1进行细胞存活率分析及周围组织切片分析都表明器件具有良好的生物相容性。
2019年,Liu等利用TENG制备了一种小型化,柔性及自驱动的心内膜压力传感(Self-powered endocardial pressure sensor,SEPS),该SEPS和外科导管结合用于微创植入 (图4D)[53]。SEPS整体尺寸为1 cm×1.5 cm×0.1 cm。该器件电晕处理前开路电压为1.2 V,电晕放电处理后电压提升至6.2 V,电压输出提高了约5倍。SEPS被植入到成年猪的左心室和左心房,低压和高压环境下器件均有较好的响应性。在体内工作时,SEPS具有高灵敏度、可实时监测、机械稳定性好的特点。器件灵敏度达到了1.195 mV mm/Hg,线性度2= 0.997。此外SEPS还可以检测心律不齐,如心室颤动和心室过早搏动。
3.3 自驱动脉搏传感
实时生物医学监测系统可以对生理信号进行交互式实时监测,还可以进行自动诊断,该技术为人们的日常生活带来了极大便利。植入式器件在体内信号传输方面具有不可替代的优势,如果穿戴式器件在灵敏度和精确度方面可以达到同植入式器件相同的效果,那么无需手术的穿戴式器件将更加受病人的欢迎。自驱动可穿戴脉搏传感为这一问题提供了有效解决方案,无需电池,低能源损耗,无环境污染,器件小型化,信号保真度高。由于心脏与主动脉关系密切,因此自驱动脉搏传感器可用于循环系统的有效检测。
2017年Ouyang等制备了一种基于TENG的自驱动超灵敏脉搏传感(Self-powered ultrasensitivepulse sensor,SUPS),该器件同时具有高柔性及高输出的特点 (图5A)[54]。纳米结构Kapton及铜薄膜作为两个摩擦层。利用PDMS封装后,整个器件柔软轻薄,尺寸大小为20 mm×10 mm×0.1 mm。在线性马达50 N垂直压力作用下,SUPS输出电压、电流、电荷量分别为109 V、2.73 μA及7.6 nC,输出功率约为0.3 mW。当将器件贴附在24岁男士的径向动脉上,SUPS输出性能分别为1.52 V、5.4 nA及1.08 nC,输出功率为8.2 nW。SUPS波峰电压输出和ECG中对应波一致,一致性2= 0.981,比其他临床采用的脉搏传感器更高一些,比如压电脉搏传感器和光电脉搏传感。同时,研究者将SUPS应用于心血管疾病的诊断,包括健康组、冠心病组、房颤组及房间隔缺损组。健康组和不健康组的差异非常明显。将时间间隔P-Pn及P-Pn+1以庞加莱图表示,每一组都有其特定的波形。健康组呈现彗星状图形。冠心病组有一些分散彗星状图形,房间隔缺损组呈现出椭圆形,分布均匀。房颤组散点分布区域较大。健康组和病人组之间的庞加莱图明显不同,这表明SUPS可作为心血管疾病诊断的有效工具 (图5B)[54]。
Park等在2017年使用PZT制备了一种超薄适形压电传感器 (图5C)[55]。将高质量的PZT薄膜涂覆在蓝宝石衬底上并进行退火处理,然后将PZT薄膜被剥离转移到超薄PET基底上(4.8 μm)。然后在PZT薄膜表面制备金交叉指型电极,该器件非常薄,可以漂浮在肥皂泡上。将该压电传感器通过绷带共形贴附在人手腕上,实时脉搏信号并通过无线传输系统传输给智能手机进行脉搏监测。该脉搏传感器应用在一位30岁的男子身上,监测颈动脉产生的开路电压为400 mV,吞咽动作产生的电压为100 mV。颈动脉测量得的输出电压约为桡动脉电压的6倍。运动前桡动脉每分钟跳动73次,桡动脉脉搏产生的平均开路电压约为65 mV,运动后桡动脉每分钟跳动次数为100次,桡动脉脉搏产生的平均开路电压约为81.5 mV。每一个电压信号中,都有两个峰值信号出现,P1和P2,P1代表脉压,P2代表后期心脏收缩增强压,径向桡动脉增强指数可定义为P2/P1,该指标和动脉硬化关系密切。运动前,传感器给出的P2/P1值为0.54,运动后平均P2/P1值为0.22。这表明后期心收缩增强压降低,该变化可能是因为运动后心率发生了变化,增加了心室血液排出。
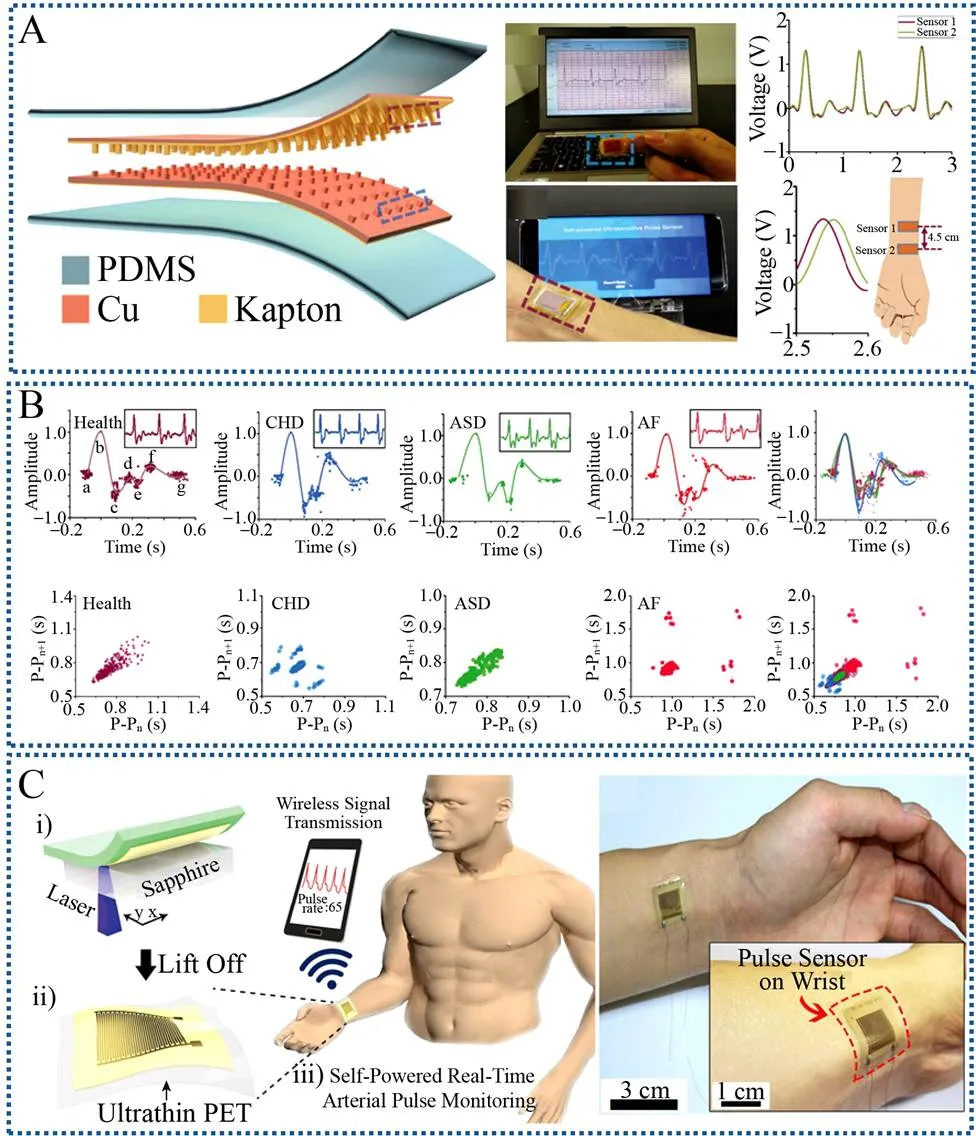
图5 基于压电及摩擦电的自驱动脉搏传感器[54-55]
4 自驱动生理功能调节
4.1 自驱动神经电刺激
深脑刺激(Deep brain stimulation,DBS) 是指神经外科中使用电脉冲刺激特定的脑区域,达到特定治疗目的[56]。研究证实深脑刺激可以缓解各种神经及精神疾病,包括癫痫、帕金森疾病、原发性震颤及重度抑郁[57-58]。植入式深脑刺激器需要高功率,电压在3−5 V之间,130 Hz,脉冲时长60 ms,是心脏起搏器 (2 V,1 Hz,脉冲时长400 ms) 的几倍。为完成DBS的自驱动刺激,纳米发电机需要从结构设计、材料选择及植入手术等方面不断改进。
2015年,Kim及其合作者在PET基底上制备了一种柔性单晶Pb(In1/2Nb1/2)O3-Pb(Mg1/3Nb2/3) O3-PbTiO3(PIN-PMN-PT:PIMNT) 膜,并尝试将其用于深脑刺激[59]。PIMNT非常薄,厚度只有10 μm,PET基底厚度为125 μm,二者一起组成了超薄器件 (图6A)。在机械力弯曲作用下,器件最大开路电压为11 V,短路电流为283 μA,输出功率为3.11 mW,该输出值可以给电容器充电并点亮120盏LED。在手指弯曲作用下,PIMNT纳米发电机最大电流为0.57 mA,功率为0.7 mW。将PIMNT脑刺激器用于激活活体老鼠大脑初级运动皮质,刺激电极放置到老鼠M1皮质部位。PIMNT纳米发电机的每一次弯曲都导致前肢肌肉的收缩,右爪前移1.5−2.3 mm距离。该工作是通过纳米发电机利用身体运动实现直接深脑刺激的重要一步。
体内迷走神经在调节食物摄入量用于肥胖治疗方面具有意义。2018年,Yao等利用植入式TENG对迷走神经进行刺激(Vagus nerve stimulation,VNS),实现自驱动胃部运动调节,进而有效控制大鼠体重 (图6B)[60]。该VNS器件贴附在胃部表面,尺寸大小为1.2 cm×3 cm,从胃部蠕动收集生物机械能,通过TENG摩擦层 (聚四氟乙烯和金)的接触与分离产生电脉冲,最大输出功率40 μW。胃食管结边缘双向VNS由金导线包覆,铜导线和金电极连接用于传递电信号。器件通过PDMS和共聚酯封装,以实现良好的生物相容性、机械稳定性及柔性。0.05 Hz频率下连续胃蠕动,VNS器件的输出电压可以达到60 mV。实验结果表明,实验组老鼠平均体重被控制在350 g,比对照组少38%。该工作为肥胖症提供了治疗方案。
外周神经调节是用于神经康复及生物电子医学的新兴领域。2018年Lee等利用水-空气复合摩擦纳米发电机(Water-air TENG,WA-TENG)进行外周神经刺激,该刺激可以控制老鼠腿部肌肉的运动 (图6C)[61]。该TENG具有层状结构,包括厚PDMS封装层、氧化铟锡(Indium tin oxide,ITO) 及聚对苯二甲酸乙二醇酯(ITO/PET) 阵列、垫片1、薄PDMS层、垫片2、海绵阵列、ITO/PET阵列、底部厚PDMS膜。悬空介电薄膜可以明显提高TENG输出,从几个毫伏到几十伏,TENG最大输出功率2.93 μW。利用海绵结构吸收水分,可以克服传统水凝胶型TENG的缺点。和水凝胶相比,本实验中包含海绵结构的器件更加坚固,可承受传统器件的4倍作用力。通过柔性界面诱导腿部肌肉选择性激活可以选择性刺激大鼠坐骨神经。
多种神经疾病都可引起肌肉功能损失,如脊髓损伤、中风、多发性硬化症。肌肉电刺激是临床上常用的一种方式,用于肌肉功能康复,该过程通常需要毫安级别的刺激电流。2019年Wang等将柔性多通道肌肉内电极和TENG结合实现了自驱动肌肉直接电刺激 (图6D)[62],该TENG具有层层堆叠结构,PTFE和铝箔作为摩擦层,TENG开路电压为47 V,短路电流35 μA,外部负载 2.8 mΩ时TENG输出功率为1.65 mW。实验发现TENG肌肉刺激效率主要受两个因素影响,一是电极神经元位置,二是电刺激波形极性。当电极靠近运动神经元分布区域时,刺激效率提高。同时,当电刺激波形极性改变时,刺激效率也不一样。
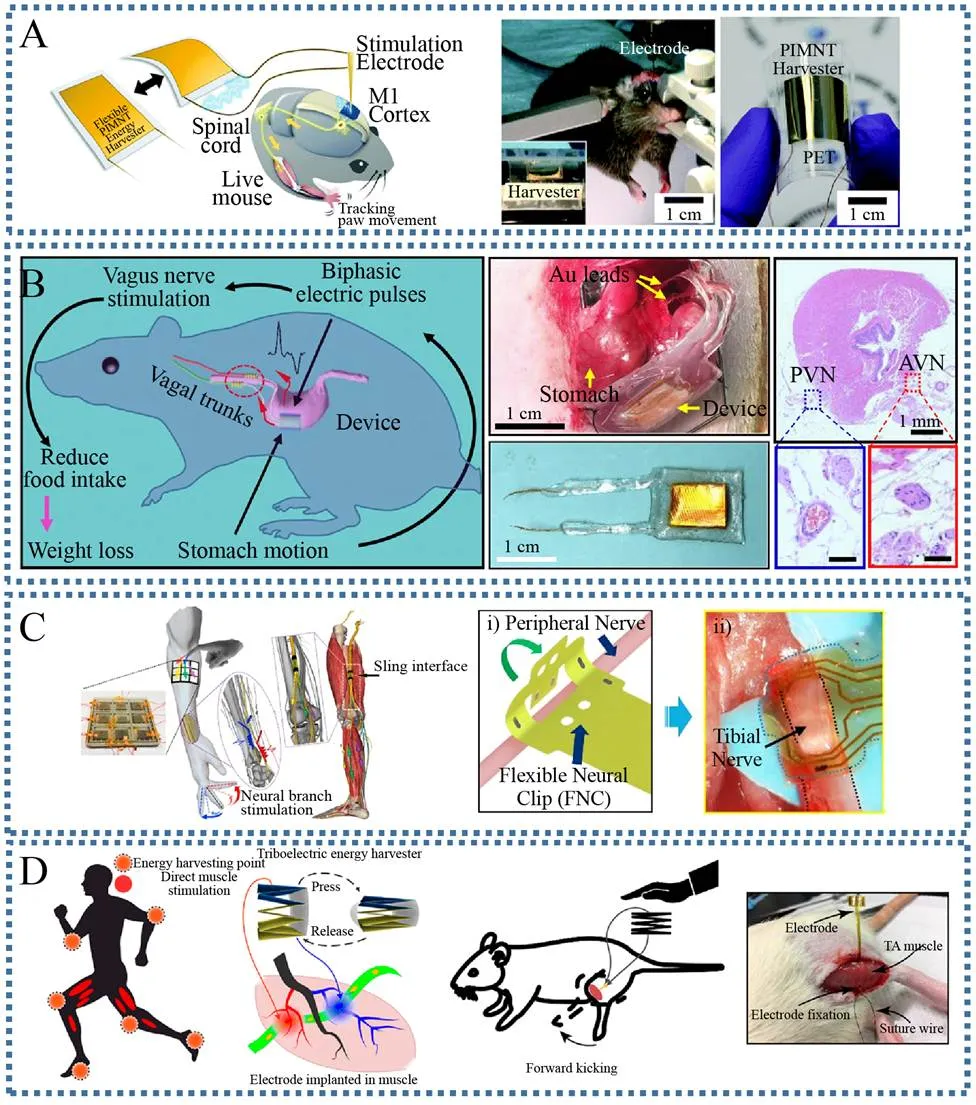
图6 基于压电及摩擦电的自驱动神经电刺激[59-62]
4.2 自驱动细胞电刺激
当骨受伤以后,如何加速骨修复是一个关键问题[63],研究结果证明低功率激光修复对损伤后的骨愈合具有积极意义,因为激光能量对应线粒体中呼吸链的特征能量和吸收能量[64]。该方法需要一种植入式的激光修复系统,基于TENG的自驱动植入式电源整合系统为该问题提供了解决方案。
2015年,Tang等开发了一种基于TENG和红外激光激发单元的自驱动激光治愈系统用于骨组织再生[65]。该系统可以明显加速老鼠胚胎成骨细胞的增殖与分化。金字塔阵列状的PDMS及氧化铟锡(ITO) 薄膜作为TENG摩擦层 (图7A),该TENG输出短路电流为30 μA,开路电压115 V,输出功率为3.45 mW,每个循环转移电荷量70 nC。MC-3T3成骨细胞被分为3组:无激光对照组、TENG激光照射组 (每天刺激100次)、电池激光照射组 (每天1 min)。激光照射组细胞增殖15%。5 d后,TENG激光照射组的分化水平比对照组多16%,电池激光照射组比对照组多21.7%。这些结果表明TENG在骨修复方面具有和电池等效的增强效应,TENG有很大潜力作为植入式医疗器件的电源用于临床骨组织修复治疗。
2016年Zheng等利用人工合成可降解材料聚乙烯醇(Polyvinyl alcohol,PVA)、共聚物(Poly(lactic-co-glycolic acid),PLGA)、聚己内酯(Polycaprolactone,PCL)和聚羟基丁酸戊酯(Polyhydroxylbutyrate valerate,PHBV) 开发了生物可降解TENG (图7B),该TENG采用层层结构,垂直接触分离模式,PLGA作为封装层,金属镁作为背电极,摩擦层为上述4种可降解材料中任意两种的组合[66]。当用线性马达1 Hz刺激TENG时,器件开路电压达到了40 V,短路电流1 μA,输出功率为40 μW,负载电阻80 MΩ时功率密度可达32.6 mW/m2。将TENG整流后与PDMS封装的交叉指状电极连接,然后在电极表面接种神经元细胞,两个电极之间电场强度为10 V/cm,实际PDMS表面处电场强度约为7.5 V/cm。24 h细胞培养后,每天1 Hz频率刺激30 min。培养5 d后细胞核及细胞骨架通过激光扫描共聚焦显微技术染色观察。大多数电场刺激后的神经元细胞都发生了定向排列,细胞骨架明显平行于电场方向,对照组细胞排列及细胞骨架没有发生明显取向。神经细胞的定向排列对神经修复具有重要意义。
2018年Jiang等利用5种天然可降解材料 (纤维素、丝素蛋白、甲壳素、米纸、蛋清) 开发了基于天然材料的多种生物可降解可吸收TENG (图7C)[67],该TENG采用层层结构,垂直接触分离模式,使用丝素蛋白进行了封装,金属镁作为背电极,其余天然材料中的任意两种进行组合作为摩擦层,最高输出开路电压55 V,短路电流0.6 μA,输出功率为33 μW,功率密度21.6 mW/m2。将该TENG整流后与交叉插指电极连接,电极采用PDMS封装,表面电场强度为8 V/cm,然后在PDMS表面接种心肌细胞,培养48 h后,对细胞施加电场刺激,频率1 Hz,连续刺激30 min,经此电场刺激后,心肌细胞簇跳动速率明显加快,刺激前后跳动速率增加了8.8倍,跳动状态更加有力。两个细胞跳动周期由1.382 s缩短至0.606 s,细胞的收缩周期由0.32 s缩短至0.24 s。这些实验结果说明TENG可用于异常心肌细胞的调节和修复。为心脏疾病提供了新的治疗方案,如心率过缓和心律不齐,也可用于体内心肌组织的重建。
4.3 自驱动组织修复
伤口愈合是一个重要的医疗保健问题,电场刺激是已知的可有效促进皮肤伤口恢复的方法,但由于常规电刺激系统笨拙,限制了其广泛应用。

图7 基于摩擦电的自驱动细胞电刺激[65-67]
2018年,Long等报道了一种基于TENG的自驱动电子绑带用于加速皮肤伤口愈合 (图8A)[68]。该电子绑带由聚四氟乙烯(Polytetrafluoroethylene,PTFE)、金电极、铜电极及聚对苯二甲酸乙二醇酯(PET) 组成,TENG采用滑移工作模式,滑动速率110次每分钟时,最大输出电压为2.2 V,最大输出功率2.25 μW。该TENG自驱动电子绷带可以穿戴在老鼠身上,将皮肤运动机械能转化为电能,并产生交替电场。大鼠实验表明,TENG自驱动电子绷带处理的全层伤口可在3 d愈合,而常规缝合对应的愈合过程需要12 d。体外实验表明,皮肤伤口愈合的加速过程可归因于电场促进成纤维细胞迁移、增殖及分化转移。

图8 基于摩擦电的自驱动组织修复[68-69]
2018年Li等利用PLGA、PCL、聚乳酸(Polylactic acid,PLA)、金纳米棒及聚1,8-辛二醇柠檬酸(poly1,8-octanediol citric acid,POC) 制备了光热可控降解的TENG (图8B)[69]。该TENG开路电压可达28 V,短路电流220 nA,输出功率为6.16 μW,转移电荷量12 nC。由于金纳米棒对近红外光反应灵敏,将其掺入高分子膜中接受红外光照射时,TENG的输出在24 h内减小为0,两周内基本完全降解。将TENG直接连接到交叉指插电极并培养成纤维细胞时,TENG电场可明显加速细胞向抓痕处迁移,该过程对伤口修复非常关键。此外,实验还发现TENG交流电场比传统直流电对伤口修复更加有效。
5 自驱动睡眠监测及水下救援
睡眠障碍是很多人遇到的健康问题,临床上常通过监测病人鼻子呼吸气流、胸腔呼吸运动、胳膊及腿部运动等来进行诊断[70-72]。这些监测设备一般需要电池或电插座来维持正常运行,灵活性较弱。对于睡眠呼吸暂停引起的身体运动,特别是需要大量睡眠的儿童,使用这类设备进行监测比较困难。因此,无需电源的智能传感更加符合解决上述问题的要求。
2016年,Song等提出了利用纳米柱阵列结构的TENG作为自驱动传感用于睡眠监测系统 (图9A)[73]。该TENG具有三明治状结构,由折叠状铝/ 塑料复合膜 (聚酰胺、铝膜及聚丙烯),2 mm悬臂弹簧组成。TENG开路电压为55 V,短路电流约0.9 μA,输出功率为49.5 μW,负载60 MΩ时最大功率约120 mW/m2。将该自驱动TENG传感器固定在胳膊或腿上可以监测到睡眠过程中翻身运动及蜷缩腿运动。其中固定在胳膊上时,翻身动作挤压TENG可产生约40 V电压。固定在腿部,平躺时腿部挤压TENG可产生约30 V电压。该工作证明了利用TENG实现自驱动传感,对人体睡眠进行实时监测。

图9 基于摩擦电的自驱动睡眠监测及水下救援[73-75]
2018年,Lin等将TENG阵列放到织物中做成床单,用于高灵敏度智能睡眠监测 (图9B)[74]。该床单由3层组成,顶层由正交阵列组成,底层由纯导电纤维阵列组成作为摩擦层,波浪形PET膜夹在两层导电纤维之间。该TENG阵列智能床单压力灵敏度为0.77 V/Pa,响应时间小于80 ms,循环接触测试5 000次输出电压(3.5 V) 基本不变,循环接触10 000次导电纤维表面结构基本不变,输出功率为52.5 nW。当人体躺到该床单上时,人体姿势、位置及压力分布可以很好地显示 在图形用户界面上。研究者从晚上23:00到第二天早上08:00对被试者进行测试,该TENG智能传感床单可以很好地监测人体整晚的睡眠状态,包括清醒运动和深度睡眠。
电鳗可以通过其独特的发电器官在水下产生高达数千伏的电压。在发电细胞的一个神经冲动过程中,当受到神经递质的刺激,细胞膜上的离子通道开启,钠离子流入,钾离子流出,从而产生一个150 mV的膜电位。2019年,Zou等模仿电鳗发电器官细胞膜上的离子通道,构造了一种机械敏感性的仿生通道,用于控制发电机内部的起电液体的往复运动,从而实现电能的转化[75]。两种独特的工作模式使得该仿生可拉伸纳米发电机(Bionic stretchable nanogenerator,BSNG) 在液体环境中可以实现超过10 V的开路电压,在干燥条件下可以实现超过170 V的开路电压,50 000次单轴拉伸测试后BSNG的输出没有任何衰减,单电极模式下器件功率为28.8 μW,双电极模式下器件功率为0.1 μW。研究者还利用该BSNG构建了一套水下救援系统,用于在水下危险特殊情况的远程求救警报。穿戴者只需在水下活动一段时间,固定于关节处的BSNG便可收集来自人体运动的机械能,并将其转化为电能存储到电容器中,当遇到紧急情况时,只需拍打胸前的报警触发器,便可远程点亮救援信号灯。良好的可拉伸性、优秀的水下输出性能和出色的抗拉疲劳性使BSNG可以作为水下自驱动传感器和能量采集装置,为可穿戴电子设备的水下可持续供电带来了新的机遇。
6 自驱动健康监测及生理功能调节器件输出功率对比及展望
如图10所示,当前关于自驱动健康监测及生理功能调节器件的应用主要包括自驱动心脏起搏、自驱动心血管传感、自驱动细胞电刺激、自驱动神经电刺激、自驱动组织修复及自驱动睡眠监测,不同的应用场景对自驱动器件的输出性能 (输出电压/电流/功率) 具有不同的要求。自驱动器件类型既有摩擦电器件又有压电器件,器件功率大小根据不同的应用从微瓦量级到毫瓦量级不等。
在自驱动心脏起搏器方面,随着技术的发展,自驱动器件输出功率不断提升,基于摩擦电的自驱动器件输出功率从3 μW[47]提升至32.6 μW[48],工作模式从直接电刺激[47]转为驱动商用心脏起搏器刺激心脏[48]。与摩擦电器件相比,基于压电薄膜的自驱动器件输出功率可达毫瓦 (1.19 mW)[44]。在自驱动传感、组织修复、睡眠监测及水下救援等应用中,基于摩擦电及压电的自驱动器件输出功率一般在微瓦量级 (0.05−70 μW)[50-52,68-69,73-75]。自驱动器件的输出功率在不同应用场景中的差异很大,比如可用于人体运动监测和水下救援的摩擦电自驱动传感器,在水中的输出功率为0.1 μW,而该器件在空气中的输出功率可达28.5 μW[75]。摩擦电及压电器件在进行细胞电刺激及神经电刺激时,输出功率在微瓦[60-61,66-67]及毫瓦[59,62,65]量级不等。
根据已有文献报道及结合不同应用场景,自驱动系统在生物医疗领域的主要应用范围及目标可分为以下几类:1) 当摩擦电或压电器件自身用作自驱动传感器检测生理信号时,和器件输出电流及功率相比,研究者更偏向于采用输出电压作为采集信号[44,47-48,50-52,54,73-75]。此应用场景下,小尺寸、便携式、高灵敏度、高电压输出的自驱动器件是未来研究的重点,此类器件对于检测人体脉搏、心率、呼吸、血流等微弱信号将发挥重要作用。2) 当把摩擦电或压电器件直接用作电压源或电流源时,研究人员可用它调控细胞生长或进行神经电刺激[66-69]。考虑到摩擦电器件以及压电器件的电流一般在微安量级,因此在上述应用场景下的器件需要有较大的电压,以便产生强度可调控的电场对细胞或神经进行调控,此类器件对未来伤口杀菌、肥胖控制、神经及组织修复、帕金森等神经类疾病以及其他相关疾病的治疗具有重要意义。3) 当摩擦电或压电器件作为电源,给低功耗医疗电子器件供能时,器件输出功率则显得尤为重要[59-62]。考虑到摩擦电及压电器件产生的是脉冲电,实际应用当中需将电能存储到电容器或电池中,就可驱动低功耗医疗电子器件 (如脉搏手环、心脏起搏器、深脑刺激器等)。因此,对于用作电源的场景,未来开发高输出功率,甚至直流电器件将是未来研究的重点,该类器件将为解决便携式、小型化、低功耗、用于诊断或治疗的医疗电子设备的电源问题提供解决方案。
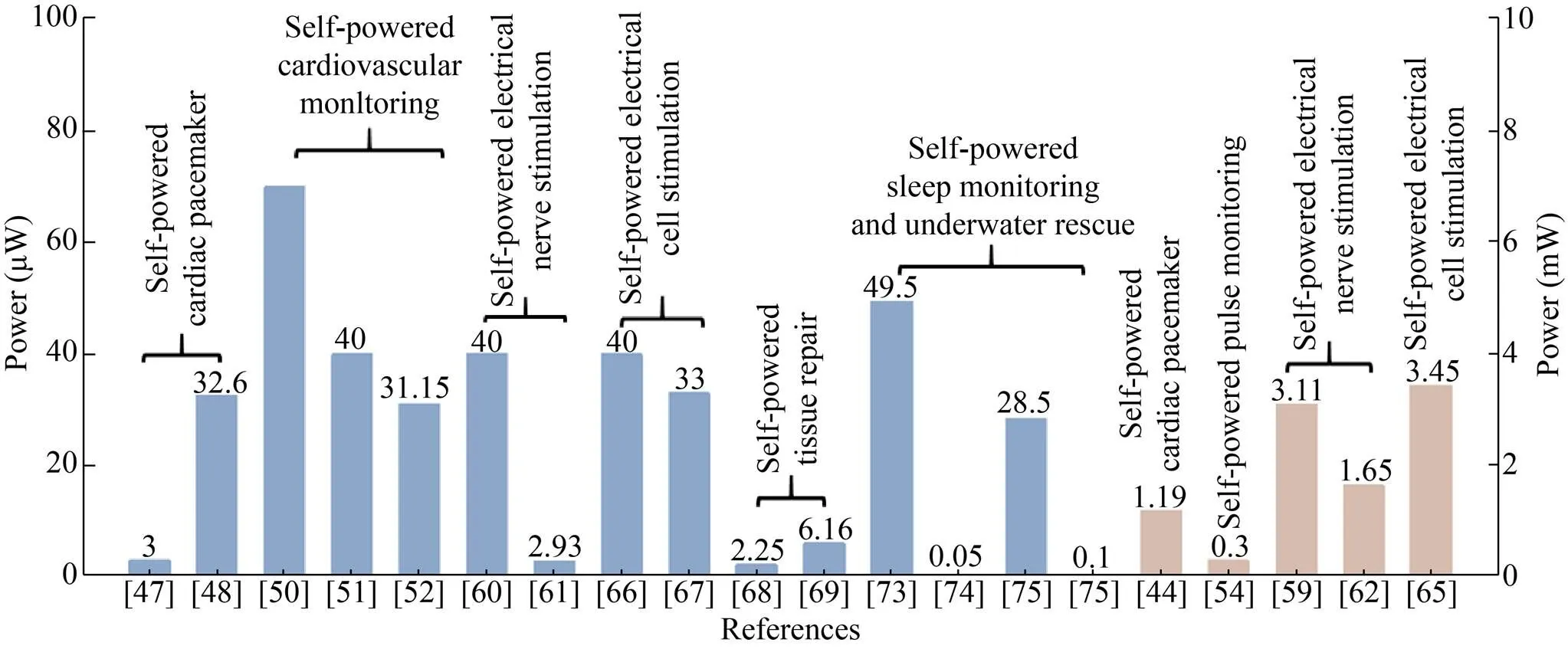
图10 文献中自驱动健康监测及生理功能调节器件输出功率对比
7 讨论与展望
人体及其他动物身上蕴藏着很多种能量,包括化学能、热能及机械能[76]。研究者提出了各种策略对不同形式的能量进行收集,进而构建自驱动医疗电子系统,这类研究对可穿戴、可植入医疗器件的发展具有重要意义。本文主要聚焦纳米发电机从人体及动物体运动中收集机械能,并将其用于自驱动健康监测和生理功能调节。
多种纳米发电机被用于生物医疗领域,包括心血管传感、脉搏监测、神经电刺激、细胞电刺激、睡眠监测及救援报警等。除了综述中提到的应用外,纳米发电机在其他领域也有重要应用,如药物递送[77]、语音识别[78]、生物监测[79]。这些自驱动生物医疗器件将会对未来医疗健康产业产生重要影响。但是,这些应用只是自驱动健康监测及生理功能调节领域的开始,为充分合理利用基于纳米发电机的自驱动医疗系统,还需要更多更深入的研究。首先,对于可植入场景,纳米发电机应更加小型化,以适应身体的特定腔室。其次,纳米发电机需要更加柔软更加耐用以满足植入位点的机械性能及形状,并耐受肌肉组织的长期包裹挤压。此外,纳米发电机需要更加有效、耐用、柔性的封装以保护其免受体液腐蚀。最后,纳米发电机输出性能的优化及电源管理需要进一步增强以符合实际临床要求。对于可穿戴纳米发电机,小型化、耐用性、封装及电学输出的问题也很重要。
随着材料合成和微纳加工技术的不断发展,纳米发电的研究及其在生物医疗领域的应用也不断进步。未来纳米发电机在自驱动健康监测及生理功能调节方面的研究重点是和现代医学实现精准结合。当前纳米发电机的研究和实际临床应用依然存在较大差距。首先,植入式纳米发电机作为心血管传感器可以独立工作并实现无线数据传输。但是,植入式纳米发电机向心血管的植入手术复杂,手术可能会影响这些器官的正常功能。因此,这类器件的应用标准会非常高,这导致基于纳米发电机的传感应用比较滞后。其次,纳米发电机收集身体动能并将其和能源管理系统整合是另一项挑战,因为只有特定参数的电学刺激才能起到器官功能增强及细胞调控的作用。第三,研究者进行了很多实验,将纳米发电机植入到动物体内,收集肌肉收缩机械能,或者线性马达刺激纳米发电机产生电能,或者外部手拍打纳米发电机产生电能。但是至今依然很难有一种方法能够在体内将能量产生、能量管理、能量输出及应用一体化。笔者认为纳米发电机作为植入式器件最优的应用方向是收集呼吸机械能,即呼吸过程中胸腔的规律性扩张运动,为心脏起搏器或脊柱损伤修复提供电能。对于穿戴式纳米发电机,脉搏传感是一种非常合适和有前景的应用,也可将其用于某些表皮电刺激治疗,例如,伤口愈合或表皮肿瘤消除。
[1] Bonawitz SC. Management of exposure of cardiac pacemaker systems. Ann Plas Surg, 2012, 69(3): 292–295.
[2] Li H, Zhao CC, Wang XX, et al. Fully bioabsorbable capacitor as an energy storage unit for implantable medical electronics. Adv Sci, 2019, 6(6): 1801625.
[3] Hannig J, Siekmeier R. Quality of the cardiac defibrillators from 2005 to 2014 from the federal institute for drugs and medical devices in presence of product problems published by customer informations. Wien Klin Wochenschr, 2016, 128: S262–S263.
[4] Mond HG, Sloman JG, Edwards RH. The first pacemaker. Pac Clin Electrophysiol, 1982, 5(2): 278–282.
[5] Akbari S, Shea HR. An array of 100 μm×100 μm dielectric elastomer actuators with 80% strain for tissue engineering applications. Sens Actuat A, 2012, 186: 236–241.
[6] Soon CF, Youseffi M, Berends RF, et al. Development of a novel liquid crystal based cell traction force transducer system. Biosens Bioelectron, 2013, 39(1): 14–20.
[7] Ko WH. Early history and challenges of implantable electronics. ACM J Emerg Technol Comput Syst, 2012, 8(2): 8.
[8] Von Lueder TG, Krum H. Current modalities for invasive and non-invasive monitoring of volume status in heart failure. Heart, 2012, 98(13): 967–973.
[9] Horlbeck FW, Mellert F, Kreuz J, et al. Real-world data on the lifespan of implantable cardioverter- defibrillators depending on manufacturers and the amount of ventricular pacing. J Cardiovasc Electrophysiol, 2012, 23(12): 1336–1342.
[10] Hwang GT, Byun M, Jeong CK, et al. Flexible piezoelectric thin-film energy harvesters and nanosensors for biomedical applications. Adv Healthcare Mater, 2015, 4(5): 646–658.
[11] Feng HQ, Zhao CC, Tan PC, et al. Nanogenerator for biomedical applications. Adv Healthcare Mater, 2018, 7(10), 1701298.
[12] Proto A, Penhaker M, Conforto S, et al. Nanogenerators for human body energy harvesting. Trends Biotechnol, 2017, 35(7): 610–624.
[13] Zheng Q, Shi BJ, Li Z, et al. Recent progress on piezoelectric and triboelectric energy harvesters in biomedical systems. Adv Sci, 2017, 4(7): 1700029.
[14] Yuan MM, Cheng L, Xu Q, et al. Biocompatible nanogenerators through high piezoelectric coefficient 0.5Ba(Zr0.2Ti0.8)O3-0.5(Ba0.7Ca0.3)TiO3nanowires forapplications. Adv Mater, 2014, 26(44): 7432–7437.
[15] Yu YH, Sun HY, Orbay H, et al. Biocompatibility and in vivo operation of implantable mesoporous PVDF-based nanogenerators. Nano Energy, 2016, 27: 275–281.
[16] Amar A, Kouki A, Cao H. Power approaches for implantable medical devices. Sensors, 2015, 15(11): 28889–28914.
[17] Bhatnagar V, Owende P. Energy harvesting for assistive and mobile applications. Energy Sci Eng, 2015, 3(3): 153–173.
[18] Chen XL, Li XM, Shao JY, et al. High-performance piezoelectric nanogenerators with imprinted P(VDF-TrFE)/BaTiO3nanocomposite micropillars for self-powered flexible sensors. Small, 2017, 13(23): 1604245.
[19] Wang ZL, Yang RS, Zhou J, et al. Lateral nanowire/nanobelt based nanogenerators, piezotronics and piezo-phototronics. Mater Sci Eng R, 2010, 70(3/6): 320–329.
[20] Zhang Y, Liu Y, Wang ZL. Fundamental theory of piezotronics. Adv Mater, 2011, 23(27): 3004–3013.
[21] Yang RS, Qin Y, Dai LM, et al. Power generation with laterally packaged piezoelectric fine wires. Nat Nanotechnol, 2009, 4(1): 34–39.
[22] Liu Z, Ouyang H, Zou Y, et al. Self-powered implantable electronic medical devices research based on triboelectric nanogenerator. Sci Sin Tech, 2017, 47(10): 1075–1080 (in Chinese).刘卓, 欧阳涵, 邹洋, 等. 基于摩擦纳米发电机的自驱动植入式电子医疗器件的研究. 中国科学: 技术科学, 2017, 47(10): 1075–1080.
[23] Wang SH, Lin L, Wang ZL. Nanoscale triboelectric-effect-enabled energy conversion for sustainably powering portable electronics. Nano Lett, 2012, 12(12): 6339–6346.
[24] Lin L, Wang SH, Xie YN, et al. Segmentally structured disk triboelectric nanogenerator for harvesting rotational mechanical energy. Nano Lett, 2013, 13(6): 2916–2923.
[25] Bai P, Zhu G, Liu Y, et al. Cylindrical rotating triboelectric nanogenerator. ACS Nano, 2013, 7(7): 6361–6366.
[26] Niu SM, Liu Y, Wang SH, et al. Theoretical investigation and structural optimization of single-electrode triboelectric nanogenerators. Adv Funct Mater, 2014, 24(22): 3332–3340.
[27] Yang Y, Zhang HL, Chen J, et al. Single-electrode- based sliding triboelectric nanogenerator for self- powered displacement vector sensor system. ACS Nano, 2013, 7(8): 7342–7351.
[28] Niu SM, Wang SH, Liu Y, et al. A theoretical study of grating structured triboelectric nanogenerators. Energy Environ Sci, 2014, 7(7): 2339–2349.
[29] Wang SH, Niu SM, Yang J, et al. Quantitative measurements of vibration amplitude using a contact- mode freestanding triboelectric nanogenerator. ACS Nano, 2014, 8(12): 12004–12013.
[30] Kwon J, Seung W, Sharma BK, et al. A high performance PZT ribbon-based nanogenerator using graphene transparent electrodes. Energy Environ Sci, 2012, 5(10): 8970–8975.
[31] Wang AC, Liu Z, Hu M, et al. Piezoelectric nanofibrous scaffolds asenergy harvesters for modifying fibroblast alignment and proliferation in wound healing. Nano Energy, 2018, 43: 63–71.
[32] Pi ZY, Zhang JW, Wen CY, et al. Flexible piezoelectric nanogenerator made of poly (vinylidenefluoride-co-trifluoroethylene)(PVDF-TrFE) thin film. Nano Energy, 2014, 7: 33–41.
[33] Jeong CK, Park KI, Son JH, et al. Self-powered fully-flexible light-emitting system enabled by flexible energy harvester. Energy Environ Sci, 2014, 7(12): 4035–4043.
[34] Jeong CK, Han JH, Palneedi H, et al. Comprehensive biocompatibility of nontoxic and high-output flexible energy harvester using lead-free piezoceramic thin film. Apl Mater, 2017, 5(7): 074102.
[35] Zhang C, Tang W, Han CB, et al. Theoretical comparison, equivalent transformation, and conjunction operations of electromagnetic induction generator and triboelectric nanogenerator for harvesting mechanical energy. Adv Mater, 2014, 26(22): 3580–3591.
[36] Zheng Q, Jin YM, Liu Z, et al. Robust multilayered encapsulation for high-performance triboelectric nanogenerator in harsh environment. ACS Appl Mater Interfaces, 2016, 8(40): 26697–26703.
[37] Zhang NN, Tao CY, Fan X, et al. Progress in triboelectric nanogenerators as self-powered smart sensors. J Mater Res, 2017, 32(9): 1628–1646.
[38] Xu W, Huang LB, Wong MC, et al. Environmentally friendly hydrogel-based triboelectric nanogenerators for versatile energy harvesting and self-powered sensors. Adv Energy Mater, 2017, 7(1): 1601529.
[39] Ma MY, Zhang Z, Liao QL, et al. Integrated hybrid nanogenerator for gas energy recycle and purification. Nano Energy, 2017, 39: 524–531.
[40] Liang QJ, Zhang Q, Yan XQ, et al. Recyclable and green triboelectric nanogenerator. Adv Mater, 2017, 29(5): 1604961.
[41] Nelson GD. A brief history of cardiac pacing. Tex Heart Inst J, 1993, 20(1): 12–18.
[42] Liu Z, Wang L, Li H, et al. Research and application of implanted triboelectric nanogenerator. Sci Techol Rev, 2017, 35(2): 65–71 (in Chinese).刘卓, 王玲, 李虎, 等. 植入式摩擦纳米发电机的研究与应用. 科技导报, 2017, 35(2): 65–71.
[43] Li Z, Zhu G, Yang RS, et al. Muscle-drivennanogenerator. Adv Mater, 2010, 22(23): 2534–2537.
[44] Hwang GT, Park H, Lee JH, et al. Self-powered cardiac pacemaker enabled by flexible single crystalline PMN-PT piezoelectric energy harvester. Adv Mater, 2014, 26(28): 4880–4887.
[45] Southcott M, MacVittie K, Halámek J, et al. A pacemaker powered by an implantable biofuel cell operating under conditions mimicking the human blood circulatory system-battery not included. Phys Chem Chem Phys, 2013, 15(17): 6278–6283.
[46] Dagdeviren C, Yang BD, Su YW, et al. Conformal piezoelectric energy harvesting and storage from motions of the heart, lung, and diaphragm. Proc Natl Acad Sci USA, 2014, 111(5): 1927–1932.
[47] Zheng Q, Shi BJ, Fan FR, et al.powering of pacemaker by breathing-driven implanted triboelectricnanogenerator. Adv Mater, 2014, 26(33): 5851–5856.
[48] Ouyang H, Liu Z, Li N, et al. Symbiotic cardiac pacemaker. Nat Commun, 2019, 10: 1821.
[49] Ouyang H, Qu XC, Shi BJ, et al. Recent progress on nanogenerator for implantable self-powered biomedical systems. Life Sci Inst, 2017, 15(6): 3–14 (in Chinese).欧阳涵, 曲学铖, 石波璟, 等. 纳米发电机与自驱动植入式电子医疗系统的研究进展. 生命科学仪器, 2017, 15(6): 3–14.
[50] Zheng Q, Zhang H, Shi BJ, et al.self-powered wireless cardiac monitoring via implantable triboelectric nanogenerator. ACS Nano, 2016, 10(7): 6510–6518.
[51] Ma Y, Zheng Q, Liu Y, et al. Self-powered, one-stop, and multifunctional implantable triboelectric active sensor for real-time biomedical monitoring. Nano Lett, 2016, 16(10): 6042–6051.
[52] Kim DH, Shin HJ, Lee H, et al.self-powered wireless transmission using biocompatible flexible energy harvesters. Adv Funct Mater, 2017, 27(25): 1700341.
[53] Liu Z, Ma Y, Ouyang H, et al. Transcatheter self-powered ultrasensitive endocardial pressure sensor. Adv Funct Mater, 2018, 29(3): 1807560.
[54] Ouyang H, Tian JJ, Sun GL, et al. Self-powered pulse sensor for antidiastole of cardiovascular disease. Adv Mater, 2017, 29(40): 1703456.
[55] Park DY, Joe DJ, Kim DH, et al. Self-powered real-time arterial pulse monitoring using ultrathin epidermal piezoelectric sensors. Adv Mater, 2017, 29(37): 1702308.
[56] Dagdeviren C, Shi Y, Joe P, et al. Conformal piezoelectric systems for clinical and experimental characterization of soft tissue biomechanics. Nat Mater, 2015, 14(7): 728–736.
[57] Mayberg HS, Lozano AM, Voon V, et al. Deep brain stimulation for treatment-resistant depression. Neuron, 2005, 45(5): 651–660.
[58] Deuschl G, Schade-Brittinger C, Krack P, et al. A randomized trial of deep-brain stimulation for Parkinson’s disease. N Engl J Med, 2006, 355(9): 896–908.
[59] Hwang GT, Kim Y, Lee JH, et al. Self-powered deep brain stimulation via a flexible PIMNT energy harvester. Energy Environ Sci, 2015, 8(9): 2677–2684.
[60] Yao G, Kang L, Li J, et al. Effective weight control via an implanted self-powered vagus nerve stimulation device. Nat Commun, 2018, 9: 5349.
[61] Lee S, Wang H, Wang JH, et al. Battery-free neuromodulator for peripheral nerve direct stimulation. Nano Energy, 2018, 50: 148–158.
[62] Wang JH, Wang H, Thakor NV, et al. Self-powered direct muscle stimulation using a triboelectric nanogenerator (TENG) integrated with a flexible multiple-channel intramuscular electrode. ACS Nano, 2019, 13(3): 3589–3599.
[63] Gao A, Hang RQ, Huang XB, et al. The effects of titania nanotubes with embedded silver oxide nanoparticles on bacteria and osteoblasts. Biomaterials, 2014, 35(13): 4223–4235.
[64] Pretel H, Lizarelli RFZ, Ramalho LTO. Effect of low-level laser therapy on bone repair: Histological study in rats. Lasers Surg Med, 2007, 39(10): 788–796.
[65] Tang W, Tian JJ, Zheng Q, et al. Implantable self-powered low-level laser cure system for mouse embryonic osteoblasts’ proliferation and differentiation. ACS Nano, 2015, 9(8): 7867–7873.
[66] Zheng Q, Zou Y, Zhang YL, et al. Biodegradable triboelectric nanogenerator as a life-time designed implantable power source. Sci Adv, 2016, 2(3): e1501478.
[67] Jiang W, Li H, Liu Z, et al. Fully bioabsorbable natural-materials-based triboelectric nanogenerators. Adv Mater, 2018, 30(32): 1801895.
[68] Long Y, Wei H, Li J, et al. Effective wound healing enabled by discrete alternative electric fields from wearable nanogenerators. ACS Nano, 2018, 12(12): 12533–12540.
[69] Li Z, Feng HQ, Zheng Q, et al. Photothermally tunable biodegradation of implantable triboelectric nanogenerators for tissue repairing. Nano Energy, 2018, 54: 390–399.
[70] Mahowald MW, Schenck CH. Insights from studying human sleep disorders. Nature, 2005, 437(7063): 1279–1285.
[71] Viventi J, Kim DH, Vigeland L, et al. Flexible, foldable, actively multiplexed, high-density electrode array for mapping brain activity in vivo. Nat Neurosci, 2011, 14(12): 1599–1605.
[72] Dobrescu AI, Ardelean L, Matei C, et al. Polysomnography test and sleep disordered breathing in prader-willi syndrome. Mater Plast, 2014, 51: 331–335.
[73] Song WX, Gan BH, Jiang T, et al. Nanopillar arrayed triboelectric nanogenerator as a self-powered sensitive sensor for a sleep monitoring system. ACS Nano, 2016, 10(8): 8097–8103.
[74] Lin ZM, Yang J, Li XS, et al. Large-scale and washable smart textiles based on triboelectric nanogenerator arrays for self-powered sleeping monitoring. Adv Funct Mater, 2018, 28(1): 1704112.
[75] Zou Y, Tan PC, Shi BJ, et al. A bionic stretchable nanogenerator for underwater sensing and energy harvesting. Nat Commun, 2019, 10: 2695.
[76] Dagdeviren C, Li Z, Wang ZL. Energy harvesting from the animal/human body for self-powered electronics. Annu Rev Biomed Eng, 2017, 19(1): 85–108.
[77] Song PY, Kuang SY, Panwar N, et al. A self-powered implantable drug-delivery system using biokinetic energy. Adv Mater, 2017, 29(11): 1605668.
[78] Yang J, Chen J, Su YJ, et al. Eardrum-inspired active sensors for self-powered cardiovascular system characterization and throat-attached anti-interference voice recognition. Adv Mater, 2015, 27(8): 1316–1326.
[79] Kim DI, Trung TQ, Hwang BU, et al. A sensor array using multi-functional field-effect transistors with ultrahigh sensitivity and precision for bio-monitoring. Sci Rep, 2015, 5: 12705.
Progress in self-powered health monitoring and physiological function regulation devices
Hu Li1, Luming Zhao2, Zhe Li2, Fan Ni3, Zhuo Liu1, Ruping Liu3, Yubo Fan1, and Zhou Li2
1 School of Biological Science and Medical Engineering, Beihang University, Beijing 100083, China 2 Beijing Institute of Nanoenergy and Nanosystems, Chinese Academy of Sciences, School of Nanoscience and Technology, University of Chinese Academy of Sciences, Beijing 100083, China 3 School of Printing and Packaging Engineering, Beijing Institute of Graphic Communication, Beijing 102600, China
Nanogenerator (triboelectric nanogenerator and piezoelectric nanogenerator) has experienced a rapid development since it was proposed. This technique can covert various mechanical energies into electric energy, including human motion energy, wind energy, acoustic energy and ocean energy. The converted electricity can be used for health monitoring and physiological function regulation, such as pulse detection, bioelectrical stimulation and cardiac pacing. This review summarizes the structure, working mechanism, output performance of nanogenerator and its latest progress in circulatory system, nervous system, biological tissue, sleep and rescue system. Additionally, a further analysis was also made on the application challenge of nanogenerator in clinical treatment. In the future, nanogenerator is expected to be an auxiliary power source, or even to replace battery to power medical electronic device and realize the self-powered health monitoring and physiological function regulation of human body.
self-powered, health monitoring, physiological function regulation, nanogenerator
June 25, 2019;
September 11, 2019
National Key R&D Project from Minister of Science and Technology, China (No. 2016YFA0202703), National Natural Science Foundation of China (Nos. 61875015, 31571006, 81601629, 61971049, 21801019, 11421202), the Beijing Municipal Science and Technology Commission (No. Z181100004418004), Beijing Natural Science Foundation (No. 2182091), the Research and Development Program of BIGC (No. Ec201808), the National Youth Talent Support Program.
s:Yubo Fan. Tel: +86-10-82339428; E-mail: yubofan@buaa.edu.cnZhou Li. Tel: +86-10-82854761; E-mail: zli@binn.cas.cn
国家重点研发计划 (No. 2016YFA0202703),国家自然科学基金 (Nos. 61875015, 31571006, 81601629, 61971049, 21801019, 11421202),北京市科技项目 (No. Z181100004418004),北京市自然科学基金 (No. 2182091),北京印刷学院研究发展项目 (No. Ec201808),国家万人计划“青年拔尖”项目资助。
李虎, 赵璐明, 李喆, 等. 自驱动健康监测及生理功能调节器件的研究进展. 生物工程学报, 2019, 35(12): 2367–2385.
Li H, Zhao LM, Li Z, et al. Progress in self-powered health monitoring and physiological function regulation devices. Chin J Biotech, 2019, 35(12): 2367–2385.
(本文责编 陈宏宇)
