禾谷炭疽菌CgRab5A的亚细胞定位研究
2019-12-27刘涵孟成真刘玉青李秀红石晓玲齐尧尧张桂玲
刘涵 孟成真 刘玉青 李秀红 石晓玲 齐尧尧 张桂玲

摘 要:为明确禾谷炭疽菌(Colletotrichum graminicola)中CgRab5A(GLRG_00019)蛋白在细胞内的定位特点,利用多片段一步克隆法将CgRab5A自身启动子、GFP片段和CgRab5A开放阅读框(ORF)片段克隆到pKNT载体上,转化野生型禾谷炭疽菌的原生质体后,通过新霉素抗性筛选获得阳性候选转化子,利用共聚焦显微镜观察GFP-CgRab5A在菌丝和孢子内的定位情况。结果表明,一步克隆法获得的pKNT-GFP-CgRab5A重组载体经测序后序列完全正确,亚细胞定位观察发现GFP-CgRab5A在菌丝和孢子细胞内均呈点状分布,定位于早期内涵体上,暗示其可能参与早期内涵体的相关调控过程。
关键词:禾谷炭疽菌;CgRab5A;亚细胞定位
中图分类号 S432.1文献标识码 A文章编号 1007-7731(2019)22-0099-04
Study on Subcellular Localization of CgRab5A In Colletotrichum graminicola
Liu Han et al.
(College of Agriculture and Forestry Science,Linyi University,Linyi 276000,China)
Abstract:In order to clarify the cellular characteristics of CgRab5A (GLRG_00019) from Colletotrichum graminicola,firstly native promoter and ORF of CgRab5A,GFP were cloned to pKNT vector by multis one step cloning method. And then the recombinant plasmid was transferred to protoplast of wild type C. graminicola and positive candidates were screened by neomycin resistance. Finally,the localization of GFP-CgRab5A in mycelia and spores was observed by confocal microscope. The results showed that the recombinant vector of pKNT-GFP-CgRab5A was completely right by sequencing,and the subcellular localization observation showed that GFP-CgRab5A was distributed in the mycelia and spore cells in a spot-like manner and located on the early endosomes,suggesting that it may play important roles in regulating early endosome. This study provided clues for the further analysis of the functions of CgRab5A,and also lays a theoretical foundation for illuminating of the pathogenic mechanism of C. graminicola.
Key words:C. graminicola;CgRab5A;Subcellular localization
1 前言
炭疽菌(Colletotrichum)是一种广泛分布于全球的真菌,约有600多个属,能侵染超过3200种植物,包括重要的农作物如玉米和高粱[1],因此被评为全球最重要的植物病原真菌之一[2]。禾谷炭疽菌(Colletotrichum graminicola)是一种半活体营养型真菌,能引起玉米的叶枯病和茎腐病,据估计,每年给玉米产地造成的损失高达40%,相当于美国一年损失10亿美元[3]。该病原菌能侵染玉米不同的组织,像叶片、茎秆、根部,在病死植株上腐生越冬作为来年的侵染源[4,5]。禾谷炭疽菌在侵入植物、扩展蔓延和病害发生的整个过程涉及到复杂的蛋白运输过程,然而Rab蛋白作为蛋白运输的核心调控因子,其具体功能尚未明确。
Rab蛋白作为分子开关,通过与上游调控因子和下游效应因子的相互作用,实现GTP激活态和GDP失活态的转变,调控囊泡的出芽、转运、粘附、锚定与融合等胞吞和胞吐的各个过程[6]。其成员Rab5在真核细胞内是高度保守的,在动物、植物和真菌中均有研究。在哺乳动物中参与早期胞吞作用的多个过程,包括网格衣壳蛋白内吞囊泡的形成和脱壳、囊泡与早期内涵体的融合、早期内涵体在细胞骨架上的移动以及利用与效应因子相互作用完成信号转导过程,还有自噬作用、染色体线性化等过程[7-9]。近来研究发现该蛋白在丝状真菌的生长发育和侵染致病过程中发挥重要作用。在构巢曲霉中,RabA和RabB分别是Ypt51和Ypt52的同源蛋白,两者都定位于早期内涵体上,功能存在重叠,ΔrabA和ΔrabB都影响构巢曲霉的生长,但只有ΔrabB阻碍早期内涵体的移动,是早期内涵体降解的唯一中介。此外,RabB和RabA(较小程度)能招募CORVET复合体到内涵体膜上[10-11]。最近禾谷镰刀菌鉴定出2个Rab5同源蛋白(FgRab51和FgRab52)均定位于早期內涵体上,这2个蛋白功能存在冗余,缺失后都影响了菌丝的生长、孢子萌发和致病性,但是FgRAB52对生长发育更为重要[12]。稻瘟病菌含有酵母Ypt51和Ypt52的同源蛋白MoRab5A和MoRab5B,尽管两者都定位于早期内涵体上,共同参与稻瘟病菌的生长发育、产孢过程、黑色素合成、液泡融合、胞吞作用、有性生殖和致病过程,但两者的生化特点不同,独立发挥作用[13-14]。
本课题组前期通过生物信息学的方法鉴定出禾谷炭疽菌Rab5的1个同源蛋白CgRab5A[15],共含有237个氨基酸,长度714bp,利用在线软件预测该蛋白主要定位于高尔基体,与文献报道不相符。为了明确该蛋白在细胞内的具体分布特点,本研究利用共聚焦显微镜观察其亚细胞定位,旨在为深入分析其具体功能奠定基础。
2 材料与方法
2.1 材料
2.1.1 禾谷炭疽菌菌株和载体 禾谷炭疽菌的菌株M2由中国农业科学院植物保护研究所的刘文德研究员惠赠。pkNTG质粒由福建农林大学鲁国东教授惠赠。
2.1.2 生化试剂 PhantaTM Super-Fidelity DNA Polymerase和ClonExpress?MultiS One Step Cloning Kit均购自Vazyme公司,XhoI和EcoRI限制性内切酶均购自NEB公司;PCR扩增Golden Easy PCR System、DH5α感受态细胞、通用性DNA纯化回收试剂盒和质粒小提试剂盒均购自天根公司;溶壁酶和崩溃酶均购自Sigma公司;PEG3350和新霉素均购自生工生物工程(上海)有限公司。引物合成和测序分析均由擎科完成。
2.1.3 培养基 LB培养基:氯化钠10g/L、胰蛋白胨10g/L、酵母提取物5g/L(固体培养基中加入琼脂粉15g/L);
CMII培养基:20×硝酸盐母液50mL/L、1000×微量元素母液1mL/L、维生素母液1mL/L;葡萄糖10g/L、蛋白胨2g/L、酵母提取物1g/L、酸水解酪蛋白1g/L(固体培养基加入琼脂粉15g/L)。
20×硝酸盐母液:硝酸钠120g/L、氯化钾10.4g/L、七水硫酸镁10.4g/L、磷酸二氢钾30.4g/L(高压灭菌后4℃保存);
1000×微量元素母液(100mL):七水硫酸锌2.2g、硼酸1.1g、四水氯化锰0.5g、七水硫酸亚铁0.5g、六水氯化钴0.17g、五水硫酸铜0.16g、二水锰酸钠0.15g、乙二胺四乙酸四钠5g(4℃保存);
维生素母液(100mL):生物素0.01g、维生素B0.01g、硫胺素0.01g/L、核黄素0.01g、对氨基甲苯0.01g、烟酸0.01g(棕色瓶4℃保存)。
TB3培养基:蔗糖200g/L、酵母提取物3g/L、胰蛋白胨3g/L(固体培养基加入琼脂粉15g/L)
2.2 方法
2.2.1 引物的设计 首先利用http://www.cbs.dtu.dk/services/Promoter/网站预测CgRab5A的启动子,然后利用Primer5对启动子区域、ORF区域和GFP进行引物设计,最后在设计好的引物上添加GFP接头和酶切位点。
2.2.2 重组质粒的构建 首先以野生型菌株CgM2的DNA为模板,根据PhantaTM Super-Fidelity DNA Polymerase的反应体系和条件,利用CgRab5A-PF/PR和OF/OR两对引物分别扩增CgRab5A的启动子和ORF、GFP-F/R扩增GFP片段;然后利用ClonExpress?MultiS重组克隆试剂盒将纯化回收后的启动子、GFP和ORF片段与XhoI/EcoRI双酶切后的pKNT片段进行连接;最后挑取单克隆,经PCR和测序验证后得到包含自身启动子的GFP-CgRab5A重组质粒,用于后续的转化实验。
2.2.3 原生質体的制备和转化 原生质体的制备和转化参考Wang[16]的方案稍作修改:(1)培养基换为CMII培养基;(2)裂解液为溶壁酶和崩溃酶,终浓度分别是为20和5mg/mL,裂解时间为4-6h;(3)抗性筛选为新霉素,下层终浓度为200μg/mL,上层浓度为400 μg/mL。
2.2.4 候选转化子的验证 首先利用无菌牙签将上层菌落挑取到CMII固体培养基上,于26℃培养3d后刮取菌丝到含有石英砂的2.0mL离心管中;然后加入400μLDNA粗提buffer(1M Tris-HCl pH8.0、0.5M EDTA pH8.0、20%SDS、5M NaCl),涡旋混匀后,经氯仿抽提和无水乙醇沉淀后,溶解于无菌水中;最后对DNA进行PCR验证,其中PCR体系(25μL)包括DNA模板10ng、引物pKNTG-F和CgRab5A-OR各0.2μ mol/L、2x Reaction Mix和Golden DNA Polymerase12.5μL,PCR扩增程序为94℃预变性3min,94℃变性30s、60℃复性30s、72℃延伸5min15s、循环数为30,72℃延伸7min后于4℃保存。
2.2.5 亚细胞定位观察 CgRab5A的亚细胞定位观察是将候选转化子挑取到CMII固体培养基上,4d后挑取菌丝到载玻片上,制备样品。同时用膜结合染料FM4-64处理5min后于共聚焦显微镜下观察CgRab5A与FM4-64的共定位情况。
3 结果与分析
3.1 CgRab5A引物 本实验中用到的引物序列如表1所示。其中CgRab5A-PF/PR首先通过在线网站预测CgRab5A的启动子可能在ORF区域上游2700bp左右的位置(Score值为1.084),因此选定ORF上游大概3000bp核苷酸用Primer5设计引物得到CgRab5A-PF/PR,并在其CgRab5A-PF前面加上pKNT XhoI无缝接头序列GGGTACCGGGCCCCCCCTCGAG,在CgRab5A-PR前面加上GFP的前接头TCCTCGCCCTTGCTCACCAT。GFP片段的扩增引物GFP-F/R则是从GFP序列中起始密码子和去除终止密码子后开始各取20个碱基得到的。CgRab5A片段扩增的前引物CgRab5A-OF是从起始密码子开始取20个碱基,并在前面加上GFP的后接头CACTCACGGCATGGACGAGCTGTACAAG获得的,而扩增的后引物则是用Primer 5 对CgRab5A的ORF和3′端UTR序列进行设计获得,并在CgRab5A-OR前面加上pKNT EcoRI无缝接头CCCCCGGGCTGCAGGAATTC。
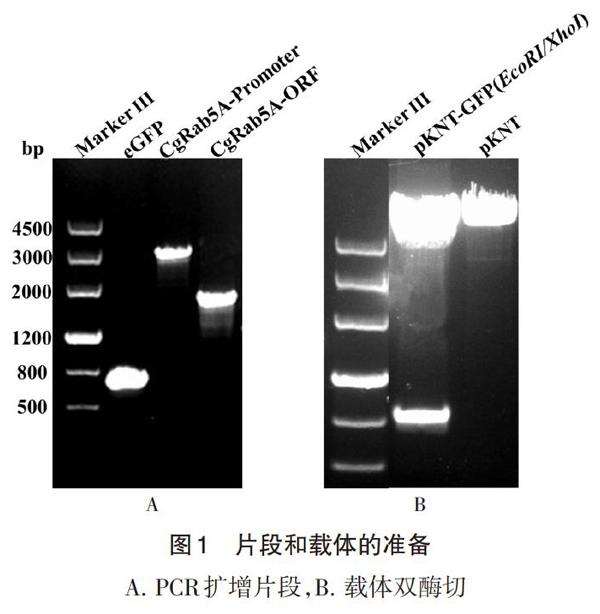
3.2 GFP、CgRab5A自身启动子、ORF片段和pKNT载体 首先PCR扩增GFP、CgRab5A自身启动子和ORF片段各100μL,然后利用天根公司的DNA琼脂糖胶回收试剂盒纯化回收得到35μLDNA片段,取3μLDNA片段利用1%的琼脂糖凝胶检测,结果如图1A所示,GFP大小为717bp,条带介于500bp和800bp条带之间,CgRab5A片段大小为1594bp大小介于800bp和2000bp之间,而启动子大小为2740bp,条带接近3000bp,结果表明这3个片段的大小与理论值一致,可以用于后续实验。
由于Rab蛋白的C末端含有异戊二烯化基序,与GFP等标签蛋白进行融合时通常将标签加到N末端,因此本研究首先利用EcoRI和XhoI对pKNTG载体进行双酶切,切除容易连接到基因C末端的GFP标签,结果如图1B所示,双酶切可以看到pKNT和GFP两条带,切取pKNT片段进行琼脂糖凝胶回收后,取3μL利用1%琼脂糖凝胶检测DNA,结果如图1B所示,pKNT片段大于4500bp,大小正确。
A. PCR扩增片段,B. 载体双酶切
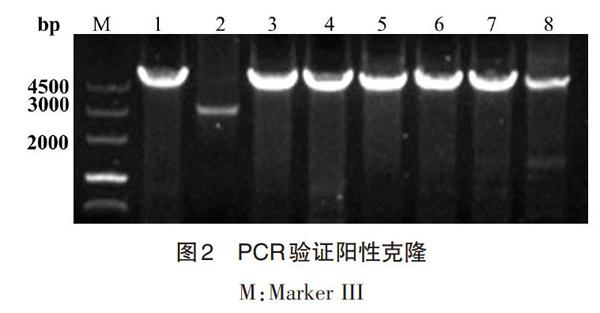
3.3 pKNT-GFP-CgRab5A重组载体 将上述得到的pKNT载体、启动子、GFP片段和CgRab5A片段根据ClonExpress?MultiS One Step Cloning Kit的说明进行连接,转化到DH5α感受态细胞中,挑取单克隆用CgRab5A-PF/OR进行验证。结果如图2所示,共挑取8个单克隆进行PCR,只有第2个单克隆大小与理论值(5051bp)不符,最终挑取第1、5和6等3个克隆扩大培养并进行测序(测通),发现第1个克隆序列完全正确,命名为pKNT-GFP-CgRab5B-1,提取质粒用于后续转化实验。
M:Marker III
3.4 GFP-CgRab5A阳性转化子 将pKNT-GFP-CgRab5A质粒转化野生型禾谷炭疽菌CgM2的原生质体中,通过新霉素筛选共获得12个候选转化子,利用CTAB粗提法提取候选转化子的DNA,结果如图3A所示,12个候选转化子的DNA条带清晰,大小正确。进而利用引物pKNTG-F和CgRab5A-OR对候选转化子进行PCR验证,结果如图3B所示,除了第2个转化子没有扩增到之外,其他11个转化子都大小与理论值一致。
A:DNA提取,B:PCR验证
3.5 GFP-CgRab5A的定位 FM4-64作为内膜系统的标记染料,因染色时间不同而定位于不同的内膜上,其中染色时间较短时FM4-64首先进入早期内涵体[17]。本研究用FM4-64染色5min后于共聚焦显微镜下观察,发现无论是菌丝还是孢子,GFP-CgRab5A都呈点状分布,能与FM4-64共定位(箭头所示),表明GFP-CgRab5A主要定位于早期内涵体上。
4 结论与讨论
蛋白质的亚细胞定位决定其生物学功能,因此明确禾谷炭疽菌中CgRab5A在细胞内的亚细胞定位有助于解析其生物学功能。本研究根据一步克隆法构建了GFP-CgRab5A融合蛋白载体,通过PCR验证获得候选阳性转化子后,利用共聚焦显微镜观察到CgRab5A主要分布于早期内涵体上呈点状分布,这与之前其他丝状真菌的研究报道是一致的[12-14],表明该蛋白可能在禾谷炭疽菌的生长发育和侵染致病过程中发挥了重要作用。
前期的生物信息學分析发现,CgRab5A含有Pro44氨基酸残基,内源GTPase活性可能较低,暗示其在与效应蛋白的相互作用和早期内涵体分拣过程中发挥作用,但具体的功能还有待于进一步研究。尽管Rab5家族在序列上是高度保守的,但是其成员之间的功能在不同的丝状真菌中却不尽相同。例如,禾谷镰刀菌中的FgRab51和FgRab52的功能存在冗余[12],而稻瘟病菌中的MoRab5A和MoRab5B生化功能不同[13],在稻瘟病菌的生长发育和侵染致病过程中独立发挥作用[14]。禾谷炭疽菌中CgRab5A和CgRab5B两者的具体功能如何,两者是否像已报道的研究中那样存在独立或冗余的功能,亦或者有不同于已有报道的独特的功能,这些都值得深入探究。
参考文献
[1]O′Connell RJ,Thon MR,Hacquard S,et al. Lifestyle transitions in plant pathogenic Colletotrichum fungi deciphered by genome and transcriptome analyses[J]. Nature genetics,2012,44(9):1060-1065.
[2]Dean R,Van Kan JA,Pretorius ZA,et al. The Top 10 fungal pathogens in molecular plant pathology[J]. Molecular plant pathology,2012,13(4):414-430.
[3]Frey TJ,Weldekidan T,Colbert T,et al. Fitness Evaluation of Rcg1 ,a Locus that Confers Resistance to Colletotrichum graminicola (Ces.) G.W. Wils. Using Near-Isogenic Maize Hybrids[J]. Crop Science,2011,51(4):1551.
[4]Sukno SA,Garcia VM,Shaw BD,et al. Root infection and systemic colonization of maize by Colletotrichum graminicola[J]. Applied and environmental microbiology,2008,74(3):823-832.
[5]Perfect SE,Hughes HB,O'Connell RJ,et al. Colletotrichum: A model genus for studies on pathology and fungal-plant interactions[J]. Fungal genetics and biology: FG & B,1999,27(2-3):186-198.
[6]Segev N. GTPases in intracellular trafficking: an overview[J]. Seminars in cell & developmental biology,2011,22(1):1-2.
[7]Serio G,Margaria V,Jensen S,et al. Small GTPase Rab5 participates in chromosome congression and regulates localization of the centromere-associated protein CENP-F to kinetochores[J]. Proceedings of the National Academy of Sciences of the United States of America,2011,08(42):17337-17342.
[8]Luisa C,Pier Paolo DA,Vincent A,et al. Rab5 GTPase controls chromosome alignment through Lamin disassembly and relocation of the NuMA-like protein Mud to the poles during mitosis[J]. Proceedings of the National Academy of Sciences of the United States of America,2011,108(42):17343-17348.
[9]Zerial M,McBride H. Rab proteins as membrane organizers[J]. Nature reviews Molecular cell biology,2001,2(2):107-117.
[10]Abenza J,Pantazopoulou A,Rodriguez J,et al. Long-Distance Movement of Aspergillus nidulans Early Endosomes on Microtubule Tracks[J]. Traffic,2010,10(1):57-75.
[11]Abenza JF,Galindo A,Pantazopoulou A,et al. Aspergillus RabBRab5 integrates acquisition of degradative identity with the long distance movement of early endosomes[J]. Molecular biology of the cell,2010,21(15):2756-2769.
[12]Zheng H,Zheng W,Wu C,et al. Rab GTPases are essential for membrane trafficking-dependent growth and pathogenicity in Fusarium graminearum[J]. Environmental microbiology,2015,17(11):4580-4599.
[13]Qi Y,Marlin MC,Liang Z,et al. Distinct biochemical and functional properties of two Rab5 homologs from the rice blast fungus Magnaporthe oryzae[J]. The Journal of biological chemistry,2014,289(41):28299-28309.
[14]Yang CD,Dang X,Zheng HW,et al. Two Rab5 Homologs Are Essential for the Development and Pathogenicity of the Rice Blast Fungus Magnaporthe oryzae[J]. Frontiers in plant science,2017,8:620.
[15]李源,步偉洋,鲁国东,等.利用生物信息学方法鉴定和分析禾谷炭疽菌Rab蛋白家族[J]. 热带作物学报,2018,39(7):163-169.
[16]Wang CL,Shim WB,Shaw BD. The Colletotrichum graminicola striatin orthologue Str1 is necessary for anastomosis and is a virulence factor[J]. Molecular plant pathology,2016,17(6):931-942.
[17]Fischerparton S,Parton RM,Hickey PC,et al. Confocal microscopy of FM4-64 as a tool for analysing endocytosis and vesicle trafficking in living fungal hyphae[J]. Journal of microscopy,2010,198(3):246-259.
(责编:张 丽)
