利用研磨仪快速提取基因组DNA用于PCR
2019-12-25胡荣飞陈璐瑶张小妮吴均坚何文锦陈由强薛婷
胡荣飞,陈璐瑶,张小妮,吴均坚,何文锦,陈由强,薛婷
福建师范大学a.生命科学学院海洋生物医药与制品产业化开发技术公共服务平台;b.南方海洋研究院福建省微藻种质改良工程技术研究中心;福建福州350117
随着基因编辑工具的发展,尤其是近年来CRISPR/Cas9 技术[1-2]的开发利用,传统的DNA 提取方法已经无法满足高通量的目的基因筛选工作。尤其对于细胞壁较厚的真核生物和一些非常规物种来说,提取DNA 需要进行大量摸索,不仅耗费试剂,更消耗了宝贵的时间。DNA 的提取无非是破除细胞壁使DNA 释放出来,与传统沸水浴、碱裂解、酶解法、反复冻融、液氮研磨不同的是,在本研究中,我们意图更快速有效地破碎细胞壁来释放DNA,因此采用研磨仪研磨的机械方法破碎细胞壁,使其中的DNA 释放出来,以便用于目的基因快速扩增和基因组DNA 测序。研磨仪研磨法影响细胞破碎程度的因素主要有2 个,即研磨频率和研磨时间。我们探究了研磨频率和研磨时间的不同组合对DNA 提取效果的影响,建立了更好的DNA 提取方法。同时,用茂源链霉菌[3-5]、三角褐指藻[6-7]、酿酒酵母[8-9]验证了该方法在不同物种中的可行性,以期建立一种全物种通用的快速提取基因组DNA 用于PCR 的方法。
1 材料与方法
1.1 材料
茂源链霉菌(Streptomyces mobaraensis)11019、酿酒酵母(Saccharomyces cerevisiae)Y1H(Leu2-)、三角褐指藻(Phaeodactylum tricornutum)CCAP 1055/1 均为本实验室保存;Biowest Regular Agarose G-10 购自上海生工公司;1.1× T3 Super PCR Mix 购自擎科生物技术有限公司;裂解缓冲液(1 mmol/L EDTA 2 mL,50 mmol/L 磷酸缓冲液250 mL,5% 甘油50 mL,加ddH2O 定容到1 L);1 mol/L Tris-HCl(pH8.0)。
研磨仪(上海净信实业发展有限公司);5424R 4℃离心机(Eppendorf 公司);PCR 仪、梯度PCR 仪(Applied Biosystems 公司);DYY-6C 电泳仪(北京六一仪器厂);ChemiDOCTMMP 凝胶成像仪(Bio-Rad 公司)。
1.2 引物与PCR 反应条件
引物见表1。反应条件:98℃2 min 预变性;98℃ 10 s 变性,Tm 60~65℃ 10 s 退火,72℃ 5~15 s/kb 延伸,32 个循环;72℃延伸2 min。扩增产物采用0.9%琼脂糖凝胶电泳进行检测。
1.3 用于PCR 的基因组快速提取
取适量样品于2 mL EP 管中,加入2 颗灭菌的4 mm 钢珠、100 μL 裂解缓冲液,放入研磨仪中研磨,研磨结束后将样品放入70℃烘箱或水浴5 min,加入20 μL 1 mol/L 的Tris-HCl,上下颠倒几次使混匀,13 000 r/min 离心3 min,取上清液直接作为模板用于PCR。若对PCR 的模板要求较高,也可用酚氯仿抽提后再进行PCR 实验。
1.4 全基因组的快速提取
在超净工作台中取适量样品放入液氮中冷冻,同时将液氮研磨管和研磨球一同放入液氮中快速冷冻,药匙和2 mL EP 管也一同放入液氮中预冷备用。带上防冻手套,用镊子将样品和研磨球放入液氮研磨管中旋紧,放入研磨仪中研磨。研磨结束后,用液氮预冷的药匙取适量样品粉末于2 mL EP 管中,加入400 μL 裂解缓冲液,于70℃烘箱或水浴5~10 min。加入80 μL 1 mol/L的Tris-HCl,上下颠倒几次使其混匀。加入300 μL DNA 提取液(酚∶氯仿∶异戊醇为25∶24∶1),涡旋2 次,13 000 r/min 离心5 min。将上层水相吸到1.5 mL EP 管中,不要吸到下层有机相,大约吸300 μL 左右的水相。加入2~2.5 倍体积的无水乙醇或95%乙醇(预先在-20℃预冷沉淀效果更好),-20℃沉淀30 min。4℃,13 000 r/min 离心5 min 沉淀DNA,弃上清,沉淀即为DNA。用75%乙醇(-20℃预冷)清洗离心后的DNA,无需将DNA 混起,上下颠倒几次,仅清洗表面即可。4℃下13 000 r/min 离心1~2 min,弃上清后在超净工作台中吹干或室温挥发残留的乙醇,用100 μL ddH2O 溶解。

表1 PCR扩增引物序列
1.5 提取条件的优化
DNA 提取效果受研磨频率和时间的影响。为确定快速提取DNA 的最优条件,设计了不同的研磨频率和研磨时间组合,见表2。
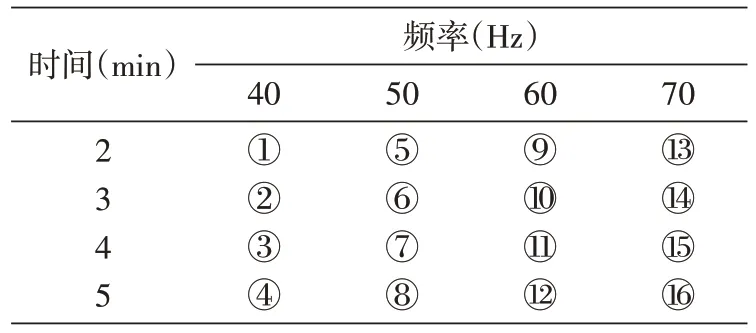
表2 不同研磨时间和频率的组合
2 结果
2.1 最佳DNA 提取方法的确定
用研磨仪破碎细胞时,如果频率过低,研磨力度不够,导致细胞无法破碎,DNA 无法释放出来;而频率过高,则研磨力度过大,会将DNA 打碎,同时还会缩短研磨仪使用寿命。研磨时间过短,研磨不够充分,DNA 也无法释放出来;研磨时间过久也会打碎DNA,还会缩短研磨仪使用寿命。从实验结果可以看出(图1),当研磨频率为40、50 Hz 时,研磨时间从2 min 增加到5 min 时,提取出来的DNA 在0.9%的琼脂糖凝胶上无法看到任何条带,这是由于研磨频率太低,无法破碎细胞,导致DNA 无法释放或释放量极少。将这8个不同条件提取的无法看到条带的DNA 进行PCR,却发现可以得到SSTI 基因扩增条带,说明该方法即使在很低的研磨频率下,提取到的少量DNA 依然可以用于PCR 实验。当研磨频率达到60、70 Hz 时,研磨时间无论是2、3、4 还是5 min,提取出来的DNA 在0.9%的琼脂糖凝胶上均可看到弥散的拖尾条带,在相同研磨频率下,随着研磨时间的增加,DNA 条带越亮;在相同的研磨时间下,随着研磨频率的增大,DNA 条带也越亮。同样利用这8 个条件下提取的DNA 进行PCR 扩增实验,亦都能获得SSTI 基因扩增条带。
由此证明利用研磨仪破碎细胞提取DNA 用于PCR 完全可行,为了降低仪器的损耗和提高PCR 效果,后续实验中选取的研磨频率为60 Hz,研磨时间为2 min。

图1 不同研磨频率和时间下提取的DNA 电泳图和PCR 电泳图
2.2 全基因组的提取
为了满足基因组测序以及重测序的要求,提取的基因组必须片段完整、纯度高。因此,本实验利用研磨仪结合液氮研磨法来提取茂源链霉菌的完整基因组DNA。机械研磨省去了手工研磨的费时费力,且研磨更加充分,液氮冷冻过的样品很容易磨碎,因而实验中只选取研磨频率作为变量,选取的频率为40、50、60、70 Hz,研磨时间固定为2 min。从实验结果(图2)可以看出,当研磨频率为40 Hz 时就足以磨碎细胞壁,释放出DNA,随着研磨频率的增大反而会打碎DNA,出现拖尾弥散甚至较小的DNA 条带。为了提高DNA 的提取质量,降低仪器损耗,综合考虑,用研磨仪液氮研磨样品提取全基因组DNA 时,采用的频率为40 Hz,研磨时间为2 min。
2.3 用于PCR 的基因组快速提取方法在不同物种中的验证
2.3.1 在茂源链霉菌中的验证 在用研磨仪快速破碎茂源链霉菌细胞后,我们选取了2 个基因片段(447 bp 的SSTI 基因和941 bp 的SSTI 基因加上游片段)对粗提的基因组进行PCR 实验,以验证该方法在霉菌中的可行性,结果选取的2 段目的基因均能从快速提取的茂源链霉菌基因组中扩增出来(图3)。
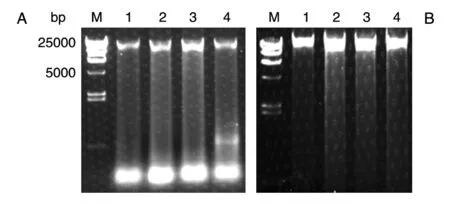
图2 茂源链霉菌全基因组DNA 提取的电泳结果
2.3.2 在三角褐指藻中的验证 该方法可以在茂源链霉菌中成功进行目的基因的扩增,我们又将该方法应用于低等植物进行PCR 以验证该方法的可行性。在用研磨仪破碎三角褐指藻粗提取基因组DNA 后,我们选取2 个目的基因片段(Δ5-fatty acid elongase 基因长936 bp,acetyl-CoA acyltransferase 基因长1374 bp)对粗提的基因组进行PCR 实验,结果2 个目的基因片段均能从快速提取的三角褐指藻基因组中扩增出来(图4)。
2.3.3 在酿酒酵母中的验证 我们将该方法进一步应用到酵母中。选取酿酒酵母Y1H 作为实验对象,用研磨仪破碎细胞粗提基因组后,同样选取2 个目的片段(CYC1 基因长约300 bp,GPD1 基因加上下游共1577 bp)对粗提的基因组进行PCR,以验证该方法在酵母中的可行性,结果见图5,选取的2 个目的基因均能从粗提的基因组中扩增出目的片段。
2.4 用快速提取的基因组扩增较大的目的片段
基于快速提取的基因组在多个物种中实现目的基因扩增后,我们尝试用该方法提取的基因组进行较大片段的扩增。选取茂源链霉菌中SSTI 基因上下游共4023 bp 的一段序列作为扩增的目的基因,结果见图6,快速提取的基因组虽然被打碎,但对于较大片段的扩增仍是可行的。
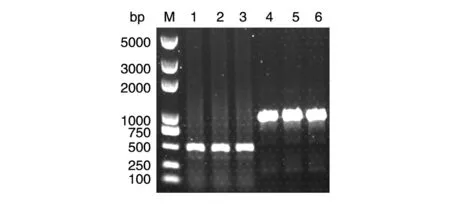
图3 茂源链霉菌基因组快速提取PCR 验证结果
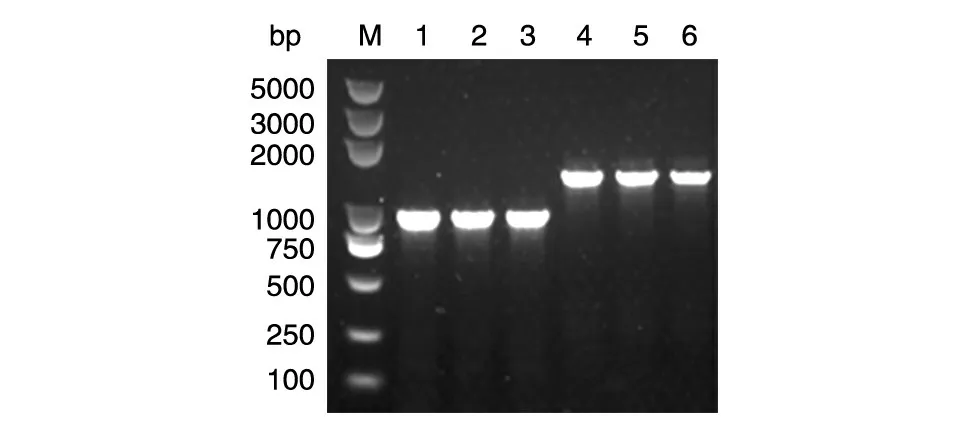
图4 三角褐指藻基因组快速提取PCR 验证结果
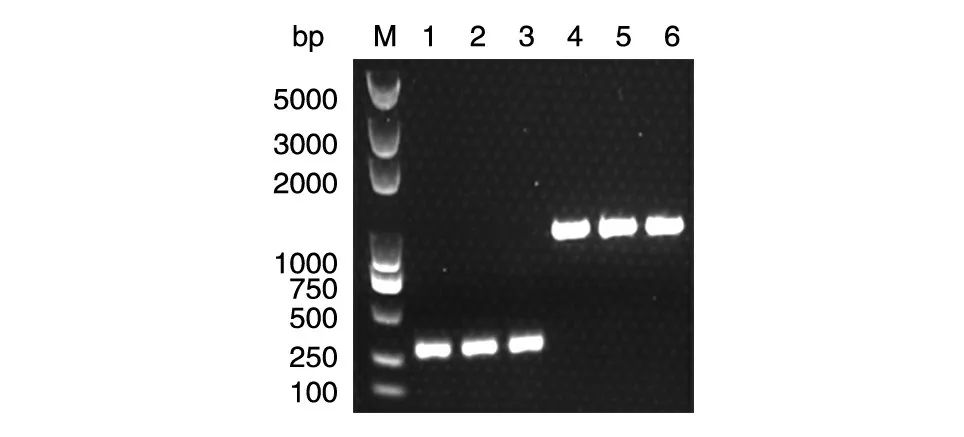
图5 酿酒酵母Y1H 基因组快速提取PCR 验证结果
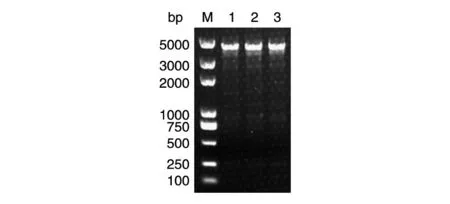
图6 茂源链霉菌中较大目的基因片段PCR 验证结果
3 讨论
在分子生物学研究领域,提取样本DNA 是实验的首要任务,目前已有很多成熟的方法[10-11]。DNA 提取的难点又在于怎样更有效率地破除细胞壁,释放里面的DNA,比较常用的方法有液氮研磨、酶解法、反复冻融、沸水浴、玻璃珠研磨、各种成品试剂等,但这些方法均须花费大量的时间、人力和物力,而且很难适用于多个不同样品的一次性提取。在本实验中,我们大胆尝试将机械研磨应用于DNA 提取,对于仅用于PCR 的DNA提取,利用研磨仪可以同时提取64 个样品,研磨时间2 min,加上水浴5 min、离心3 min,整个实验流程下来只需10 min,即可轻松得到PCR 模板,而且实验过程中无需使用有机溶剂,大大提高了DNA 的提取效率,同时也节约了大量时间,不使用有机溶剂更加环保健康,符合发展理念。对于需要测序的DNA 样本,采用研磨仪液氮研磨,可在2 min 内磨好4 个样品,相比于手工液氮研磨,不仅节约了时间,提高了实验效率,而且研磨更加充分,同时也减少了因在研钵里研磨而造成的样品损耗。在茂源链霉菌SSTI 基因敲除过程中,培养皿上长出无数转化子,需要验证目的基因是否被敲除以及敲除效率有多少。由于茂源链霉菌细胞壁较厚且结构紧密,沸水浴、碱裂解、反复冻融均无法达到快速提取基因组DNA 进行PCR 的目的,面对几百个转化子,如果用传统的手工液氮研磨,再加上PCR 验证,至少需要花费1 个月的时间,但采用研磨仪快速提取基因组进行PCR,仅在1 周内就完成了这个巨大的任务。
目前快速PCR 应用于山药、人参等鉴别真伪时[12-13],仍采用传统方法提取总基因组后建立快速PCR,需要花费大量时间,与本实验方法相比仍是繁琐的,且针对单一物种,未在其他物种中验证。王学仁等[14]建立的改进的DNA 提取方法,虽然可用于植物和真菌的DNA 提取,但仍只是在传统方法上进行改进,所花费的时间精力相比于本实验方法仍较多。陈吉良等[15]建立的高效快速提取病原真菌DNA 用于PCR 的方法,相对于传统方法确实简便很多,但还是需要手工液氮研磨,相比较本实验方法的机械研磨无需手工、无需液氮,仍显繁琐。柴海云等[16]用自己配制的DNA 快速提取液可以直接裂解真菌,可用其作为PCR 模板,但有些细胞壁较厚的真菌无法用该方法提取出DNA,而本实验采用研磨仪破碎细胞则不存在类似问题,只要研磨频率够高,再厚的细胞都可以破碎。孙立夫等[17]采用手电钻在冰上研磨细胞,已达到破碎细胞快速提取DNA 的目的,但相比于本实验中采用研磨仪研磨仍是效率低,不安全的。Lõoke 等[18]也在酵母中建立了快速提取基因组DNA 用于PCR 的方法,方法足够简便,利用醋酸锂和SDS 进行裂解细胞,水浴离心,无水乙醇抽提,但该方法仅在酵母中使用,很难适用于细胞壁较厚的非常规物种。
我们用研磨仪对茂源链霉菌进行研磨破碎,不仅建立了快速提取DNA 用于PCR 的方法,同时也建立了快速提取完整基因组DNA 的方法。以研磨仪快速提取的基因组DNA 为模板在茂源链霉菌中扩增目的基因取得成功后,又将该方法应用于三角褐指藻和酿酒酵母,并对同一物种中的2 个目的片段进行扩增,均取得成功。最后,利用快速提取的茂源链霉菌基因组DNA 对4023 bp 的大片段目的基因进行扩增,也成功扩增出目的条带,这充分证明了利用研磨仪研磨提取DNA 进行PCR 的可行性。由于是机械研磨,所以不必考虑细胞壁的组成、厚度等问题,只要频率够高,足以磨碎所有的细胞,因此该方法可以推广到更多的物种,为快速PCR 和提取完整基因组等试验节约大量的人力物力。
