以肠道功能保护与恢复为核心的癌性肠梗阻多学科综合治疗决策
2019-12-25江波
江 波
(首都医科大学附属北京世纪坛医院,s 北京, 100038)
癌性肠梗阻(MBO)多继发于结直肠癌(25%~40%)、卵巢癌(16%~29%)、胃癌(6%~19%)等恶性肿瘤[1], 少数患者继发于乳腺浸润型导管癌等非原发于腹腔的肿瘤[2], 也是肿瘤患者营养不良、恶液质、易位感染、水电解质平衡紊乱、肺动脉栓塞等直接死亡原因的关键病理生理过程之一。癌性肠梗阻患者多已进行过多线化疗、一次甚至多次的手术治疗和放射治疗,治疗极为棘手。患者一般状况较差,可以获得外科手术的机会较少。研究[3]表明,癌性肠梗阻外科治疗的围术期死亡率高达21%。综合使用肿瘤内科的各种医疗手段进行有效干预,多学科协作,患者的生活质量远高于手术治疗。
1 癌性肠梗阻的病理生理过程
传统的肠梗阻多以机械性肠梗阻、绞窄性肠梗阻、麻痹性肠梗阻等进行分类,此类分类方法是基于肠梗阻发生的病理生理过程:因肠道本身病变或者外压导致的肠道狭窄,导致肠内容物通过困难,在梗阻上方堆积、发酵并分泌大量炎症介质、细菌毒素和积气,导致肠内压升高,肠道蠕动功能下降,肠壁静脉回流障碍,肠壁水肿进一步加重肠道梗阻,见图1。如果及时诊治并处理得当,肠壁水肿是一个可逆的过程。通过综合措施减轻梗阻上方的肠内压是阻断这一病理生理过程的首选策略。随着肠内压的逐步恢复,肠壁血运趋于正常,肠壁水肿得到改善,多数癌性肠梗阻患者可以有限度地恢复肠道通畅。
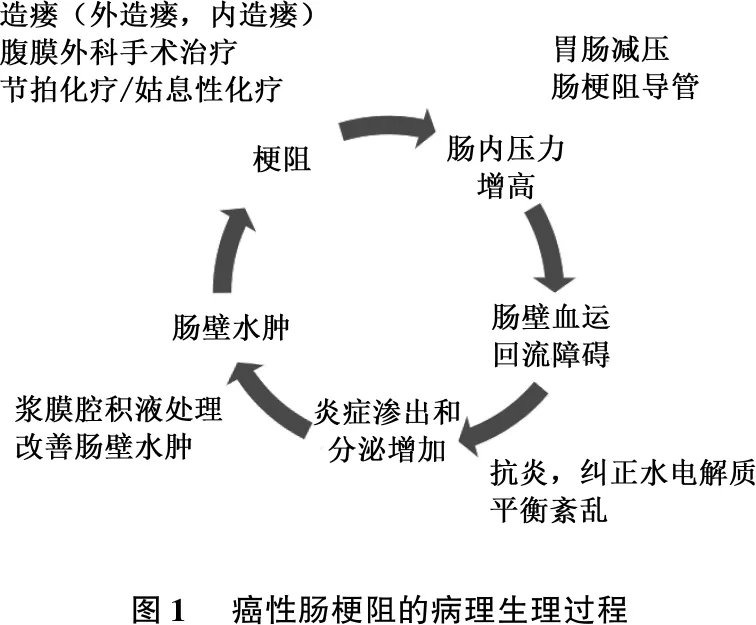
图1 癌性肠梗阻的病理生理过程
2 建立以保护和恢复肠道功能为核心思想的癌性肠梗阻综合治疗策略
营养学是以膳食为基础的,膳食是最普遍、最重要的营养素获得方式。即使患者因为疾病状态不能从膳食中获得足够的营养素,也应该优先使用添加肠内营养制剂,而非肠外营养。成人只要有100 cm功能良好的小肠,即可通过膳食或者膳食配伍肠内营养制剂满足生命所需,意味着在癌性肠梗阻的诊治过程中,各专科的临床医生应该尽一切手段为患者保存或者恢复100 cm的功能良好的小肠,从而使患者逐步摆脱肠外营养治疗,最大限度地提高生活质量。
3 癌性肠梗阻分型的再认识
癌性肠梗阻的分型多沿袭传统,或者良性疾病的分型方式,并未充分显示癌性肠梗阻的基本特征。考虑到100 cm肠道的重要性和癌性肠梗阻的基本特征,可以考虑在传统的低位肠梗阻和高位肠梗阻的基础上增加2个分型,即极高位肠梗阻与多节段混合型肠梗阻。
3.1 极高位肠梗阻
极高位肠梗阻即梗阻部位位置极高,所能够残留的正常小肠小于100 cm。此类患者造瘘后即形成类似短肠综合征的改变,不能够通过肠内营养的方式获得充分的营养素,需要终身使用补充性肠外营养治疗。如果进行外科干预时,需要充分评估是否有可能利用好梗阻远端的肠道,进行梗阻的远端和近端肠道的侧侧吻合,而将肿瘤进行旷置。
高位肠梗阻和低位肠梗阻即梗阻部位近端小肠大于100 cm, 在肠梗阻治疗缓解后,患者可以通过流食、低渣饮食等方式获取生命所需的营养素而不再次发生梗阻,可以拔除胃肠减压管或者肠梗阻导管,也可以在梗阻部位的近端直接外科造瘘。
3.2 多节段混合型肠梗阻
癌性肠梗阻多继发于消化道肿瘤和妇科肿瘤, 50%女性肠梗阻患者继发于妇科肿瘤[4]。术后的粘连性肠梗阻也是癌性肠梗阻的原因之一,这些病理类型均表现为腹腔内的广泛播散,或者肠壁的多节段转移,肠道的多节段梗阻。临床实践中多节段混合型肠梗阻最为常见。
多个节段的肠梗阻给临床治疗带来了更多的困难,其最近端的梗阻部位与治疗决策密切相关,如最近端梗阻部位能够保留100 cm的有效肠道,可考虑在一般状况好转后请外科会诊直接进行造瘘,如果不能够保留100 cm的有效肠道,则需要考虑进行多次的侧侧吻合以恢复肠道功能,或者干脆使用部分肠内联合补充性肠外营养的方式进行营养供给。
3.3 癌性肠梗阻的IEPS分型
既往的肠梗阻分型包括机械性肠梗阻、绞窄性肠梗阻和麻痹型肠梗阻等,但是从肠道功能恢复的角度而言,正确评估肠黏膜屏障和肠道黏膜侵犯的程度具有较高的临床意义。妇科肿瘤、腹膜肿瘤等非消化道肿瘤,多以腹膜侵犯、腹腔转移为机械性肠梗阻的发生机制[5], 粘连性肠梗阻发生的机制也与消化道肿瘤引起的肠梗阻的发生机制有较大差异,表现为粘连带对肠道的压迫,或者肠管之间、肠管和网膜的粘连导致的蠕动和通过能力的下降,对肠道本身的消化和吸收功能的影响并不明显。而消化道肿瘤,如胃癌、结肠直肠癌、小肠癌的发生,多表现为肿瘤向肠壁或者肠腔的增生和直接侵犯导致肠道梗阻,其对肠道消耗吸收功能的影响大于妇科肿瘤和腹膜肿瘤。
因此,有必要将这2种不同机制导致的机械性肠梗阻进行区分,内生型机械性肠梗阻(Ⅰ型)和外压型机械性肠梗阻(Ⅱ型)。通过综合治疗,外压型的肠梗阻患者更容易重建和恢复肠道功能,愈后也相对较好。
麻痹型肠梗阻(Ⅲ型)并无明确的梗阻因素,大量的癌性腹水,水电解质尤其是钙离子等的紊乱,肠道运动神经丛的破坏,均可能是其发生的原因。对于癌性腹水的治疗,肿瘤内科已有较为成熟的且有效率高达60%以上的浆膜腔积液的治疗策略,抗新生血管生成药物和顺铂等化疗药物的联合使用,对浆膜腔积液可进行很好的控制[6]。
绞窄性肠梗阻(Ⅳ型):与良性疾病导致的绞窄性肠梗阻不同,肿瘤导致的肠道血液循环系统的阻塞往往是一个缓慢进展的过程,肿瘤高负荷状态下,患者凝血功能异常,局部血栓形成并逐步衍生。肿瘤对门脉系统等血管的直接侵犯也是绞窄性肠梗阻的原因之一。全身使用抗凝药物是否可以让患者获益,尚有待研究。 癌性肠梗阻IEPS分型见图2。

图2 癌性肠梗阻IEPS分型
4 癌性肠梗阻MBO多学科综合治疗策略
4.1 充分引流,减轻肠道内压
减轻肠道内压是阻断肠梗阻病理生理过程的重要措施。极高位的肠梗阻可以通过胃管或者空肠管的负压吸引来获得胃肠减压[7], 改善肠壁的血运状况,为减轻肠壁水肿、恢复一定程度肠道功能奠定基础。
如果肠梗阻的部位较远,胃管引流形成的负压不能很好地传递到梗阻部位的近端,造成治疗无效,而利用肠梗阻导管,因为其远端的水囊的配重,将肠梗阻导管逐步漂浮于梗阻部位上端,从而实现梗阻部位的有效减压。需要注意的是: 肠内容物的引出需充分重视患者的水电解质和酸碱平衡,易出现代谢性酸中毒/碱中毒,低钠、低钾血症等,持续生长抑素的泵入可以一定程度抑制消化液的分泌,减少肠内容物的形成,降低水电解质、酸碱平衡紊乱的概率。
4.2 重视肠功能屏障的修复和肠道菌群稳态的维系
肠道黏膜具有物理屏障(肠黏膜上皮细胞、细胞间紧密连接等)、化学屏障(肠黏膜上皮分泌的黏液、消化液及肠腔内正常寄生菌产生的抑菌物质等)、生物学屏障(稳态的肠道微生态系统与菌膜等)和免疫屏障(肠黏膜淋巴组织、肠集和淋巴小结和肠道内浆细胞分泌型抗体等构成)4大屏障功能。
肠黏膜上皮营养的主要来源并不是血液供应,而是自身从肠内容直接吸收,禁食、化疗、梗阻上方的炎症过程、细菌毒素、肠道微生态的破坏等诸多因素均直接影响肠道的屏障功能,表现为肠壁通透性增加、循环D- 乳酸和二胺氧化酶水平的升高、循环中菌群DNA的可检出等。
以保护和恢复肠道功能为癌性肠梗阻综合治疗的核心思想需要重视肠屏障功能的保护和修复,及早给予肠内营养,适当给予谷氨酰胺[8]、精氨酸[9]以保持肠黏膜柱状上皮的厚度。
4.3 癌性肠梗阻的营养治疗策略
癌性肠梗阻的营养治疗是癌性肠梗阻治疗的最关键环节,通过恰当的营养治疗稳定患者内环境,改善和恢复肠道吸收功能,改善一般状况。肿瘤营养治疗的基本原则是优先选用肠内营养,而肠梗阻是肠内营养的禁忌证,基于肠道功能恢复的核心思想,癌性肠梗阻肠内营养治疗的时机可以选择经过胃肠减压和抑制肠道消化液分泌、减轻肠壁水肿、患者主观症状得到显著缓解后,尽早开始肠内营养的治疗。从无渣肠内营养制剂少量开始添加。处理得当后,患者可以居家进行肠内营养或居家的补充性肠外营养治疗(HPN)[10]。
癌性肠梗阻的营养治疗可以归纳为“三从四得”,治疗过程包括“三从”: ① 肠内营养从少量到多量,逐步过渡到全肠内营养; ② 从水解蛋白制剂过渡到整蛋白制剂; ③ 从无渣肠内营养制剂逐步过渡到常规的肠内营养制剂。
治疗目的“四得”包括: ① 肠道功能得到一定程度恢复; ② 水电解质、酸碱平衡紊乱得到纠正; ③ 一般状况得到明显好转; ④ 获得再次姑息性手术或者造瘘的机会,从而提高生活质量。
4.4 癌性肠梗阻的手术治疗策略选择
癌性肠梗阻可以选择的方式包括根治性切除、姑息性手术、肠短路手术和造瘘4种手术方式,而根治性手术多见于肿瘤以肠梗阻为主要表现进行初次手术时选择,而对于一般状况较差,反复多次手术、伴有多处转移的患者生存获益并不明显。Shariat等[11]研究了313例接受手术治疗的MBO患者,其中249例(79.5%)为肿瘤腹腔转移导致肠梗阻, 总生存期(OS)平均为6.4个月,其中切除手术为7.2个月,造口术为3.4个月,肠捷径手术为2.7个月, 37%切除手术患者术后发生不同程度的并发症。对于癌性肠梗阻,手术治疗能否给患者带来生存获益,尚需研究讨论。
手术治疗适用于一般状况良好、肿瘤生长缓慢、预期生存期大于60 d的患者; 而肿瘤广泛转移的患者,手术治疗30 d内死亡率21%~40%, 严重并发症发生率20%~40%[12], 还有较高的再梗阻发生率。对于美国东部肿瘤协作组(ECOG performance status)>2分、肾功能较差、重度营养不良的患者,围术期死亡率和再入院率显著提高。这项研究提示,有效的内科和营养治疗是进行手术的有效保证。
因此,癌性肠梗阻的中国专家共识指出: 癌性肠梗阻治疗需要内科、外科等多学科协作制定个体化治疗方案,以综合治疗为主,手术不适于所有MBO患者[13], MBO的药物姑息治疗可有效改善症状。NCCN指南也明确指出: MBO干预的目的是减少恶心、呕吐,恢复进食,减轻疼痛,可以出院回家,而手术非首选。
4.5 癌性肠梗阻的内科治疗
一项基于4 576名MBO患者的研究[14]表明: 内科治疗的在院死亡率、严重并发症的发生率远低于外科治疗,同时患者离院居家治疗的时间也远高于外科治疗,而二者的总生存并无显著差别,提示MBO的内科治疗尽管OS没有较外科治疗表现出优势,但是在生存质量以及和家人的团聚时间要远优于外科治疗。
癌性肠梗阻患者往往经历过多线化疗,并且一般状况并不支持强烈化疗,在充分评估患者身体状况和有效的营养治疗的前提下,选择未曾使用过的化疗药物,以周方案或者小剂量节拍化疗[15]的方式进行,目的为延缓肿瘤的生长,而非根治。具体药物的选择只能根据患者的肿瘤种类、既往的用药史和可能有效的药物进行个性化选择。呕吐、腹痛、乏力、失眠等可使用5- HT3抑制剂、抗胆碱能药物,哌甲酯,地西泮等药物治疗。
奥曲肽是肠梗阻研究较多的药物,一项双盲安慰剂对照的临床研究提示奥曲肽的使用并不能减少患者72 h内的呕吐的发生。一项研究[16]表明,奥曲肽和地塞米松,胃复安的联合应用可以使患者恶心和腹痛得到缓解。
肠道支架也是癌性肠梗阻可以选择的内科治疗手段之一[17]。综合以上,作者得出MBO多学科综合治疗流程示意图,见图3。
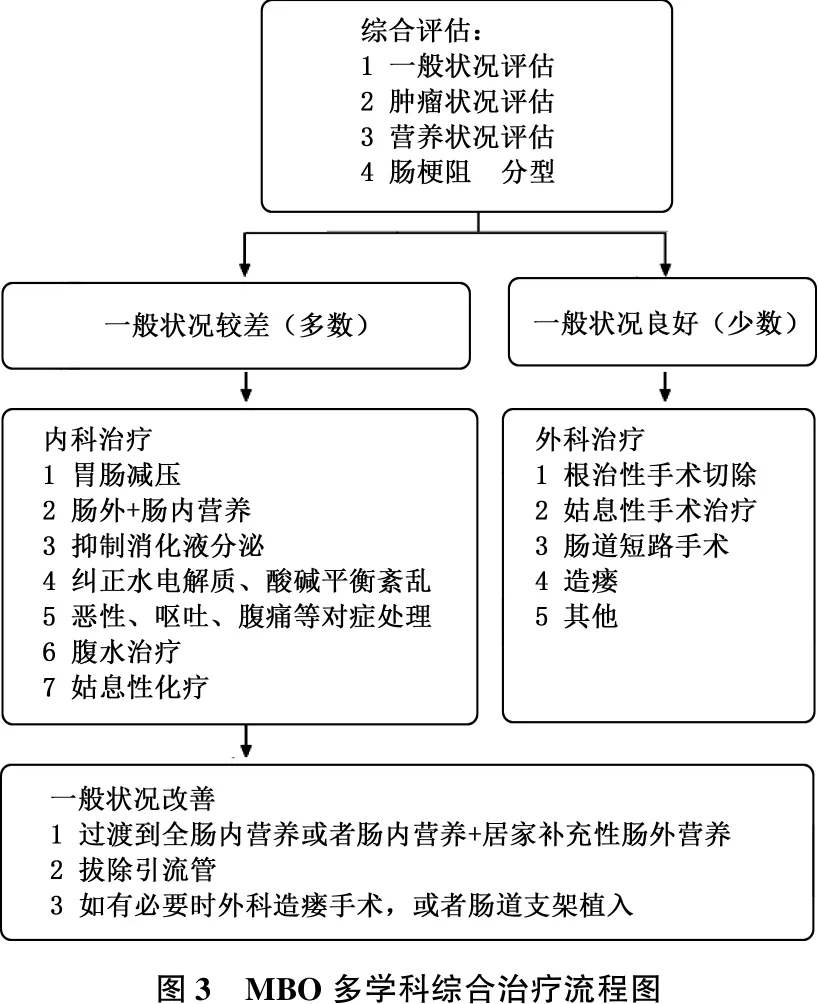
图3 MBO多学科综合治疗流程图
分析上述病理生理过程可以得知,保护和恢复肠道功能是癌性肠梗阻治疗的核心思想,具体手段包括: 降低肠内压力,纠正水电解质平衡紊乱,减少消化液分泌和减轻炎症过程,积极处理腹腔积液,必要时加以持续的低强度的抗肿瘤治疗和外科造瘘;较少情况下,在外科医生充分评估后方可进行根治性手术或减瘤手术。
