金属硫蛋白1M在非小细胞肺癌中的表达及其与患者预后的关系
2019-12-23徐振雷张正卫
徐振雷,张正卫
肺癌是恶性程度很高的肿瘤,非小细胞肺癌(non-small cell lung cancer,NSCLC)约占肺癌的80%,由于早期症状不明显,约75%的NSCLC患者被确诊时有局部转移或远处转移[1-4],预后不容乐观,因此寻找新的诊断和治疗标志物迫在眉睫。
金属硫蛋白(metallothionein,MT)是一类相对分子量低(6 000~7 000 Da)、富含半胱氨酸的金属结合蛋白,之前有研究报道其与细胞的金属的代谢有关,并且可以保护细胞免受亲电性致癌物的攻击[5]。越来越多的研究报道MT家族在包括肿瘤在内的病理过程中起到重要调节作用,MT被许多研究团队证明在肝癌中低表达[6],金属硫蛋白1M(metallothio-nein 1M,MT1M)属于MT家族的一员,有报道MT1M抑制了肝癌的发生发展[7-9],MT1M启动子甲基化是乳腺癌和肝癌的生物标志物[10-11],提示MT1M与肿瘤的发生发展密切相关。但是MT1M在NSCLC中的表达及生物学效应尚不完全清楚,本研究采用免疫组织化学方法检测MT1M在NSCLC组织中的表达并分析其与患者临床病理参数及预后之间的关系,并且在体外细胞功能层面研究MT1M与肿瘤侵袭和迁移的关系。
1 资料与方法
1.1 资料 组织芯片购于上海芯超有限公司,包含144对NSCLC组织及对应癌旁组织的组织芯片以及完整的临床病理资料,患者术前均未经放射治疗和化学治疗。
1.2 主要仪器与试剂 GTVisionTM抗兔鼠通用型免疫组织化学试剂盒购自于上海研卉生物有限公司,鼠抗人MT1M抗体、GAPDH单抗、FLAG抗体和兔抗鼠二抗购自于美国西格玛公司。人NSCLC细胞系A549、H520和H1650细胞株,过表达MT1M质粒为PCDH-Lenti-MT1M flag(lenti-MT1M),2个敲减MT1M质粒为pSIREN-RetroQ-sh-MT1M-1(shMT1M-1)和pSIREN-RetroQ-sh-MT1M-2(shMT1M-2)购自于上海中科院研究所。Transwell侵袭和迁移试剂盒购自于美国康宁公司。
1.3 免疫组织化学检测 将组织芯片放置于二甲苯中脱蜡,并在梯度乙醇中水合,在沸腾的柠檬酸盐缓冲液(10 mmol/L,pH6.0)进行抗原修复15 min,冷却至室温。为了阻断内源性过氧化物酶活性,将芯片浸入0.3%过氧化氢磷酸盐-柠檬酸盐缓冲液中10 min,然后在PBS中充分冲洗。将芯片与MT1M的一抗(1∶100稀释)一起孵育4 ℃过夜。用PBS洗涤后,使用二抗在37 ℃孵育30 min,使用PBS代替一抗作为阴性对照,使用奥林巴斯显微镜和软件成像系统捕获芯片图像。
1.4 免疫组织化学结果判定 将组织芯片在光镜下观察和评分[12],同时进行病理图像采集。MT1M主要定位在细胞质,综合低倍镜下染色强度和高倍镜下阳性细胞百分比进行半定量测定,为了减少误差,随机选取5个视野进行判读。染色强度评分标准:基本不着色0分,浅黄色1分,棕黄色2分,黄褐色3分。阳性细胞数百分比评分标准:计数400个细胞,阳性细胞百分数<10%为0分;10%~40%为1分;41%~70%为2分;>70%为3分。两者相加后若为0~2分为阴性;2~6分为阳性。结果由2名有资质的病理科医师进行判读,阴阳性判断不一致时,以第3位病理科医师的判读结果为准。
1.5 稳定表达细胞株的构建 在6孔板内加入适量细胞,使细胞密度24 h后达到50%,使用10%培养基与病毒感染液1:1混合后培养24 h,弃去原培养液,加入1∶2 000嘌呤霉素培养基,筛选出阳性细胞,细胞传代至第三代,收集细胞用免疫印迹法检测过表达和敲减效率。
1.6 Transwell实验分析细胞迁移和侵袭 调整细胞密度至5×105/mL,取200 μL细胞株各约1×105左右的细胞悬匀后铺在上层小室里,下层小室加600 μL含20%胎牛血清的培养基,孵育24 h,吸去上层小室培养液,用PBS清洗2次,用棉签小心刮除小室上方的细胞,反面的细胞用PBS清洗后,用甲醇固定30 min,0.2%的结晶紫染色20 min,PBS清洗后,在高倍镜下(×400)用光镜拍照,每个小室取5个视野,重复3次,计算3次均数。
1.7 统计学处理 采用SPSS 11.5统计软件,计量资料组间比较采用独立样本t检验、单因素方差分析,计数资料采用卡方检验,生存分析采用Kaplan-Meier法,以P<0.05为差异比较具有统计学意义。
2 结果
2.1 MT1M在NSCLC组织中的表达及其与患者临床病理参数间的关系 通过检测144对NSCLC组织及其癌旁组织中MT1M的表达,肿瘤组织中MT1M阳性率为20.14%,癌旁组织中MT1M阳性率为90.28%,肿瘤组织及其癌旁组织之间MT1M阳性表达率差异比较具有统计学意义(χ2=143.23,P<0.01)。肿瘤组织中MT1M表达低于对应癌旁组织。典型免疫组织化学结果见图1。肿瘤组织中MT1M的表达与淋巴结转移、TNM分期有关(χ2分别为18.66、12.73,P均<0.01),而与性别、年龄、肿瘤直径及分化程度无关(χ2分别为0.001、1.91、0.10、1.80,P均>0.05),见表1。
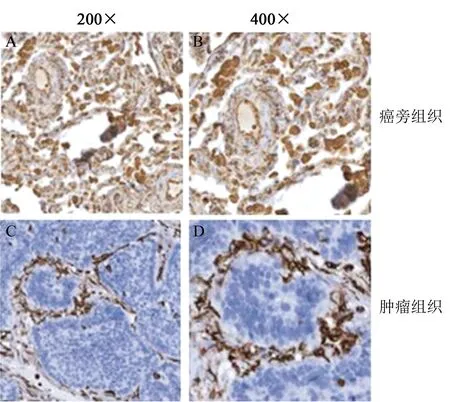
MT1M主要定位于细胞质中;A、B为癌旁组织中MT1M高表达;C、D为肿瘤组织中MT1M低表达图1 MT1M在NSCLC组织及其癌旁组织中的表达
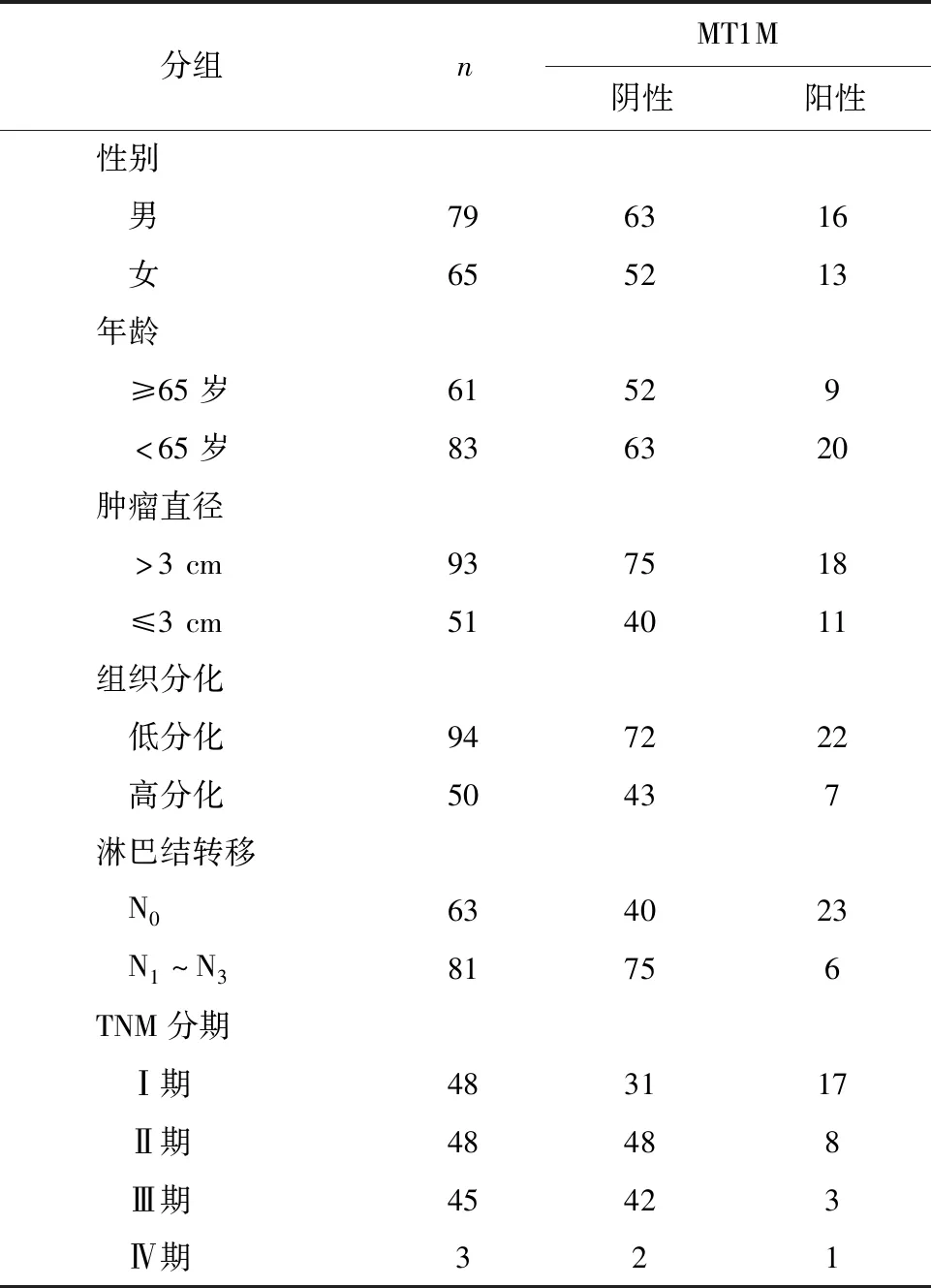
表1 MT1M表达与NSCLC患者临床病理参数之间的关系
2.2 MT1M对NSCLC细胞迁移和侵袭能力的影响 通过免疫印迹法检测NSCLC细胞系中MT1M的表达,A549细胞和H520细胞中MT1M表达较正常肺上皮细胞BEAS-2B低,而H1650细胞中MT1M表达高(F=91.21,P<0.01),图2A。选取A549细胞和H1650细胞用于细胞迁移和侵袭功能实验,在A549细胞中稳定过表达MT1M,在H1650细胞中稳定敲减MT1M,采用免疫印迹法验证不同稳转细胞株中MT1M的表达情况,结果见图2B、图2C。Transwell实验分析细胞迁移和侵袭实验结果见图3,过表达MT1M后A549迁移和侵袭能力明显降低(t分别为14.08、9.177,P均<0.001),敲减MT1M(选择敲减细胞株shMT1M-2)后H1650迁移和侵袭能力明显增强(F分别为50.46、48.09,P均<0.001)。
2.3 NSCLC组织中MT1M的表达与患者预后间的关系 生存分析结果表明,对于TNMⅠ、Ⅱ和Ⅲ期的NSCLC患者,MT1M阳性患者的总体生存期高于MT1M阴性患者(见图4A~图4C),差异比较具有统计学意义(Log-Rank检验,χ2分别为21.19、10.13、6.10,P均<0.05)。此外,多因素Cox回归分析显示,NSCLC组织中MT1M的表达是NSCLC患者预后不良的独立危险因素(P<0.001,见表2)。
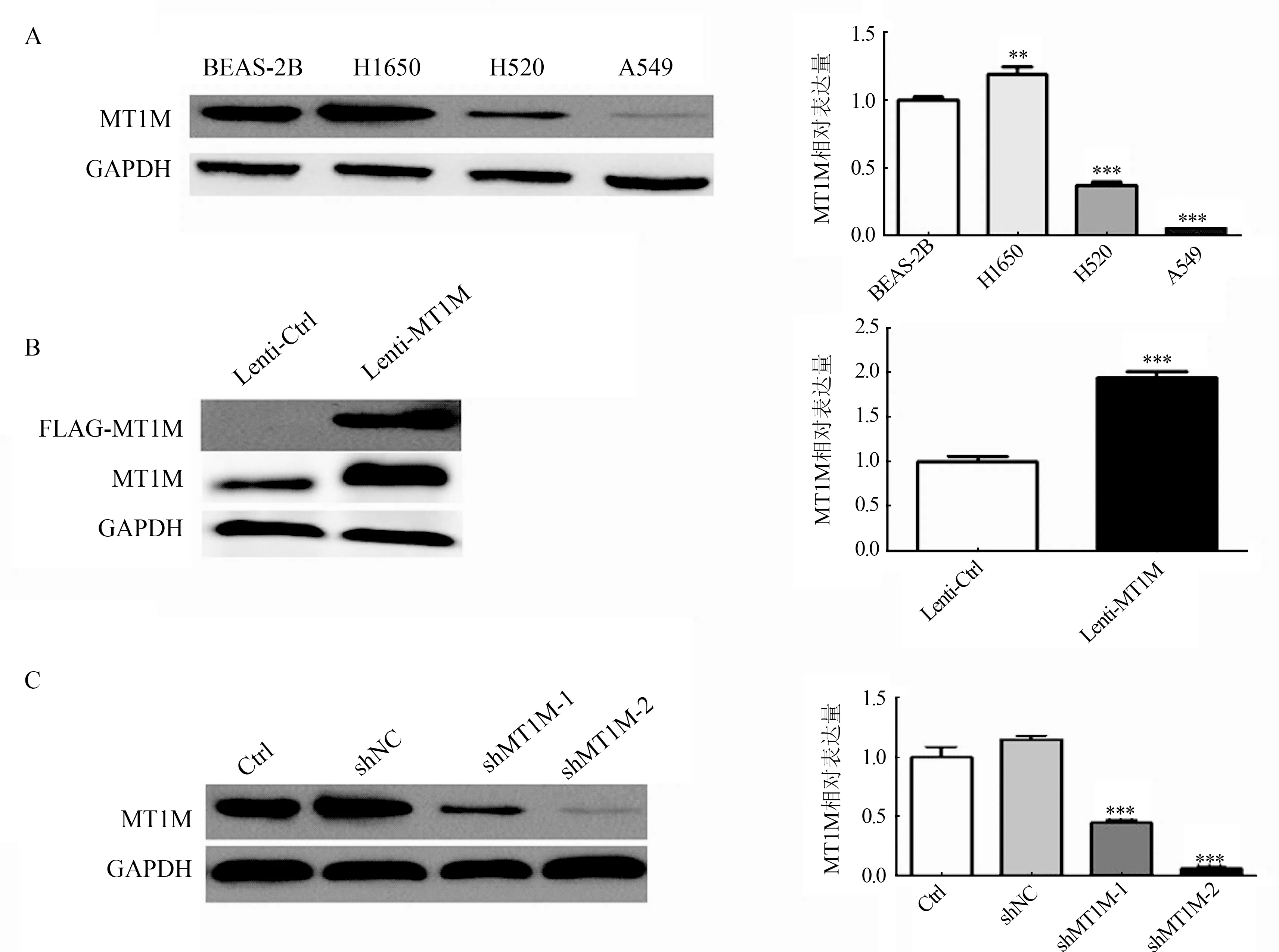
A.采用免疫印迹法检测正常上皮细胞BEAS-2B和NSCLC细胞系中MT1M的表达;B.在A549细胞中使用慢病毒(lentivirus)稳定过表达MT1M,获得过表达细胞株PCDH-Lenti-MT1M flag(Lenti-MT1M);C.在H1650中使用shRNA敲减MT1M,获得敲减细胞株pSIREN-RetroQ-sh-MT1M-1(shMT1M-1)和pSIREN-RetroQ-sh-MT1M-2(shMT1M-2),选择GAPDH作为内参,**P<0.01,***P<0.001图2 免疫印迹法检测NSCLC细胞系中MT1M表达
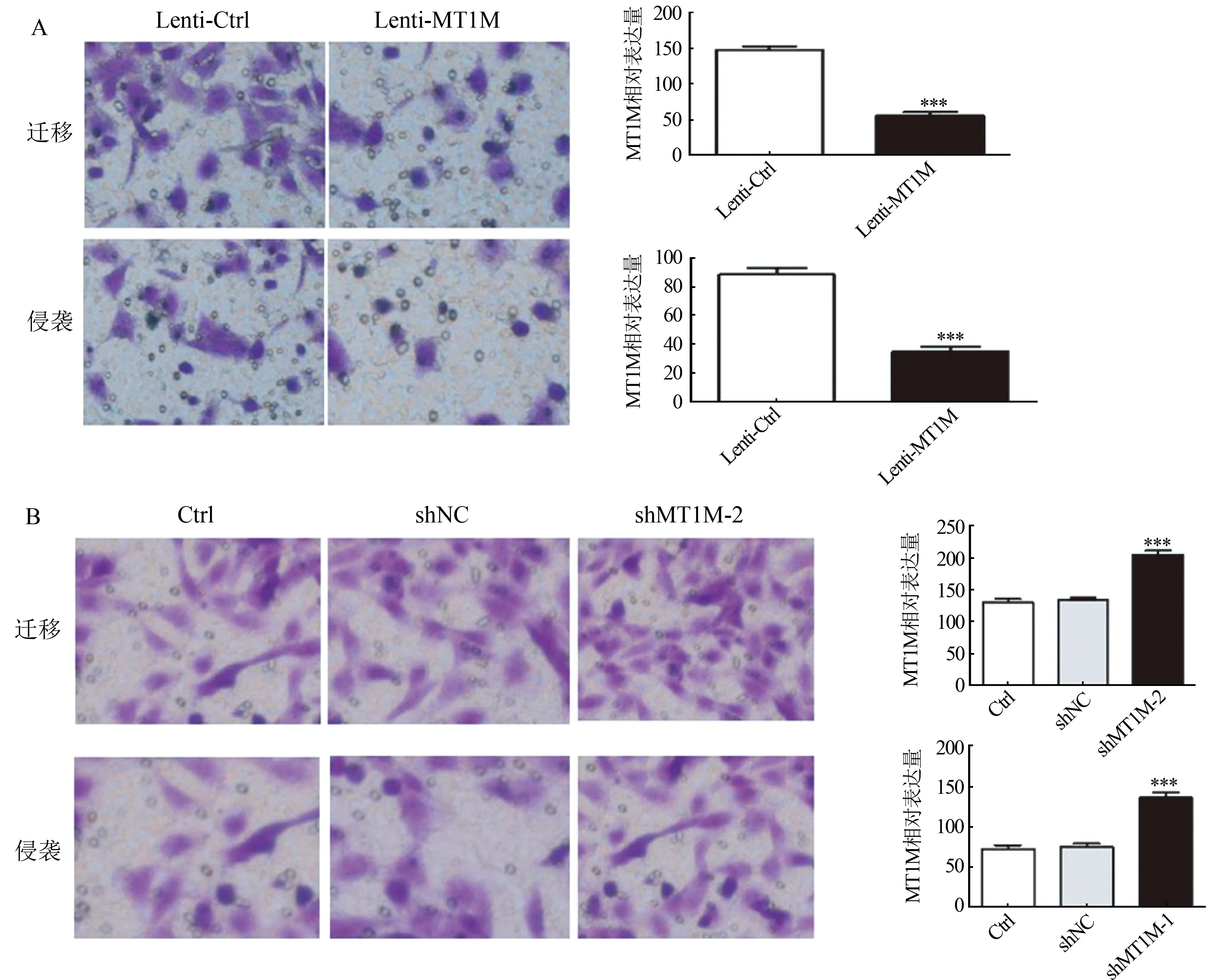
A.过表达MT1M后A549细胞迁移和侵袭能力显著降低;B.敲减MT1M后H1650细胞迁移和侵袭能力显著增强图3 Transwell实验分析NSCLC细胞株A549和H1650的迁移和侵袭
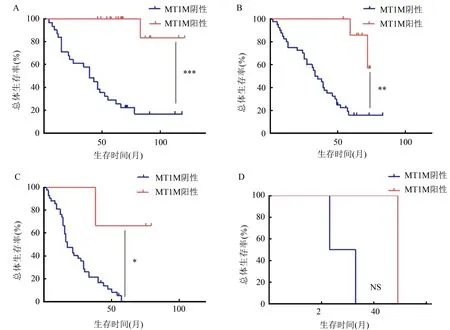
MT1M阳性与MT1M阴性NSCLC患者比较,*P<0.05,**P<0.01,***P<0.001,NS:无差异A.TNM Ⅰ期(48例);B.TNM Ⅱ期(48例);C.TNM Ⅲ期(45例);D.TNM Ⅳ期(3例)图4 NSCLC患者MT1M表达与预后关系的Kaplan-Meier生存曲线
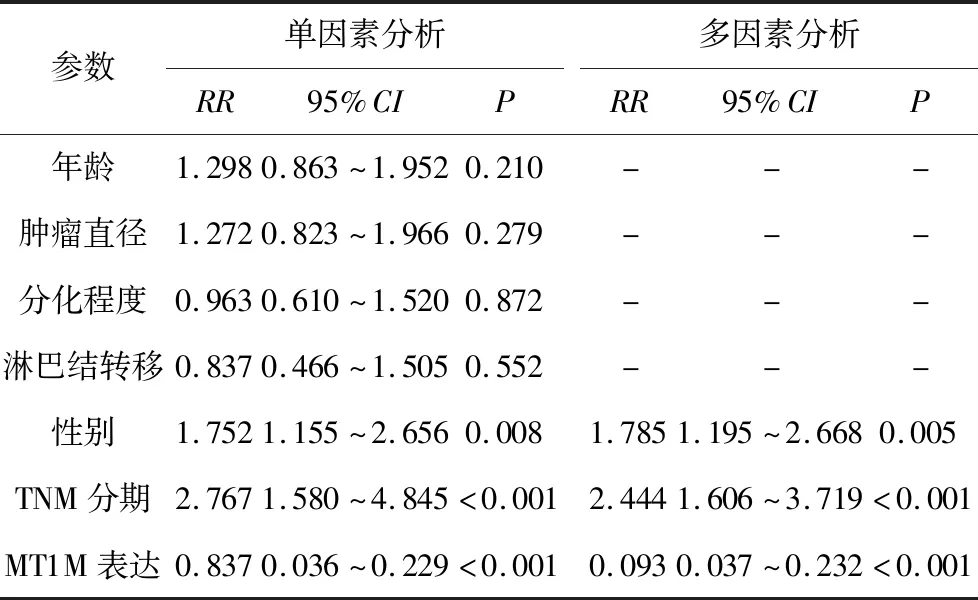
表2 NSCLC患者预后因素的单因素和多因素方差分析
3 讨论
以往有研究报道,MT1M在肝癌组织中低表达,并且可以诱导肝癌细胞凋亡,抑制肝癌细胞的增殖、侵袭和迁移[7-8,13],MT1M表达较低的肝癌患者术后复发率明显升高,预后往往不容乐观[9],同时MT1M启动子甲基化状态可以作为肝癌血清诊断的标志物[11],表明MT1M对肝癌的发生发展起到重要作用。本研究结果显示,MT1M在NSCLC组织中的表达明显低于癌旁组织,表明其低表达可能导致NSCLC组织上皮过度增殖或突变,进而形成肿瘤。
通常肿瘤细胞发生转移,首先要在原发灶侵袭基底膜,然后进入血管或淋巴结,进而发生远处转移,是否发生转移对患者的预后影响十分重要[14-15]。MT1M与患者临床病理参数相关性分析发现MT1M与NSCLC淋巴结转移呈负相关,患者越趋于淋巴结转移,组织中MT1M表达越低。体外细胞功能实验显示MT1M在NSCLC中可能具有抑制癌细胞迁移的功能。此外,生存分析结果显示,对于TNMⅠ、Ⅱ和Ⅲ期的NSCLC患者,MT1M阴性的NSCLC患者总体生存期较MT1M阳性患者明显缩短,多因素方差分析显示NSCLC组织中MT1M的低表达是患者总体生存率的独立危险因素,提示MT1M在NSCLC中可以作为预后标志物,其低表达提示NSCLC患者预后不良。
本研究初步探讨了MT1M可能具有抑制NSCLC细胞侵袭转移的功能,其表达也可作为NSCLC患者潜在的预后标志物,但具体作用机制还需要进一步研究。
