VE-cad-Fc功能化透明质酸水凝胶的制备与表征
2019-12-21谢敬辉刘开政
杨 军,谢敬辉,高 超,刘开政
VE-cad-Fc功能化透明质酸水凝胶的制备与表征
杨 军1, 2,谢敬辉1, 2,高 超1, 2,刘开政1, 2
(1. 南开大学生命科学学院,天津 300071;2. 南开大学生物活性材料教育部重点实验室,天津 300071)
为了提高透明质酸水凝胶的生物学功能,本研究利用两步迈克尔加成反应及点击化学反应制备了人血管内皮钙黏素融合蛋白(VE-cad-Fc)功能化的透明质酸水凝胶,并进一步研究了其对人脐带间充质干细胞(hUC-MSCs)的影响.核磁共振光谱检测及凝胶时间检测显示,透明质酸主链丙烯酰肼取代率为16%,,融合蛋白功能化透明质酸以DTT交联的凝胶化时间约为30,min.ELISA检测显示水凝胶中化学键合Fc结构域特异性结合多肽可以显著提高融合蛋白的长期负载稳定性.2D/3D细胞黏附、增殖与活细胞染色实验结果显示,水凝胶中利用Fc结构域固定融合蛋白显著改善人脐带间充质干细胞的黏附、增殖,且促进水凝胶中hUC-MSCs的长期克隆化生长.作为一种细胞培养基质(2D/3D培养),这种融合蛋白功能化的水凝胶材料在组织工程、再生医学等领域将有非常广阔的应用前景.
水凝胶;透明质酸;人脐带间充质干细胞;细胞黏附;细胞增殖
透明质酸(HA)是一种广泛分布于多种组织细胞外基质中的糖胺聚糖,具有较好的生物相容性,对组织器官生长发育、疾病发生以及损伤修复均发挥重要作用[1-2].因此,基于透明质酸的水凝胶已经在组织工程支架、细胞三维培养以及再生医学研究中被广泛应用.透明质酸能够通过与多种细胞表面受体如CD44和RHAMM等结合,支持细胞的黏附、增殖与分化,但由于透明质酸水凝胶本身缺乏整合素受体以及分化调控因子的活性,所以为了促进其在干细胞的分化研究中应用,很多研究者对透明质酸水凝胶进行了进一步的功能化修饰[3].Hanjaya-Putra等[4]通过在透明质酸侧链上化学键合整合素功能多肽(RGD)促进干细胞的黏附与增殖.Cosgrove等[5]、Zhu等[6]和Jcm等[7]通过透明质酸水凝胶中固定神经钙黏素功能性短肽,为干细胞创建了一种利于其向软骨和神经分化的微环境,成功实现了干细胞的分化命运调控.
血管内皮细胞钙黏素(VE-cadherin)是一种分布于血管内皮细胞中用于细胞间连接的跨膜蛋白,其在细胞间相互作用以及血管的发生发育和管型形成中发挥着至关重要的作用[8].研究表明,在斑马鱼胚胎中对VE-cadherin进行基因敲除处理,最终会严重影响胚胎的管型构建并引起官腔的塌陷[9].此外,VE-cadherin的胞内域还可以与细胞骨架相互作用激活p-FAK、AKT和Bcl-2等细胞内信号通路,从而在细胞的黏附、增殖、迁移以及分化中发挥重要作用[10].人血管内皮钙黏素融合蛋白(VE-cad-Fc)已经作为一种胞外基质用于胚胎干细胞的培养以及内皮细胞的功能维持中,而且表现出很好的促进细胞黏附和生长的特性[11].人脐带间充质干细胞(hUC-MSCs)由于其来源丰富、低免疫原性和免疫调节性已经被广泛用于疾病治疗以及再生医学的的研究中[12].本研究拟制备一种VE-cad-Fc功能化修饰的透明质酸水凝胶材料,研究VE-cad-Fc功能化修饰透明质酸水凝胶对hUC-MSCs黏附与增殖的影响,旨在为后续hUC-MSCs在该融合蛋白修饰水凝胶中的血管分化研究以及血管组织工程中的应用奠定基础.
1 材料与方法
1.1 材料
HA(相对分子质量91000)购自山东福瑞达生物医药有限公司;己二酸二酰肼(ADH)、1-羟基苯并三唑(HOBT)、碳二亚胺(EDAC)和N-丙烯酰氧基琥珀酰亚胺(NHS-AC)购自日本Tokyo chemical industry公司;二硫苏糖醇(DTT)购自美国Solarbio公司;细胞黏附性多肽(RGD、相对分子质量634)、Fc段特异性结合多肽(Fc-binding peptide,相对分子质量943)、VE-cad-Fc(相对分子质量120000)为本实验室委托南京金斯瑞公司合成;Hepes缓冲液(1,mol/L)、三乙醇胺(TEOA)购自美国Solarbio公司;过氧化酶标记的人IgG抗体(HRP-goat anti-human IgG)购自美国Solarbio公司.
1.2 实验仪器
控温型磁力搅拌器,MS-H280-Pro型,SCILOGEX公司;pH测试仪,METTLER TOLEDO公司;冻干机,北京博医康实验仪器有限公司;核磁共振波谱仪,Mercury Vx-300型,美国瓦里安公司;倒置相差显微镜,日本奥林巴斯公司;高级正置荧光显微镜,Axio Imager Z1型,德国ZEISS公司;多功能酶标仪,美国Bio-RAD公司.
1.3 透明质酸-脂肪双酰肼衍生物(HA-ADH)的合成与鉴定
称取HA粉末0.5,g,添加适量ddH2O,充分溶解.称取9.0,g ADH 加入充分溶解,添加1,g EDAC、0.2,g HOBT 至充分溶解,反应液pH=4.75,温度 25,℃.过夜反应,反应完成后置于100,mmol/L NaCl溶液透析48,h,1/4~1/5乙醇溶液透析48,h,DIH2O透析48,h.透析完成后,样品冻干,取出5~10,mg进行1H NMR分析并计算取代度,以D2O为溶剂.
1.4 丙烯酰肼化透明质酸(HA-AC)的合成与鉴定
取适量HA-ADH样品充分溶解于Hepes缓冲液(0.05,mol/L),加入质量比HA-ADH:NHS-AC=4∶3的NHS-AC,充分混匀,反应液pH=7.20,温度25,℃.反应过夜,反应完成后置于100,mmol/L NaCl溶液中透析48,h,DIH2O中透析48,h.透析完成后,样品冻干,取出5~10,mg进行1H NMR分析并计算取代度,以D2O为溶剂.
1.5 Fc段特异性结合多肽(Fc-binding peptide)修饰透明质酸的制备

1.6 HA-AC水凝胶制备
取第1.4节方法制备的HA-AC粉末配置成质量分数5%,溶液,每100,mL添加4,mL 0.45,g/mL DTT交联剂充分混匀37,℃反应30,min成胶,制成HA-AC水凝胶.
1.7 Fc-binding peptide水凝胶的制备
取第1.5节方法中制备的Fc-binding peptide修饰透明质酸配置成质量分数5%,溶液,每100,mL添加4,mL 0.45,g/mL DTT交联剂充分混匀37,℃反应30,min成胶,制成Fc-binding peptide水凝胶.
1.8 VE-cad/Fc-binding(-)水凝胶的制备
取1.4方法制备的HA-AC粉末配置成质量分数5%,溶液,每100,mL添加2,mL 1,mg/mL VE-cad-Fc溶液,充分混匀37,℃反应30,min,后添加交联剂DTT充分混匀37,℃反应30,min成胶,制成VE-cad/Fc-binding(-)水凝胶.
1.9 VE-cad/Fc-binding(+)水凝胶的制备
配制质量分数5%, Fc-binding peptide修饰透明质酸溶液,取100,mL,添加2,mL 1,mg/mL VE-cad-Fc溶液,充分混匀37,℃反应30,min,后添加交联剂DTT充分混匀37,℃反应30,min成胶,制成VE-cad/Fc-binding(+)水凝胶.
1.10 RGD水凝胶的制备
配制质量分数5%, HA-AC溶液,每100,mL,添加6.3,mL 10,mg/mL RGD溶液,充分混匀37,℃反应30,min,后添加交联剂DTT充分混匀37,℃反应30,min成胶,制成RGD水凝胶,此水凝胶作为阳性对照,合成方法参见文献[6].
1.11 ELISA实验检测VE-cad-Fc的固定量
按照第1.8节和第1.9节方法分别制备VE-cad/Fc-binding(-)、VE-cad/Fc-binding(+)水凝胶于96孔板中,成胶后,培养基浸泡,定时更换培养基直至检测结束.分别于1,d、3,d、5,d、7,d时间点取样进行ELISA检测,以PBS冲洗5次,加入以PBS配置的5%,牛血清白蛋白(BSA)溶液,37,℃孵育1,h.PBST清洗5次后,加入过氧化酶标记的人IgG抗体,37,℃孵育1,h.PBST清洗5次,每孔加入100,mL TMB显色液,37,℃避光孵育15,min,加入终止液后,于452,nm下测定吸光度,并绘制VE-cad-Fc标准曲线.
1.12 细胞培养与黏附实验
于96孔板中按照第1.6节~第1.10节分别制备HA-AC、Fc-binding peptide、VE-cad/Fc-binding(-)、VE-cad/Fc-binding(+)、RGD水凝胶,取第3代hUC-MSCs,二维培养细胞密度5×103/孔,三维培养细胞密度为5×106mL-1水凝胶.培养24,h后,拍照取样.
1.13 MTT细胞增殖实验
分别于4,h、24,h、48,h时间点取二维培养细胞样品,吸出培养上清,PBS清洗3次,加入以新鲜培养基稀释的质量浓度为1,mg/mL的 MTT工作液(母液5,mg/mL,PBS配制).继续培养3,h后,去除上清,每孔加入100,μL DMSO,避光,摇床振荡10,min.结晶充分溶解后,吸出溶解液于450,nm下测定吸光度.
1.14 活细胞染色
取不同时间点三维培养细胞样品,吸出培养上清,PBS清洗两遍,加入稀释好的Calcein AM活细胞染色液,避光染色20,min,PBS清洗5次,置于高级荧光正置显微镜下观察拍照.
1.15 实验数据统计与分析
实验数据以平均值±标准差(SD)表示(=5).实验数据用GraphPad Prism 5软件统计分析.<0.05 表示差别有统计学意义.
2 实验结果与讨论
2.1 丙烯酰肼化透明质酸的合成与鉴定
透明质酸含有大量的羧基、羟基、N-乙酰氨基和还原末端等活性反应侧基.本研究首先选用HA的羧基侧基经过两步迈克尔加成反应,制备了丙烯酰肼化透明质酸(HA-AC).反应过程如图1所示.
对比HA和HA-ADH的1H核磁共振检测结果(见图2(a)、图2(b)),图2(b)中化学位移2.3(a)和1.6(b)处的特征吸收峰表明:通过第一步迈克尔加成反应成功合成了HA-脂肪双酰肼衍生物HA-ADH.通过MestReNova 软件计算取代度得出HA羧酸侧基的取代度约为58%,该反应效率与文献[13-14]报道相近.
进一步比较HA-ADH和HA-AC的1H核磁共振检测结果(见图2(b)、图2(c)),图2(c)中化学位移5.8(c)和6.2(d)处吸收峰的存在表明:通过第二步迈克尔加成反应成功制备了丙烯酰肼化透明质酸(HA-AC).通过MestReNova软件计算取代度得出该反应的反应效率约为16%,与文献[15]报道相近.
2.2 VE-cad-Fc功能化透明质酸水凝胶的制备
巯基-双键点击反应是近年来发展衍生的一种具有高度选择性有机加成反应,已经成为合成新型材料的一种重要途径.该反应机理在文献[16]中已有报道,本实验Fc-binding peptide与HA-AC的反应过程如图3(a)所示.
多肽(CHWRGWV)可以与Fc结构域发生特异性结合[17],融合了人IgG的Fc段的VE-cad-Fc即可以通过与透明质酸骨架化学键合的Fc-binding peptide结合而实现透明质酸水凝胶的功能化.实验结果显示(见图3(b)),质量分数5%,的Fc-binding peptide修饰透明质酸溶液,反应温度37,℃,VE-cad-Fc质量浓度20,mg/mL,交联剂浓度1.17,mol/L,反应时间30,min即可成胶.

图1 丙烯酰肼化透明质酸的制备

如图3(c)所示,利用ELISA方法检测水凝胶中释放到培养介质中的VE-cad-Fc的量,结果显示:化学键合Fc-binding peptide修饰透明质酸水凝胶(VE-cad/Fc-binding(+))在1周后释放出的VE-cad-Fc仅为添加量的10%,左右,而纯透明质酸(VE-cad/Fc-binding(-))体系为40%,左右.因此,我们认为透明质酸主链上融合蛋白Fc结构域特异性结合位点的存在,有利于提高水凝胶内功能蛋白的长期负载稳定性.
2.3 VE-cad-Fc功能化透明质酸水凝胶对hUC-MSCs黏附与增殖的影响
利用倒置显微镜观察细胞形态以及MTT检测细胞增殖初步验证了VE-cad-Fc功能化透明质酸水凝胶对hUC-MSCs黏附与增殖的影响.RGD功能化透明质酸作为阳性对照.如图4(a)所示,相较于HA-AC、Fc-binding peptide、RGD组和VE-cad/Fc-binding (-),VE-cad/Fc-binding(+)实验组细胞的黏附得到了显著改善.MTT细胞增殖实验结果(见图4(b))显示,在经时培养的各时间点(4,h,24,h,48,h),VE-cad/Fc-binding(+)实验组的细胞增殖活性显著高于各对照组.上述结果证明,在透明质酸水凝胶中,VE-cad-Fc在水凝胶中的稳定固定是发挥其生物学活性、改善水凝胶生物功能的重要影响因素.
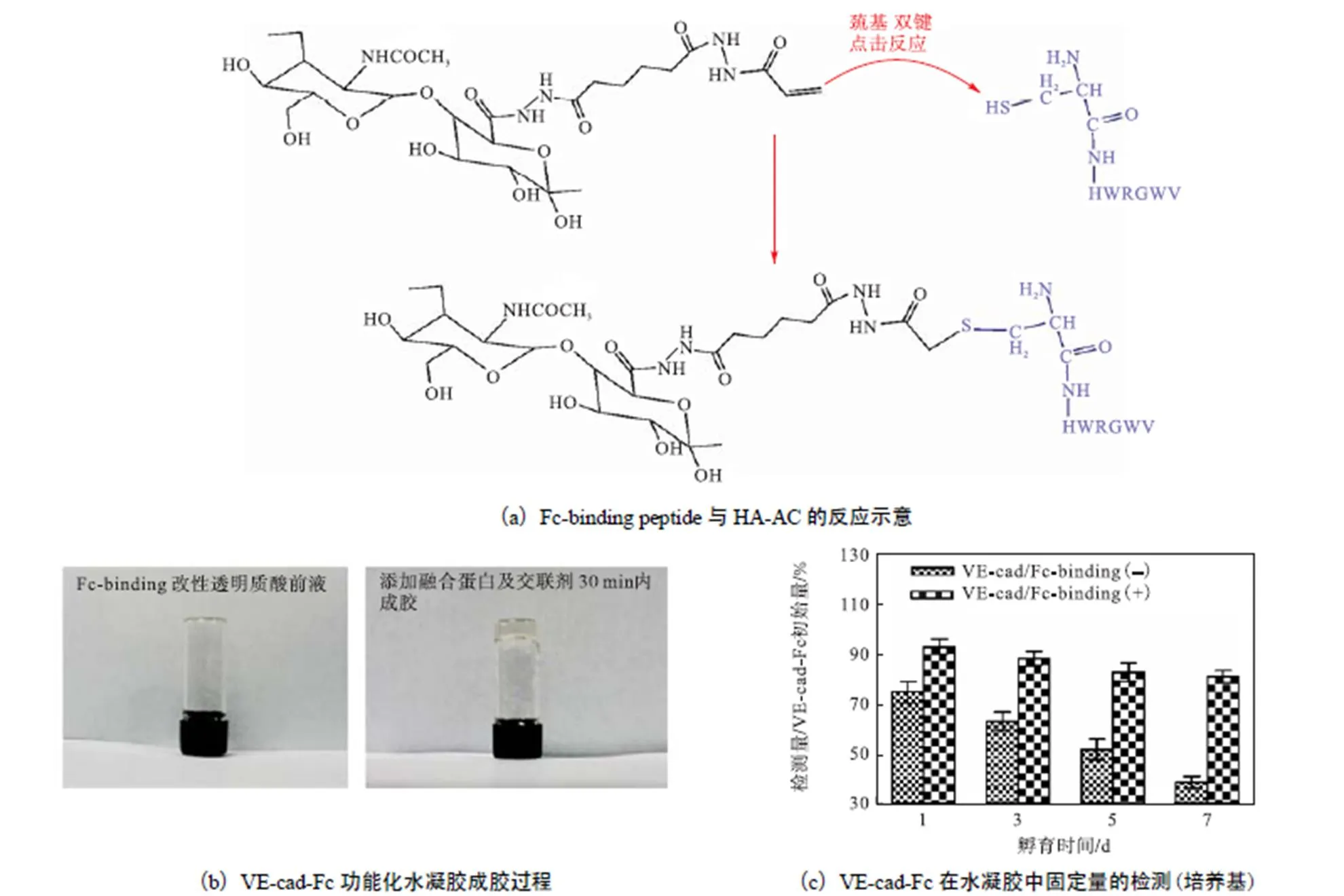
图3 VE-cad-Fc功能化透明质酸水凝胶的合成

图4 hUC-MSCs在不同因子修饰透明质酸水凝胶表面的黏附与增殖
2.4 VE-cad-Fc功能化透明质酸水凝胶用于hUC-MSCs的三维培养
利用水凝胶仿生细胞体外三维微环境,实现细胞的体外三维培养已成为近年水凝胶研究的热点.本研究初次利用VE-cad-Fc功能化透明质酸水凝胶三维培养hUC-MSCs,通过活细胞染色观察了水凝胶中细胞的分布及存活.如图5所示,在三维培养1,d、3,d、7,d后,活细胞染色显示VE-cad-Fc功能化水凝胶hUC-MSCs分布均匀、细胞呈克隆化增殖,活细胞染色结果显示细胞增殖活性与MTT细胞活性检测水凝胶表面细胞的增殖活性结果一致,即VE-cad-Fc功能化透明质酸水凝胶具有良好的细胞相容性,促进hUC-MSCs的三维生长.说明VE-cad-Fc的修饰可以维持hUC-MSCs在透明质酸水凝胶中的长期存活.
3 讨 论
透明质酸具有亲水性强、无毒、可降解及生物相容性好等优点,以其为主要原料制备的透明质酸基水凝胶常用于可控药物释放、组织修复和三维细胞培养等领域[18].但是天然透明质酸所形成的水凝胶无论是细胞黏附,还是细胞因子活性调控等均有待进一步改进[19].因此,通过透明质酸分子主、侧链化学修饰,接枝具有促进细胞特异性黏附与增殖的活性因子的研究,已成为现代透明质酸应用研发的热点.

图5 三维培养中hUCMSCs的存活
通过透明质酸侧链进行修饰(酰胺化、开环、酯化、接枝等),及其化学键合功能性活性分子,从而提升其生物学功能特性[20].VE-cad-Fc融合蛋白已经被证实对于内皮细胞的生长以及其功能发挥具有非常好的促进作用.另外,我们近期利用VE-cad-Fc作为细胞培养基质培养胚胎干细胞,成功实现了胚胎干细胞的功能维持.本研究中,我们通过两步迈克尔加成反应成功制备了丙烯酰肼化通明质酸,进一步通过点击化学实现了其化学键合Fc-binding peptide,最终成功实现了VE-cad-Fc功能化的透明质酸水凝胶的制备(见图4).
hUC-MSCs作为一种来源广泛、免疫原性低以及具有免疫调节性的功能性细胞被广泛用于临床研究.本研究VE-cad-Fc功能化后的透明质酸水凝胶相比于未经修饰的透明质酸水凝胶具有良好的间充质干细胞亲和性.水凝胶表面二维培养中,细胞的黏附是影响细胞的存活的首要因素.本研究结果表明,经VE-cad-Fc功能化后,hUC-MSCs在水凝胶表面的黏附与增殖情况得到了明显改善,这为细胞在功能化水凝胶中的长期存活提供了基础.同时,间充质干细胞在水凝胶中长期三维培养结果也表明,VE-cad-Fc功能化透明质酸水凝胶能够保持hUC-MSCs的长期 存活.
细胞黏附性多肽(RGD)通过与细胞表面的整合素特异性结合,介导细胞黏附,已被广泛用于透明质酸水凝胶的功能化研究[21-23].本研究中,对比RGD功能化透明质酸水凝胶,我们发现VE-cad-Fc功能化透明质酸水凝胶在促进细胞的黏附与增殖方面与RGD具有同样的效果(见图4(a)),而且能够维持间充质干细胞在水凝胶内呈克隆化增殖(见图5(b)).本研究结果显示:VE-cad-Fc融合蛋白在水凝胶中的键合方式对其生物学功能实现具有重要的影响作用,其具体分子机制还有待进一步研究.
已有研究表明VE-cad-Fc在血管形成和功能维持中具有作用[10].因此,我们推测,VE-cad-Fc功能化透明质酸水凝胶无论是作为一种体外功能细胞的培养基质,还是作为细胞移植载体,均将会带来细胞功能的显著提升,该功能化的水凝胶材料在组织工程、再生医学等领域也将有非常广阔的应用前景.
4 结 语
本实验通过对透明质酸侧链进行化学接枝及交联修饰,成功制备了VE-cad-Fc功能化透明质酸水凝胶.相比于未经修饰的透明质酸水凝胶,该功能化水凝胶不仅显著改善了hUC-MSCs的黏附与增殖,同时促进hUC-MSCs在水凝胶中呈克隆化增殖、生长.作为一种细胞培养基质材料,VE-cad-Fc功能化透明质酸水凝胶在后续的研究中也必将对hUC-MSCs的培养及细胞治疗研发产生重要的影响,为其在再生医学研究中的应用研发奠定基础.
[1] 崔 媛,段 潜,李艳辉. 透明质酸的研究进展[J]. 长春理工大学学报:自然科学版,2011,34(3):101-106. Cui Yuan,Duan Qian,Li Yanhui. The research progress in hyaluronic acid[J]. Journal of Changchun University of Science and Technology:Social Sciences Edition,2011,34(3):101-106(in Chinese).
[2] Grigorij K,Šoltés L,Robert S,et al. Hyaluronic acid:A natural biopolymer with a broad range of biomedical and industrial applications[J]. Biotechnology Letters,2007,29(1):17-25.
[3] Caliari S R,Burdick J A. A practical guide to hydrogels for cell culture[J]. Nat Methods,2016,13(5):405-414.
[4] Hanjaya-Putra D,Bose V,Shen Y I,et al. Controlled activation of morphogenesis to generate a functional human microvasculature in a synthetic matrix[J]. Blood,2011,118(3):804-815.
[5] Cosgrove B D,Mui K L,Driscoll T P,et al. N-cadherin adhesive interactions modulate matrix mechanosensing and fate commitment of mesenchymal stem cells[J]. Nature Materials,2016,15(12):1297-1306.
[6] Zhu M,Lin S,Sun Y,et al. Hydrogels functionalized with N-cadherin mimetic peptide enhance osteogenesis of hMSCs by emulating the osteogenic niche[J]. Biomaterials,2015,77:44-52.
[7] Jcm V L,Lee M K,Qin E C,et al. Three dimensional conjugation of recombinant N-cadherin to a hydrogel for in vitro anisotropic neural growth[J]. J Mater Chem B Mater Biol Med,2016,4(42):6803-6811.
[8] Carmeliet P,Lampugnani M G,Moons L,et al. Targeted deficiency or cytosolic truncation of the VE-cadherin gene in mice impairs VEGF-mediated endothelial survival and angiogenesis[J]. Cell,1999,98(2):147-157.
[9] Harris E S,Nelson W J. VE-cadherin:At the front,center,and sides of endothelial cell organization and function[J]. Current Opinion in Cell Biology,2010,22(5):651-658.
[10] Xu K,Shuai Q,Li X,et al. Human VE-cadherin fusion protein as an artificial extracellular matrix enhancing the proliferation and differentiation functions of endothelial cell[J]. Biomacromolecules,2016,17(3):756-766.
[11] He N,Chen X,Wang D,et al. VE-cadherin regulates the self-renewal of mouse embryonic stem cells via LIF/Stat3 signaling pathway[J]. Biomaterials,2018,158:34-43.
[12] Bronckaers A,Hilkens P,Martens W,et al. Mesenchymal stem/stromal cells as a pharmacological and therapeutic approach to accelerate angiogenesis[J]. Pharmacology & Therapeutics,2014,143(2):181-196.
[13] Luo Y,Kirker K R,Prestwich G D. Cross-linked hyaluronic acid hydrogel films: New biomaterials for drug delivery[J]. Journal of Controlled Release,2000,69(1):169-184.
[14] Tokatlian T,Cam C,Segura T. Non-viral DNA delivery from porous hyaluronic acid hydrogels in mice[J]. Biomaterials,2014,35(2):825-835.
[15] Lam J,Segura T. The modulation of MSC integrin expression by RGD presentation[J]. Biomaterials,2013,34(16):3938-3947.
[16] 赵正达,袁伟忠,顾书英,等. 点击化学及其在生物医学领域的应用[J]. 化学进展,2010,22(2/3):417-426.Zhao Zhengda,Yuan Weizhong,Gu Shuying,et al. Click chemistry and its growing applications in biomedical field[J]. Progress in Chemistry,2010,22(2/3):417-426(in Chinese).
[17] Yang H,Gurgel P V,Jr Williams D K,et al. Binding site on human immunoglobulin G for the affinity ligand HWRGWV[J]. Journal of Molecular Recognition,2010,23(3):271-282.
[18] 王姜玲,冉维志. 透明质酸及其衍生物的现状和发展趋势[J]. 黑龙江医药科学,2014,37(6):117-118. Wang Jiangling,Ran Weizhi. Current status and development trend of hyaluronic acid and its derivatives[J]. Heilongjiang Medicine and Pharmacy,2014,37(6):117-118(in Chinese).
[19] 梁嘉碧,李 俊,汪 婷. 原位交联透明质酸水凝胶的制备及体外生物相容性研究[J]. 中国修复重建外科杂志,2016,30(6):767-771.Liang Jiabi,Li Jun,Wang Ting. Preparation and biocompatibility of in situ crosslinking hyaluronic acid hy-drogel[J]. Chinese Journal of Reparative and Reconstructive Surgery,2016,30(6):767-771(in Chinese).
[20] Collins M N,Birkinshaw C. Hyaluronic acid based scaffolds for tissue engineering—A review[J]. Carbohydr Polym,2013,92(2):1262-1279.
[21] Lei Y,Gojgini S,Lam J,et al. The spreading,migration and proliferation of mouse mesenchymal stem cells cultured inside hyaluronic acid hydrogels[J]. Biomaterials,2011,32(1):39-47.
[22] Caliari S R,Vega S L,Kwon M,et al. Dimensionality and spreading influence MSC YAP/TAZ signaling in hydrogel environments[J]. Biomaterials,2016,103:314-323.
[23] Li S,Nih L R,Bachman H,et al. Hydrogels with precisely controlled in tegrin activation dictate vascular patterning and permeability[J]. Nature Materials,2017,16(9):953-961.
Preparation and Characterization of VE-cad-Fc Functionalized Hyaluronic Acid Hydrogel
Yang Jun1, 2,Xie Jinghui1, 2,Gao Chao1, 2,Liu Kaizheng1, 2
(1. College of Life Science,Nankai University,Tianjin 300071,China;2. Key Laboratory of Bioactive Materials of Ministry of Education,Nankai University,Tianjin 300071,China)
To improve the biofunction of hyaluronic acid(HA) hydrogel, acryloyl hydrazide hyaluronic acid(HA-AC) was first synthesized by Michael addition reaction and click chemistry reaction, and then functionalized by human vascular endothelial cadherin fusion protein(VE-cad-Fc). Subsequently,its impact on the culturing of human umbilical cord mesenchymal stem cell(hUC-MSCs)was studied. Nuclear magnetic resonance spectroscopy and gelation time detection showed that the substitution rate of acrylation was 16% for HA,and the gelation time of the fusion protein-modified HA-AC upon mixture with DTT crosslinking agent was about 30 min. The quantitative determination of VE-cad-Fc by enzyme-linked immunosorbent assay(ELISA) showed that Fc domain specific binding(Fc-binding) polypeptides chemically bound in the HA-AC can significantly enhance the long-term stability of the fusion protein. The impacts of the hydrogel on hUC-MSCs was further characterized by a live cell staining experiment and the assay of cell adhesion and proliferation in 2D/3D cell culture. The results showed that immobilization of fusion protein in the hydrogel by Fc domain can significantly improve the adhesion,proliferation,and long-term clonal growth of hUC-MSCs in the gel. As a cell culture substrate(2D/3D culture),the fusion protein-functionalized hydrogel can be widely applied in several fields,such as tissue engineering and regenerative medicine.
hydrogel;hyaluronic acid;human umbilical cord mesenchymal stem cell;cell adhesion;cell proliferation
O636
A
0493-2137(2019)01-0033-07
2018-03-06;
2018-03-23.
杨 军(1968— ),女,博士,教授.
杨 军,yangjun106@nankai.edu.cn.
国家自然科学基金资助项目(31771067,31370965);国家重点研发计划资助项目(2016YFC1101304);天津市应用基础与前沿技术研究计划重点资助项目(17JCZDJC37600);教育部创新团队资助项目(IRT13023).
the National Natural Science Foundation of China(No.31771067,No.31370965),the National Key Research and Development Program of China(No.2016YFC1101304),the Tianjin Research Program of Application Foundation and Advanced Technology(No.17JCZDJC37600),the Ministry of Education Innovation Team Funding Project(No.IRT13023).
10.11784/tdxbz201803015
(责任编辑:田 军)
