一氧化氮信号途径参与草地早熟禾耐镉机制的研究
2019-12-20鲜靖苹王勇马晖玲
鲜靖苹,王勇,马晖玲*
(1. 甘肃农业大学草业学院, 草业生态系统教育部重点实验室,甘肃省草业工程实验室,中-美草地畜牧业可持续发展研究中心, 甘肃 兰州 730070; 2. 新乡学院生命科学技术学院, 河南 新乡 453000)

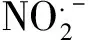
草地早熟禾(Poapratensis)是多年生禾本科(Gramineae)草本植物,在我国北方被广泛用于草坪建植,具有生物量大、适应性强、根系发达等特点,可以迅速覆盖地表,防止重金属通过水或风的侵蚀迁移到别处。我们在之前的研究中发现草地早熟禾可吸收重金属Cd[33],因此,将早熟禾作修复材料对Cd污染土壤修复具有潜在价值[34]。在众多报道中,关于植物信号NO在草地早熟禾Cd胁迫方面的研究尚未见报道。本文初步探究内源NO对草地早熟禾Cd胁迫生理响应机制,以期为草地早熟禾修复重金属污染土壤提供依据。
1 材料与方法
1.1 试验材料与试剂
采用由北京克劳沃草业技术开发中心提供的草地早熟禾‘午夜’(Poapratensis‘Midnight’)作为试验材料。分析纯CdCl2·2.5H2O购于上海中秦化学试剂有限公司;L-硝基精氨酸甲酯(L-NAME)、4-羧基苯-4,4,5,5-四甲基咪唑-1-氧-3-氧化物(cPTIO)、钨酸钠(Tungstate)均购于上海源叶生物科技有限公司。
1.2 试验设计与处理
选取颗粒饱满、大小一致的草地早熟禾种子若干,蒸馏水过夜浸泡后多次冲洗直至无瘪种子漂浮在水面上,70%酒精浸泡冲洗后的种子1 min,20%次氯酸钠溶液浸泡15 min,灭菌水冲洗5~6次,置于滤纸上晾干,均匀撒播至以蛭石为基床、直径8 cm、高10 cm的塑料育苗钵中,置于人工智能气候培养箱,每天喷施蒸馏水保持充足水分,昼夜温度为25℃/20℃,光周期循环16/8 h,幼苗展开3~4片叶后间苗至每钵30株均匀分布,移入盛有1/2 Hoagland营养液的培养盒中,每3 d更换1次营养液,营养液培养14 d后施加处理,设置5个处理(见表1),处理时间7 d,采叶片测定各项指标,处理重复3次。
植物中研究最多的两个NO的酶源是一氧化氮合酶(NOS)类型的酶和硝酸还原酶(NR)[35]。NOS催化L-精氨酸转化为L-瓜氨酸和NO;L-精氨酸类似物L-NAME已被广泛用于抑制植物中的NOS活性[36]。NR是一种含钼的酶,除了具有由硝酸盐生成亚硝酸盐的活性外,还通过亚硝酸盐还原催化NO的形成。钨酸盐是一种钼酸盐类似物,在体内抑制活性NR的形成[37],也被证明可以阻断NR依赖的NO生成[38]。cPTIO作为NO清除剂已被证明可提供一个氧原子结合NO生成NO2,同时cPTIO也可清除NO2,因此,产生的NO2被剩余的cPTIO清除[39]。
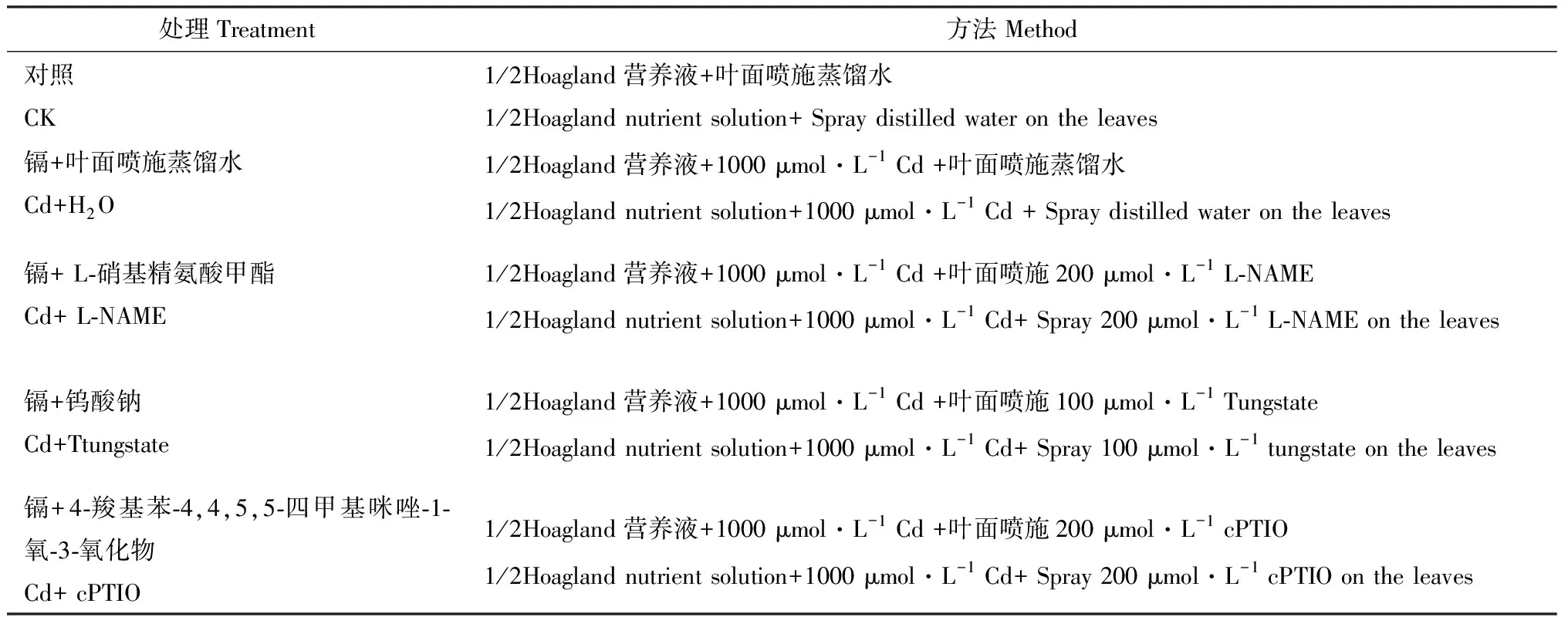
表1 试验处理Table 1 Test treatment
1.3 测定指标
APX活性:参考陈建勋的方法[40]。0.20 g草地早熟禾叶片在1.60 mL磷酸缓冲液(pH=7.80)中冰浴研磨,转入离心管中在4℃,12 000 g下离心20 min,取上清液0.10 mL上清液,加入1.70 mL含0.10 mmol·L-1EDTA-Na2的PBS(0.05 mol·L-1,pH=7),再加入0.10 mL 5 mmol·L-1的AsA,最后加入0.10 mL 20 mmol·L-1H2O2,立即在20℃下测定OD290值在40 s内的变化,计算单位时间内AsA减少量和酶活性(室温下测定,以不加H2O2为空白对照调零)。以1 min内A290变0.01定义为一个酶活性单位U,酶活性以U·g-1(FW)表示
APX活性(U·g-1)= △A290×VT/(0.01VS×t×W)
△A290表示在290 nm处吸光值的变化;VT:提取液总体积(mL);VS:酶液的体积(mL);W:叶片的鲜重(g);t:反应时间(s)
SOD活性:采用氮蓝四唑(NBT)光还原法测定[41]。0.20 g草地早熟禾叶片在1.60 mL磷酸缓冲液(pH=7.80)中冰浴研磨,转入离心管中在4℃、12000 g下离心20 min,取上清液40 μL,加入含3 mL反应混合液的反应管,同时做2支对照管,其中1支试管加3 mL反应混合液和40 μL PBS(不加酶液)作为最大光还原管,另1支加3 mL反应混合液和40 μL PBS同时遮光用于测定时调零。3 mL混合液由2.70 mL 14.50 mmol·L-1甲硫氨酸溶液、0.10 mL 3 mmoL·L-1EDTA-Na2溶液、0.10 mL 60 μmol·L-1核黄素溶液、0.10 mL 2.25 mmol·L-1NBT溶液组成,充分摇匀后4 000 Lux光照25℃下反应20 min。反应结束后以不照光的对照管调零,分别测定各管在560 nm下的吸光度(OD560),SOD活性单位以抑制NBT光化还原的50%为一个酶活单位(U)。
SOD活性(U·g-1Fw)= [(Ack-AE)×V]/(1/2Ack×W×Vt)
SOD活性以鲜重酶单位每克表示(U·g-1Fw);Ack为照光对照管的吸光度;AE为样品管的吸光度;V为样品液总体积(mL);Vt为测定时的酶液用量(mL);W为样品鲜重(g)。
POD活性:采用愈创木酚法测定[41]。0.20 g草地早熟禾叶片在1.60 mL磷酸缓冲液(pH=7.80)中冰浴研磨,转入离心管中在4℃、12 000 g下离心20 min,取上清液40 μL,加入含3 mL反应混合液的反应管,测定470 nm下的吸光度(OD470)值在40 s内的变化。以PBS (pH=6,0.20 mol·L-1)代替酶液为对照调零。反应混合液:取50 mL PBS(pH=6,0.20 mol·L-1)缓冲液于烧杯中,加入28 μL愈创木酚(2-甲氧基酚)于磁力搅拌器上加热搅拌,直至溶解愈创木酚溶解,待溶液冷却后加入19 μL 30% H2O2。以每分钟吸光度值变化(升高)0.01为1个酶活性单位(U)。
POD活性(U·g-1FW)=(ΔA470×Vt)/(W×Vs×0.01×t)
ΔA470:为反应时间内吸光度的变化;W为样品鲜重(g);t为反应时间(min);Vt为提取酶液总体积(mL);Vs为测定时取用酶液的体积(mL)。
CAT活性:采用过氧化氢还原法测定[41]。0.20 g草地早熟禾叶片在1.60 mL磷酸缓冲液(pH=7.80)中冰浴研磨,转入离心管中在4℃、12 000 g下离心20 min。
反应混合液的配制:取100 mL PBS(0.15 mol·L-1,pH=7),加入0.15 mL 30% 的H2O2摇匀即可。取2.90 mL反应液加入0.10 mL酶液,以PBS为对照调零,测定OD240值在40 s内的变化。以每min OD值减少0.01为1个酶活性单位(U)。
CAT活性(U·g-1FW)=[ΔA240×Vt]/(W×Vs×0.01×t)
ΔA240:为反应时间内吸光度的变化;W为样品鲜重(g);t为反应时间(min);Vt为提取酶液总体积(mL);Vs为测定时取用酶液体积(mL)。
叶绿素含量:0.20 g草地早熟禾叶片置于8 mL 95%无水乙醇溶液中浸泡24 h,测定450 nm,649 nm,665 nm波长下的吸光度。
Ca=13.95 A665-6.88 A649
Cb=24.96 A649-7.32 A665
Cx.c=(1000 A470-2.05 Ca-114.8 Cb)/245
Ca+b=6.1 A665+20.04 A649
式中:Ca、Cb分别为叶绿素a和b的浓度(mg·L-1);Cx.c为类胡萝卜素的总浓度(mg·L-1)。
相对含水量:0.20 g左右草地早熟禾叶片称鲜重(Fw),置于蒸馏水中遮光浸泡5~8 h,滤纸吸干表面水分,称量其饱水重(Tw),放入烘箱100℃杀青15 min,70℃烘至恒重,称干重(Dw),计算相对含水量:RWC=(Fw-Dw)/(Tw-Dw)
MDA含量:采用TBA(硫代巴比妥酸)显色测定[40]。称取植物叶片0.20 g,加入2 mL 10%三氯乙酸(Trichloroacetic acid,TCA)和少量石英砂,研磨至匀浆,然后加入8 mL 10%三氯乙酸进一步研磨,定容,4 000 r·min-1离心10 min,吸取2 mL上清液于10 mL具塞玻璃试管中,加入2 mL 0.6% 硫代巴比妥酸溶液,摇匀后沸水浴反应10 min,取出试管迅速冷却,4000 r·min-1离心10 min,取上清液,分别于532,450和600 nm处测定吸光度,按照公式计算MDA含量(μmol·g-1FW):
CMDA(μmol·L-1)=6.45(A532-A600)—0.56A450
MDA含量= CMDA×提取液的量(mL)/植物组织鲜重(g)
Pro含量:采用酸性茚三酮显色法测定[41]。称取叶片0.20 g,剪碎置于试管中,向试管中加入5 mL 3%磺基水杨酸,沸水浴中加热10 min(不断摇动),冷却后过滤至干净试管中(滤液为提取液)。吸取2 mL提取液、2 mL冰醋酸和2 mL酸性茚三酮于具塞玻璃试管中,沸水浴反应40 min,冷却后向试管中加入5 mL甲苯,充分振荡,静置分层后,在520 nm处比色(以甲苯为对照)。根据标准曲线,按照公式计算Pro含量(μg·g-1FW):
Pro含量=X×提取液总体积(mL)/(样品鲜重×测定时提取液体积(mL))
式中,X为标准曲线中查得Pro含量(μg)。
干物质含量:20株长势一致草地早熟禾幼苗称量叶片及根系鲜重(Fw)后置于烘箱60℃烘4 h,升温至105℃烘至恒重,称量绝对干重(Dw)。干物质含量=Dw/Fw×100%
1.4 数据处理
采用Spss 19.0分析处理数据,Excel 2016作图,Duncan法进行多重比较,本研究数据均用“平均值±标准误”表示。
2 结果与分析
2.1 内源NO对Cd胁迫下草地早熟禾幼苗叶片抗氧化酶活性的影响
图1显示,Cd处理及NO清除剂和合成抑制剂处理均不同程度增加了草地早熟禾SOD酶活性,添加NOS抑制剂、NO清除剂处理SOD活性分别比Cd胁迫升高了18.92%,25.80% (P<0.05),分别比对照增加了36.93%,44.85%(P<0.05),NR抑制剂处理则与CK差异不显著(P>0.05)。

图1 内源NO对Cd胁迫下草地早熟禾幼苗叶片SOD活性的影响Fig.1 Effect of endogenous NO on SOD activity in leavesof Poa pratensis seedlings under cadmium stress
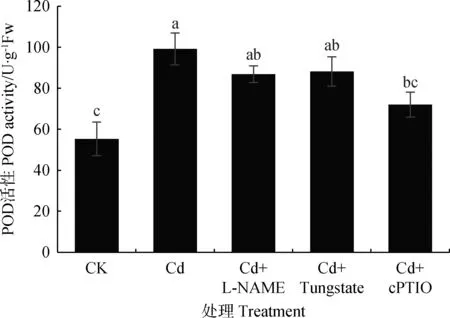
图2 内源NO对Cd胁迫下草地早熟禾幼苗叶片POD活性的影响Fig.2 Effect of endogenous NO on POD activity in leaves of Poa pratensis seedlings under cadmium stress
图2显示,单一Cd胁迫对POD活性影响最大,比CK增加79.22%(P<0.05)。NOS抑制剂、NR抑制剂处理POD活性分别比CK升高56.93%,59.34%(P<0.05)。然而,相对于单一Cd胁迫,添加NO清除剂后POD活性降低27.39%(P<0.05)。因此,可得出抑制内源NO产生可导致草地早熟禾POD活性降低。
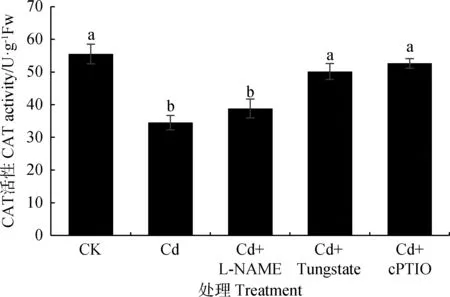
图3 内源NO对Cd胁迫下草地早熟禾幼苗叶片CAT活性的影响Fig.3 Effect of endogenous NO on CAT activity in leavesof Poa pratensis seedlings under cadmium stress
Cd胁迫会降低草地早熟禾幼苗叶片CAT活性(图3)。1000 μmol·L-1Cd处理CAT活性比CK降低37.84%(P<0.05)。添加NOS抑制剂、NR抑制剂、NO清除剂后CAT活性分别增加12.56%,45.41%,52.66%;NR抑制剂、NO清除剂处理CAT活性显著高于NOS抑制剂处理与Cd处理(P<0.05)。NO清除剂处理下CAT增幅最大,其次是添加NR抑制剂处理,因此,可得出抑制内源NO可不同程度增加CAT活性。
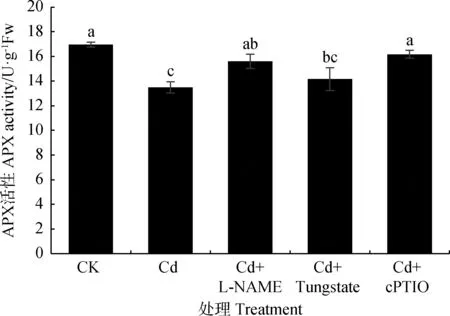
图4 内源NO对Cd胁迫下草地早熟禾幼苗叶片APX活性的影响Fig.4 Effect of endogenous NO on APX activity in leavesof Poa pratensis seedlings under cadmium stress
Cd处理草地早熟禾幼苗叶片APX活性比CK降低20.45%(图4,P<0.05)。添加NOS抑制剂、NO清除剂后APX活性分别比Cd处理升高15.65%,19.85%(P<0.05)。Cd处理降低草地早熟禾APX活性,减少内源NO可增加APX活性,且添加NOS抑制剂和NO清除剂增幅最大。
2.2 内源NO对Cd胁迫下草地早熟禾幼苗叶片光合特性的影响
表1显示,Cd胁迫可降低草地早熟禾幼苗叶片色素含量,1000 μmol·L-1Cd胁迫下叶绿素a、叶绿素b、类胡萝卜素含量均显著降低,Cd胁迫下添加NOS抑制剂、NR抑制剂、NO清除剂处理可不同程度增加叶绿素a、叶绿素b、类胡萝卜素含量。Cd处理与CK相比,叶绿素a/b的值增加,但差异不显著(P>0.05)。Cd胁迫下添加NOS抑制剂及NO清除剂均显著降低叶绿素a/b的值(P<0.05),因此,添加NO清除剂及合成抑制剂可较大程度草地早熟禾光合色素含量,且根据叶绿素a/b的值发现抑制NOS途径及添加NO清除剂对草地早熟禾产生影响较大。

表1 内源NO对Cd胁迫下草地早熟禾幼苗叶片光合特性的影响Table 1 Effects of endogenous NO on photosynthetic characteristics in leaves of Poa pratensis seedlings under cadmium stress
2.3内源NO对Cd胁迫下草地早熟禾幼苗叶片MDA含量的影响
Cd胁迫处理可增加MDA含量(图5)。添加NOS抑制剂、NO清除剂后MDA含量分别比Cd处理MDA含量增加87.19%,93.19%(P<0.05)。因此,Cd胁迫可导致草地早熟禾质膜损伤,Cd胁迫添加NOS抑制剂和NO清除剂可显著加剧质膜损伤,而添加NR抑制剂则影响程度较小,表明NOS途径在缓解氧化胁迫方面作用强于NR途径,且NO的产生对早熟禾减轻膜质损伤具有重要作用。
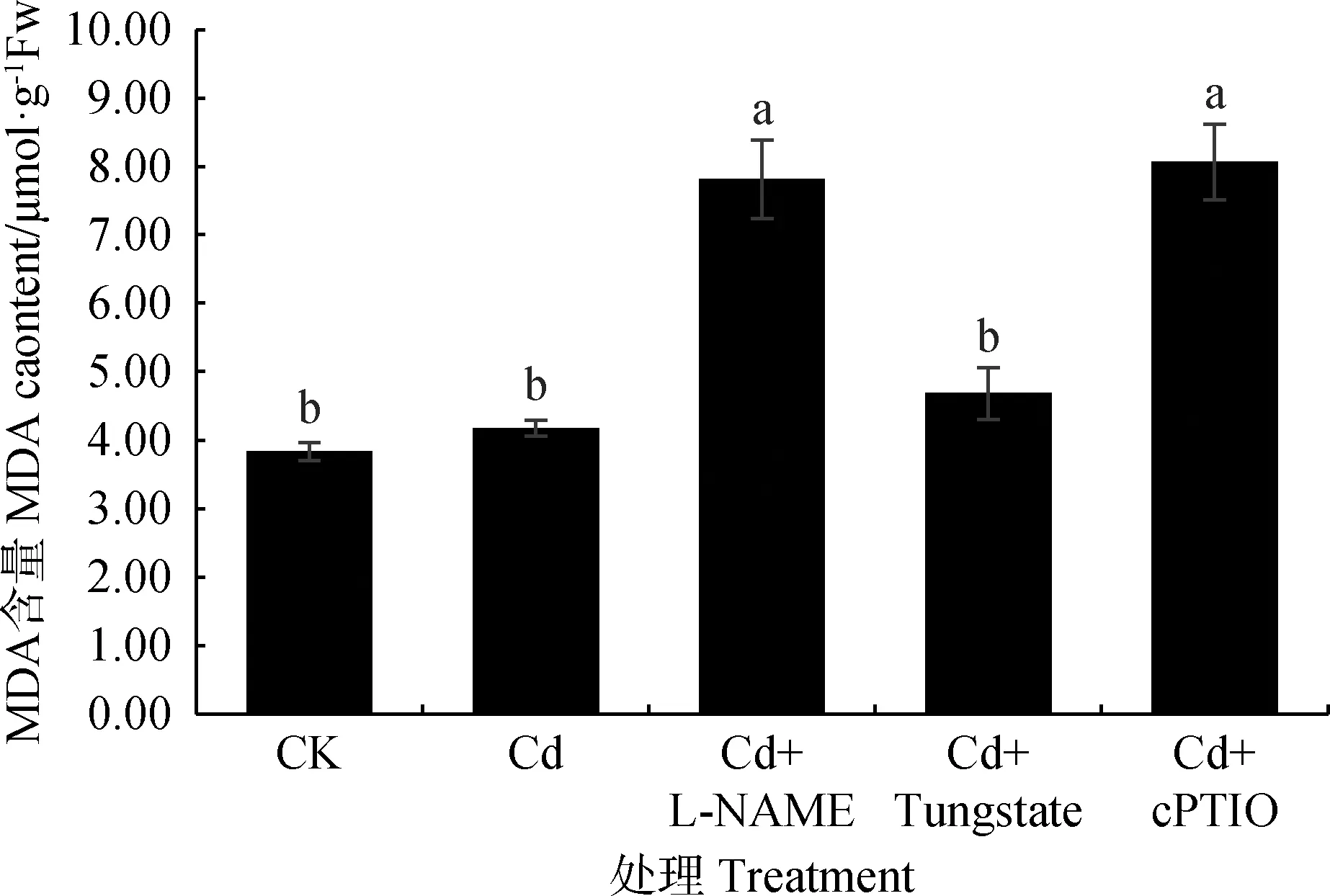
图5 内源NO对Cd胁迫下草地早熟禾幼苗叶片MDA含量的影响Fig.5 Effect of endogenous NO on MDA content inleaves of Poa pratensis seedlings under cadmium stress
2.4 内源NO对Cd胁迫下草地早熟禾幼苗叶片Pro含量的影响
图6显示,Cd胁迫下Pro含量显著增加(P<0.05),添加NOS抑制剂、NR抑制剂、NO清除剂分别比Cd处理Pro含量降低38.79%,63.39%,36.30%(P<0.05)。分析发现,Cd胁迫下添加NO合成抑制剂及清除剂可显著影响草地早熟禾Pro含量且添加NR抑制剂影响程度最大,因此,内源NO对Cd胁迫下早熟禾体内Pro合成具有重要意义。
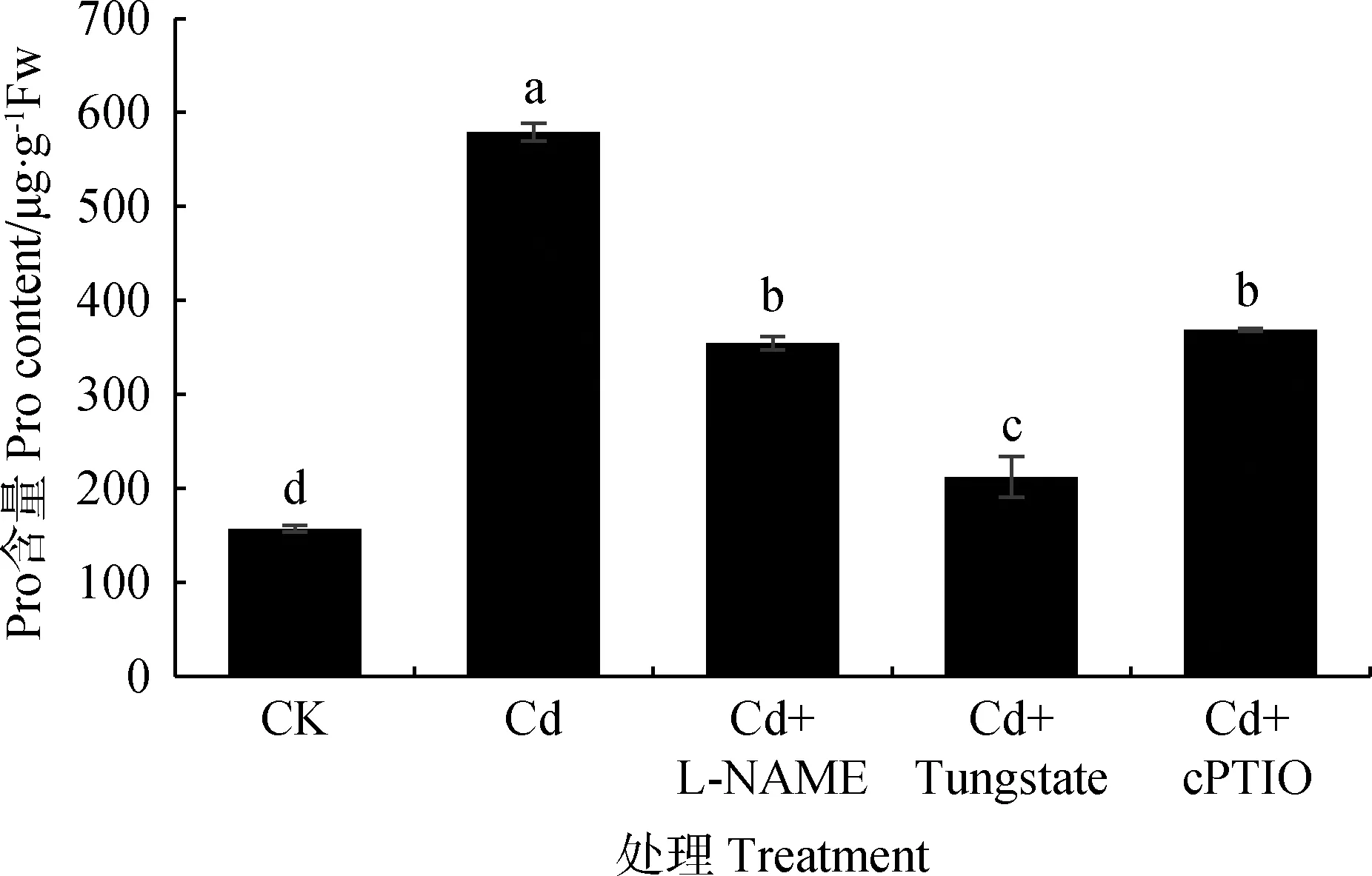
图6 内源NO对Cd胁迫下草地早熟禾幼苗叶片Pro含量的影响Fig.6 Effect of endogenous NO on Proline content in leavesof Poa pratensis seedlings under cadmium stress
2.5 内源NO对Cd胁迫下草地早熟禾幼苗生长的影响
图7显示,Cd胁迫处理显著影响草地早熟禾相对含水量(P<0.05),添加NOS抑制剂、NO清除剂处理相对含水量比Cd处理相对含水量分别降低15.73%,27.13%(P<0.05),而添加NR抑制剂对相对含水量影响较小,因此,抑制NOS途径及添加NO清除剂可加重草地早熟禾的毒害。
图8显示,Cd胁迫可降低草地早熟禾幼苗叶片干物质量,添加NOS抑制剂、NO清除剂处理干物质量分别比Cd处理干物质量降低13.39%,11.51%(P<0.05)。添加NR抑制剂处理则降幅较小,因此,NO合成抑制剂与NO清除剂可不同程度降低草地早熟禾干物质量,内源NO在草地早熟禾抵御Cd毒害方面具有积极作用,且NOS途径的贡献大于NR途径。
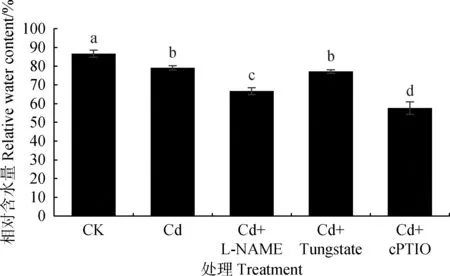
图7 内源NO对Cd胁迫下草地早熟禾幼苗叶片相对含水量的影响Fig.7 Effect of endogenous NO on relative water contentin leaves of Poa pratensis seedlings under cadmium stress
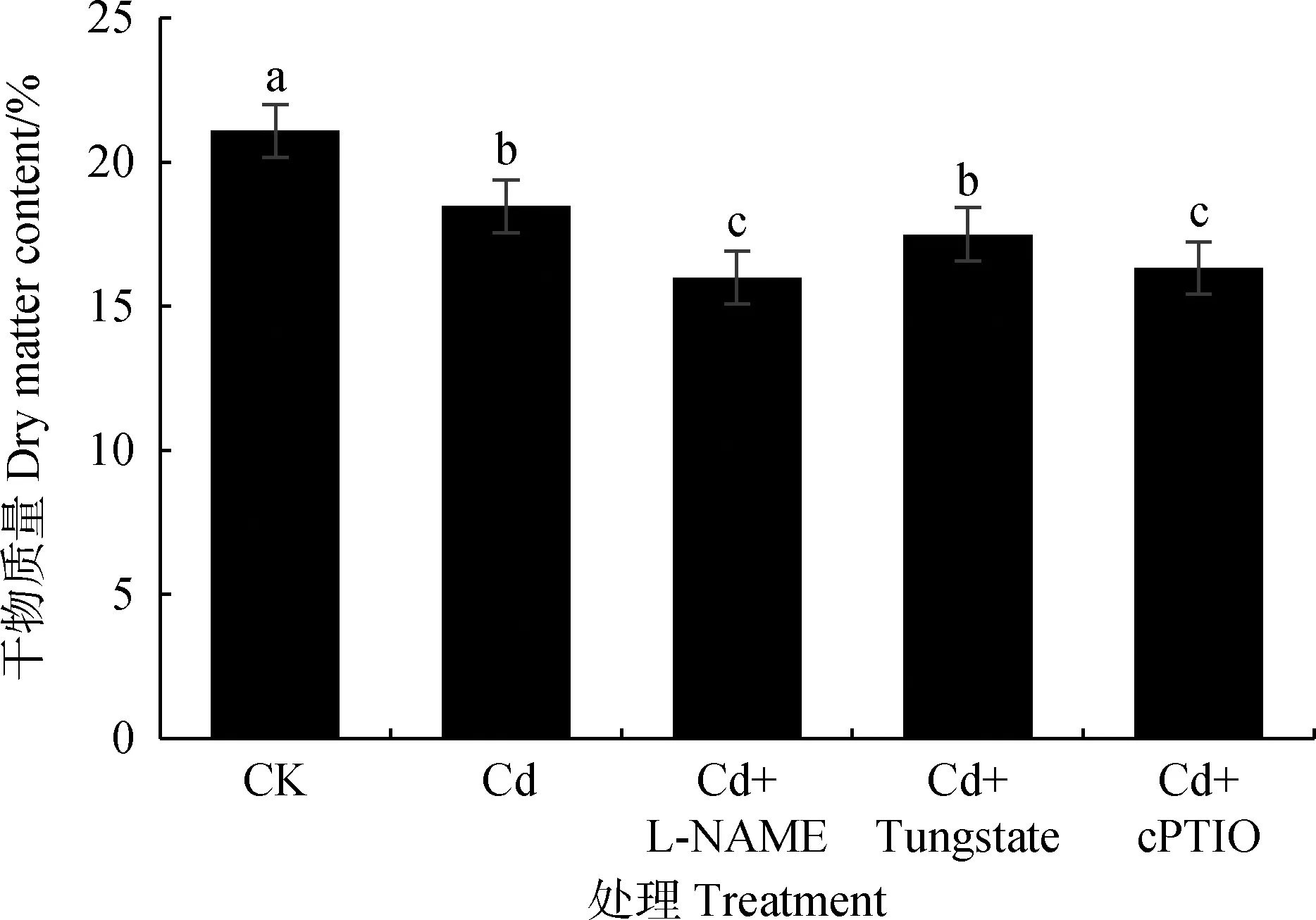
图8 内源NO对Cd胁迫下草地早熟禾幼苗叶片干物质量的影响Fig.8 Effect of endogenous NO on dry matter content in leaves of Poa pratensis seedlings under cadmium stress
2.6 Cd胁迫下NO合成抑制剂及清除剂对草地早熟禾幼苗叶片NO含量的影响
图9显示,Cd胁迫下草地早熟禾体内NO含量增加,Cd胁迫下添加NOS抑制剂、NR抑制剂、NO清除剂可显著降低NO含量,CK及Cd处理都具有较高内源NO水平。NOS途径产生较多NO而NR途径则产生量较少。

图9 NO合成抑制剂及清除剂对草地早熟禾幼苗叶片NO含量的影响Fig.9 Effect of NO synthesis inhibitors and scavengers on NO content in leaves of Poa pratensis seedlings
3 讨论
非生物胁迫水平下添加L-NAME和Tungstate可分别抑制一氧化氮合成酶途径、硝酸还原酶途径产生NO,而添加cPTIO可有效清除植物体内NO[42]。图9显示,添加NOS抑制剂、NR抑制剂、NO清除剂可显著降低Cd胁迫下草地早熟禾幼苗叶片内源NO含量(P<0.05),其中NO清除剂cPTIO降低程度最大,而NR抑制剂Tungstate降低程度较小,NOS抑制剂L-NAME清除内源NO作用效果优于NR抑制剂Tungstate,因此,NOS途径可能是草地早熟禾幼苗叶片产生内源NO的主要途径,一氧化氮合酶可能是合成内源NO的关键酶。
植物在逆境胁迫下会产生ROS信号引发植物防御反应,而酶类和非酶类抗氧化物质组成的抗氧化系统则被激活来抵御氧化胁迫,酶类抗氧化剂则被认为是最直接、最有效的途径[43]。有研究指出,适宜浓度的外源NO可增加野生早熟禾的抗氧化酶活性[44],并可通过提高抗氧化酶活性来缓解紫花苜蓿(Medicagosativa)PEG胁迫[45]、小麦(Triticumaestivum)铜胁迫[46];这些研究结果与本文研究结果一致,本试验中在镉胁迫下,草地早熟禾通过提高SOD活性清除Cd胁迫产生的过量超氧自由基阴离子,减少内源NO也可使SOD活性增加,这与刘柿良[5]研究结果一致;SOD清除ROS的同时产生大量H2O2,植物通过增强POD活性来代谢过量H2O2,所以导致草地早熟禾叶片POD活性增强,而NO可通过提高POD活性来增加植物抗逆性,清除
NO后POD活性降低,氧化胁迫加重;Cd离子占据了抗氧化酶活性中心,使这些酶失去原有功能,所以本试验中草地早熟禾幼苗叶片的CAT和APX活性在Cd胁迫下表现出明显下降;内源NO的减少可使草地早熟禾幼苗叶片CAT和APX活性增加,这和牛奎举[15]的研究结果一致,可能是因为SOD歧化反应产生过量H2O2,提高幼苗叶片CAT和APX活性可清除过量的H2O2。
高浓度Cd胁迫导致植物叶片脱落,叶绿素含量降低,并抑制叶绿素的生物合成从而抑制光合作用[47]。高桂青等[49]指出,Cd胁迫可显著降低马来眼子菜(PotamogetonMalaianus)叶绿素a、叶绿素b、类胡萝卜素含量及叶绿素a/b的值;本研究结果与其一致,即Cd胁迫导致草地早熟禾幼苗叶片叶绿素a、叶绿素b、类胡萝卜素含量降低,其原因可能是Cd离子被植物吸收后可与巯基蛋白结合或取代Fe2+,Mg2+,Zn2+等[48]。吴旭红等[50]研究发现外源NO可提高冷害胁迫下南瓜(Cucurbitamoschata)幼苗叶片叶绿素a、叶绿素b、类胡萝卜素含量及叶绿素a/b的值,本试验结果与其不同,本试验中抑制内源NO的产生促进了叶绿素a、叶绿素b、类胡萝卜素含量增加,这可能是植物为抵抗外界胁迫而做出的反应。本研究中,叶绿素a/b的值在添加Cd胁迫及添加Cd胁迫同时施加NR抑制剂后略有增加,表明轻度胁迫在一定程度上可增强植物抗逆性,而添加NOS抑制剂及NO清除剂后叶绿素a/b的值显著降低(P<0.05),表明内源NO可影响草地早熟禾对重金属Cd的耐受程度。
MDA是膜质过氧化产物,其含量可反映植物在胁迫条件下体内膜质过氧化的程度[15]。本试验中,草地早熟禾幼苗叶片MDA含量在Cd胁迫下呈增加趋势,这可能与Cd胁迫导致植物体内膜质过氧化有关,这与尚玉坤等[51]和古洪双等[52]的研究结果一致;而同时我们发现,抑制草地早熟禾幼苗内源NO的产生可导致MDA含量增加,说明内源NO的减少使植株受到的氧化胁迫加重,结果表明,NO信号分子可通过降低MDA在草地早熟禾体内的累积来缓解镉胁迫引发的植株叶片氧化损伤,这与张倩等[53]和杨杨[54]的研究结果相似。
Pro在植物抵御Cd胁迫方面具有重要作用,大量研究指出Cd胁迫下植物体内Pro含量显著增加,例如关于狼尾草(Pennisetumalopecuroides)[55]、柠条锦鸡儿(Caraganakorshinskii)[56]、小麦[57]等的研究,与这些结果类似,本研究中施加Cd胁迫后草地早熟禾叶片Pro大量累积,原因一方面可能是为了清除自由基,另一方面是为了促进植物螯合肽GSSG合成[5]。王芳等[58]指出Cd胁迫可降低玉米(Zeamays)植株体内Pro含量,马晓丽等[59]研究发现外源NO可降低Cd胁迫下小麦Pro的累积,本研究结果与其相似,试验中减少内源NO后植物Pro含量降低,可能是因为NO可通过调节纤维素含量来缓解Cd胁迫,或是清除NO或抑制NO产生后Cd离子进入细胞内部对植物产生毒害或与Pro形成复合物,降低Pro含量[60]。
NO信号在植物生长方面也具有积极作用[61],本研究中施加Cd胁迫后草地早熟禾幼苗叶片相对含水量及干物质量降低,主要原因可能是Cd2+通过抑制草地早熟禾水孔蛋白基因表达而抑制植物对水分的吸收,降低植物相对含水量;其次,Cd2+可能通过影响植物细胞分裂及伸长来抑制植物生长。Cd胁迫水平下施加ROS抑制剂、NR抑制剂、NO清除剂均不同程度降低草地早熟禾幼苗叶片相对含水量及干物质量,可能是因为清除NO后Cd胁迫毒害效应加重,导致干物质量及相对含水量降低。
4 结论
NO在植物生理及生长方面具有积极意义,添加NOS抑制剂、NR抑制剂、NO清除剂可显著抑制草地早熟禾内源NO的产生,NOS途径可能是草地早熟禾内源NO产生的主要途径;Cd胁迫下内源NO可通过调控草地早熟禾抗氧化酶活性来维持活性氧平衡,可通过降低MDA含量,增加Pro含量,增加光合色素含量,增加干物质量、相对含水量以减轻Cd胁迫造成的生长抑制,增强植物抗逆性。
