外源NO缓解草地早熟禾镉胁迫的转录组分析
2019-12-20鲜靖苹马晖玲
鲜靖苹, 王 勇, 马晖玲*
(1. 甘肃农业大学草业学院, 草业生态系统教育部重点实验室, 甘肃省草业工程实验室, 中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070; 2. 新乡学院生命科学技术学院, 河南 新乡 453000)
一氧化氮(Nitric Oxide,NO)是一种容易通过细胞膜扩散且在各种生物体中起着重要作用的简单气体小分子[1]。近年来,越来越多的证据表明NO参与了植物的许多关键生理过程,如发芽[2]、线粒体功能性[3]、引力作用[4]和花调控[5]。另一方面,NO可介导植物调节因子和活性氧(Reactive oxygen species,ROS)代谢,许多试验表明它参与信号转导[6-7]和对植物生物和非生物胁迫的反应[8-9]。NO通过调节活性氧及激素水平,在细胞保护中发挥重要作用[10-11],并通过诱导转录变化来鉴定参与不同功能过程的基因,如信号转导、防御和细胞死亡、转运、基本代谢以及活性氧产生和降解[11-12]。
镉主要来源于工业过程和农业实践,是一种非必需的、剧毒性强的重金属,具有较长的生物半衰期,对大多数生物都是危险的。镉很容易被植物吸收,导致毒性症状,如:失绿[13]、萎蔫[14]、光合作用抑制[15]、生长减少[16]、细胞死亡[17]。Cd通过诱导膜质组成的改变导致膜功能变化,同时影响与膜相关酶的活性,如H+-ATPase(质子泵)[18],破毁光系统中的电子传递链,影响色素蛋白复合物的聚集[19],破坏植物水分平衡,影响气孔关闭[20-21],影响植物对营养元素和微量元素的吸收及分配,抑制植物生长[22]。
草地早熟禾(Poapratensis)作为多年生冷季型草坪草被广泛种植。因其繁殖、抗逆、再生等性状优良而被用于城市绿化、运动场、高尔夫球场草坪建设。在重金属的植物修复方面,草地早熟禾可以迅速覆盖地面,防止重金属通过水或风的侵蚀迁移到其他地方;不进入食物链,对人类健康不存在隐患;并可通过多次刈割来减少土壤的重金属污染,基于以上优点,草坪草在重金属的植物修复方面的作用越来越受到重视。
以往研究表明,外源NO可改善Cd胁迫对植物的毒害作用[23-24]。可能是因为其作为氧化剂清除自由基[25],或者作为信号分子在碳水化合物代谢和细胞壁生物合成,萜类生物合成,或生长调节等方面发挥作用[26]。草地早熟禾根系发达,对镉有良好的吸收和积累能力,在镉污染土壤中具有潜在的植物修复功能[27]。我们前期做的预试验也充分证明NO可缓解草地早熟禾Cd胁迫,然而,这一现象背后的确切分子机制仍不清楚。RNA-Seq技术是一个高通量的转录组分析平台,可以高效、经济地研究各种类型的基因表达,甚至对许多非模型物种也是如此[28-29]。本研究首次对Cd胁迫下的草地早熟禾NO诱导的差异表达基因(Differentially expressed genes,DEGs)进行了基于转录组的分析鉴定。通过数据的统计评估可知数据质量良好。并利用RNA-Seq分析揭示了与镉胁迫相关的基因以及NO调控的相关信号通路。这些结果为深入了解草地早熟禾重金属解毒机制提供了基础。
1 材料与方法
1.1 试验材料
本试验以北京克劳沃草业技术开发公司提供的草地早熟禾”Midnight”为试验材料,于2018年2-5月在甘肃农业大学草业学院分子生物学实验室及温室中进行。
1.2 试验处理
选取颗粒饱满,大小一致的草地早熟禾种子若干,蒸馏水过夜浸泡后多次冲洗直至无瘪种子漂浮在水面上,70%酒精浸泡冲洗后的种子1min,20%次氯酸钠溶液浸泡15min,灭菌水冲洗5~6次,置于滤纸上晾干,均匀撒播至填装蛭石的育苗钵置于人工智能气候培养箱,每天喷施蒸馏水保持充足水分,昼夜温度为25/20℃,光周期循环16/8 h,幼苗展开3~4片叶后间苗至每钵30株均匀分布,移入盛有1/2Hoagland营养液的培养盒中,每3 d更换一次营养液。
在60天的生长期后,进行试验处理,所有处理浓度和时间均在前期预实验的基础上进行。以镉离子浓度为1 000 μmol·L-1的CdCl2·2.5 H2O溶液模拟镉胁迫。以浓度为50 μmol·L-1硝普钠(Na2[Fe(CN)5NO]·2H2O)作为NO供体,设置4个处理CK(1/2Hoagland营养液+叶面喷施蒸馏水)、Cd(1/2Hoagland营养液+1 000 μmol·L-1Cd +叶面喷施蒸馏水)、NO(1/2Hoagland营养液+叶面喷施硝普钠)、Cd +NO(1/2Hoagland营养液+1 000 μmol·L-1Cd +叶面喷施硝普钠)。每个处理3个重复。在处理后24 h后收集叶片样本,冷冻在液氮中,保存在-80℃准备送样测序。
1.3 mRNA高通量测序
使用TRIzol Reagent(Invitogen)试剂盒提取每个样品的总RNA。并通过Agilent 2100生物分析仪(Agilent Technologies,Palo Alto,CA,USA)、NanoDrop(Thermo Fisher Scientific Inc.)进行定量和鉴定。用1μg RIN值大于7的RNA进行后续文库的制备。根据(NEBNext®UltraTMLibrary Prep Kit for Illumina®)的方法构建下一代测序文库。使用Ribo-ZeroTMrRNA去除试剂盒(Illumina)进行Poly(A)mRNA分离。NEBNext第一链合成反应缓冲液和NEBNext随机引物进行mRNA的裂解和引物处理。用ProtoScript II逆转录酶合成第一链cDNA,用第二链合成酶Mix合成第二链cDNA。将AxyPrep Mag PCR Clean-up(Axygen) 纯化的双链cDNA用End Prep酶混合处理以修复两端并在一个反应中添加dA-拖尾,然后进行T-A连接,在两端添加适配器。每个样本使用P5和P7引物进行11个循环PCR扩增。用AxyPrep Mag PCR Clean-up(Axygen)对PCR产物进行纯化,Agilent 2100生物分析仪(Agilent Technologies,Palo Alto,CA,USA)进行验证,并利用Qubit 2.0荧光仪(Invitogen,Carlsbad,CA,USA)定量。用Illumina HiSeqTM2000对RNA样品进行转录组测序。
1.4 数据分析
1.4.1质量控制: 为了去除技术序列,包括适配体、聚合酶链反应(Polymerase Chain Reaction,PCR)引物或其片段,以及低于20的碱基质量,FASTQ格式数据被CutAdapter[30](版本1.9.1)过滤为高质量的干净数据。
1.4.2程序: Trinity[31]组装是一种从RNA-seq数据中高效地从头开始重建转录本的新方法。Trinity组合了三个独立的软件模块:inchWorm,Chrysalis和Butterfly,依次应用于处理大量RNA-seq读取。其次,通过CD-HIT去除重复重叠群[32],得到Unigene序列文件。
1.5 表达分析
以Unigene序列文件作为参考基因文件,RSEM[33](v1.2.6)从对端清洁数据估计基因和异构体的表达水平。
1.5.1差异表达基因分析 差异表达分析使用DESeq[34]Bioconductor Package,基于负二项分布模型。经Benjamini和Hochberg控制错误发现率方法调整后,将基因的P值设置为小于0.05以检测差异表达基因。
1.5.2GO和KEGG富集分析 使用Go-TermFinder识别基因本体论(GO)术语,这些术语注释了一系列p值显著小于0.05的富集基因。
京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)是处理基因组、生物途径、疾病、药物和化学物质(http://en.wikipedia.org/wiki/KEGG).)数据库集合。在内部使用脚本来丰富KEGG通路中的显著差异表达基因。
1.6 注释
使用BLAST软件注释Unigene序列。所有数据库包括Nr,COG,Swissprot,KEGG,GO。
1.7 实时荧光定量PCR分析
随机选取11个差异表达基因进行实时荧光定量(Quantitative Real-time PCR,qRT-PCR)分析,对高通量数据进行验证。用HiScript®ⅡQ RT SuperMix for qPCR试剂盒反转录合成cDNA,设计引物(表1) 进行qRT-PCR实验,Actin基因作为内参。各个处理均做3次重复,采用2-△△CT方法[35]。计算基因的相对表达量。

表1 实时定量PCR选用基因及其引物Table 1 Genes and its primers for qRT-PCR
2 结果与分析
2.1 测序结果的评估及组装
测序得到的对照及各处理组的Raw Reads都在4 313万条以上。经Trinity组装,得到的Unigene总数为478 702,平均长度为630.03 bp,N50长度为884 bp,如表2所示,组装所得片段有很高的组装完整性,组装所得序列长,测序质量好。
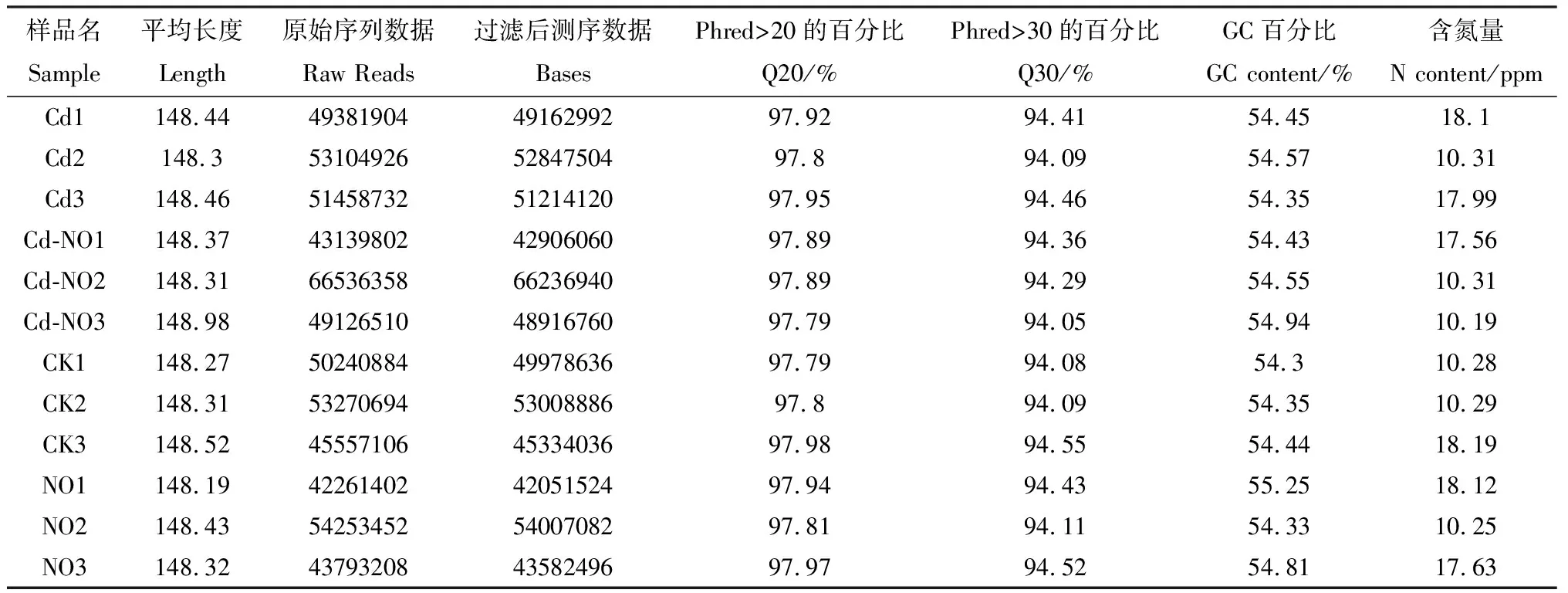
表2 测序数据输出质量情况Table 2 Sequencing data quality evaluation
2.2 Unigene的功能注释
分别基于Nr,COG,SwissProt和KEGG数据库作总Unigene注释,结果如表3。4个数据库可注释的Unigene数目为275 708,占总Unigene数目的57.59%。269 494注释到NR文库中,占总Unigene的56.3%。在COG,Swissprot和KEGG文库中,分别注释了117 849,155 509和54 251个基因,分别占总Unigene的24.6%,32.5% 和11.3%。Unigene可注释到不同物种的数量由高到底依次为二穗短柄草(Brachypodiumdistachyon),数量为71 581条,占总Unigene的15.0%;其次为大麦(Hordeumvulgaresubsp.vulgare)和节节麦(Aegilopstauschii)数量分别48 606条和42 438条,分别占总Unigene的10.2%和8.9%。

表3 Unigene在各大数据库中的功能注释分布百分比Table 3 Percent distribution of Unigene functional annotation according to the major databases
2.3 差异表达基因分析
如表4所示,与CK对照组相比,Cd处理组共有8 055条差异表达基因(differentially expressed genes,DEG),其中7 022条DEG上调表达,1 033条DEG下调表达。与CK对照组相比,NO处理组共有9 609条差异表达基因,其中7 463条DEG上调表达,2 146条DEG下调表达。Cd与Cd+NO处理组进行比较,共有2 584条差异表达基因,其中466条DEG上调表达,2 118条DEG下调表达。从DEG分析来看,虽然镉胁迫导致DEG增多,但NO处理引起基因表达的改变,因此,识别这些基因成为了重点。
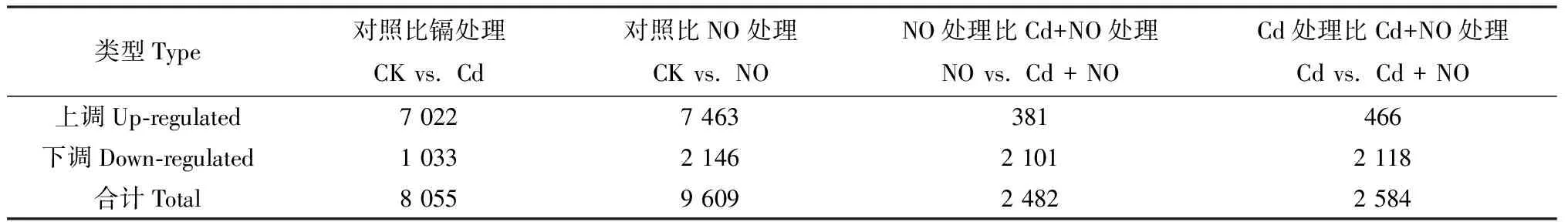
表4 草地早熟禾转录组对NO和Cd胁迫响应的差异表达基因分析Table 4 Comparisons of differentially expressed genes (DEGs) in Kentucky bluegrass with NO and Cd treatment
2.4 差异表达基因的GO分析
GO分析得到的DEGs功能注释如表5。将Cd处理组和对照组、NO处理组和对照组的DEGs功能注释分别进行比较,可将8 055和9 609 DEGs分别注释到9 166和10 515个功能组。NO处理组与Cd + NO处理组的DEGs功能注释比较,可将2 482个DEGs注释到2 629个功能组。为了探索NO对于镉胁迫的缓解作用,重点进行Cd处理组和Cd +NO处理组比较的GO富集分析,我们发现共有2 584个DEGs被注释到3 199个功能组,这些功能组分别属于生物过程(biological process)、分子功能(molecular function) 和细胞成分(cellular component)。生物过程范畴内,基因分为代谢过程的响应(945,84.4%)、有机物代谢过程(685,61.2%)、初级代谢过程(639,57.1%)、单体代谢过程(489,43.7%)、碳水化合物代谢过程(214,19.1%)和小分子代谢过程(215,19.2%)等。在细胞成分聚类中,主要有细胞(549,72.0%)、细胞部分(549,72.0%)、细胞质(417,54.7%)、细胞内细胞器(423,55.4%)、细胞膜(372,48.8%)和细胞内膜结合细胞器(366,48.0%)等作为DEGs突出的代表。分子功能聚类中,注释最多的是催化活性(1107,84.1%),其次是离子结合(517,39.3%)、转移酶活性(396,30.1%)、水解酶活性(373,28.3%)、金属离子结合(321,24.4%)、阳离子结合(324,24.6%)以及氧化还原酶活性(257,19.5%)。
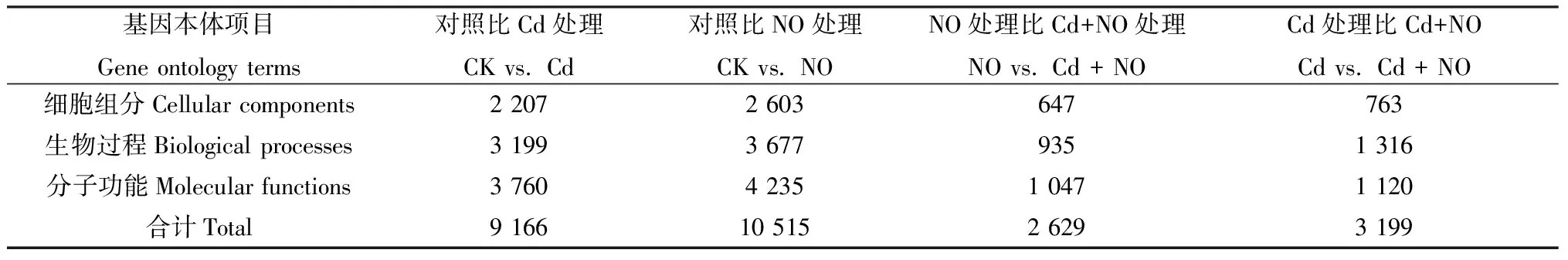
表5 差异表达基因本体分析Table 5 Gene ontology analysis of DEGs
2.5 差异表达基因的KEGG富集分析
KEGG分析表明,DEGs可分为140条KEGG通路。主要富集途径包括激素信号转导、代谢途径、次生代谢产物的生物合成、半胱氨酸和蛋氨酸代谢、精氨酸和脯氨酸代谢、半乳糖代谢、淀粉和蔗糖代谢、氨基酸生物合成和氮代谢。同时,44个通路被发现与重金属运输和细胞解毒有关,包括MAPK信号通路,氨基酸生物合成、碳水化合物转运与代谢、植物激素信号转导、半胱氨酸(Cyst)和蛋氨酸(Met)代谢、苯丙烷生物合成、氮代谢、过氧化物酶体和ABC转运蛋白等。
2.6 实时荧光定量PCR验证
随机选取11个差异表达基因,其中含有2个上调表达的差异基因(R-CK-TRINITY_DN124167_c0_g1_i1、M-Cd-NO-TRINITY_DN117299_c1_g2_i2)和9个下调表达的差异基因(M-NO-TRINITY_DN121243_c0_g2_i1,R-Cd-NO-TRINITY_DN142597_c2_g1_i1,R-Cd-TRINITY_DN137640_c1_g7_i2,M-CK-TRINITY_DN128501_c1_g19_i1,R-Cd-NO-TRINITY_DN144383_c1_g1_i4,M-CK-TRINITY_DN132271_c0_g5_i2,M-Cd-NO-TRINITY_DN125255_c1_g10_i5,R-Cd-NO-TRINITY_DN133509_c1_g4_i4,M-Cd-TRINITY_DN124248_c0_g4_i1),以Actin为内参进行qRT-PCR验证。由图3可知,11个基因的表达趋势与高通量测序结果基本一致,表明测序结果有效可靠。
3 讨论
本研究中,通过COG功能分析对Cd+NO处理组和Cd处理组进行对比,发现差异基因富集在碳水化合物转运和代谢、信号转导机制、翻译后修饰、分子伴侣、蛋白质周转、脂质转运和代谢、无机离子转运和代谢、氨基酸转运和代谢等方面。因此,NO诱导的转录及代谢调节从多方面响应镉胁迫。Cd胁迫导致的差异基因表达和调控由特定信号转导级联引起,例如:活性氧、NO信号、钙离子信号等,丝裂原活化蛋白激酶(MAPK)级联参与环境胁迫响应,包括MAPKKK,MAPKK,MAPK三种激酶,它们通过磷酸化及去磷酸化被激活后参与调控基因表达并引起植物对发育及环境的刺激反应[36]。在紫花苜蓿幼苗中报道了这种由Cd胁迫诱导的MAPK激活,其中Cd胁迫导致四种不同的MAPK激活:MMK2,MMK3,SIMK和SAMK[37]。本研究中158条差异基因富集在信号转导机制方面,MAPK级联反应中的18条基因参与调节SAPK4(gi|961441516|ref|NP_001304812.1|)、丝氨酸/苏氨酸蛋白激酶SRK2(gi|942539948|gb|ALL27273.1|)、丝氨酸/苏氨酸蛋白激酶(gi|475503964|gb|EMT04589.1|)等酶活性。NO信号介导的信号级联是植物传递Cd胁迫信号的主要方式,丝氨酸/苏氨酸蛋白激酶可通过磷酸化作用传递这种信息,在Cd胁迫信号转导中具有重要意义[38],因此被筛选为候选基因。细胞壁中果胶、多糖及某些特定的蛋白质等可为结合重金属提供交换位点,阻止重金属进入原生质体[39],细胞壁对镉的富集作用多见报道。152条差异基因与碳水化合物转运和代谢相关,13条基因参与编码UDP葡萄糖-6-脱氢酶(gi|475592099|gb|EMT21987.1|),鉴于碳水化合物代谢在Cd解毒中的重要作用,而UDP葡萄糖-6-脱氢酶(gi|475592099|gb|EMT21987.1|)是碳水化合物代谢中的关键酶,因此被筛选为候选基因。这些数据表明,外源NO诱导草地早熟禾糖代谢及信号转导是其适应镉胁迫的策略之一。

图1 差异表达基因的GO功能分类Fig.1 GO functional classification of DEGs

图2 差异表达基因KEGG富集分析Fig.2 KEGG enrichment analysis of differentially expressed genes

图3 差异表达基因的qRT-PCR验证Fig.3 Validation of DEGs data by qRT-PCR
半胱氨酸生物合成是硫酸盐同化途径的最后一步,半胱氨酸在植物逆境反应中起着重要作用,是合成谷胱甘肽(Glutathione,GSH)的前体分子,GSH是主要的非蛋白硫醇[40],参与植物对重金属的解毒过程,是植物螯合素(Phytochelatins,PCs)合成前体,PCs可与有毒重金属离子结合,这些配合物通过ABC型转运体运输到液泡中[41]。谷氨酸在植物氨基酸代谢中占有中心地位,其碳骨架和α-氨基可合成γ-氨基丁酸、精氨酸和脯氨酸,精氨酸可与Cd形成配位体而降低毒害,同时,谷氨酸也是谷氨酰胺合成前体物质,而谷氨酰胺是木质部汁液运输的主要氨基酸[42-43]。甲硫氨酸是主要的含硫氨基酸,可以和Cd2+形成稳定螯合物[44]。通过KEGG通路分析,将Cd+NO处理组和Cd处理组进行对比发现,共有122条差异基因富集在氨基酸生物合成代谢、半胱氨酸和蛋氨酸代谢、苯丙氨酸代谢3条通路上,编码5-甲基四氢丙酰基谷氨酸-同型半胱氨酸甲基转移酶(EC:2.1.1.14)、谷氨酰胺合成酶(EC:6.3.1.2)、S-腺苷甲硫氨酸合成酶(EC:2.5.1.6)、蛋氨酸-γ-裂合酶(EC:4.4.1.11)的基因参与表达,这些结果表明,氨基酸合成与代谢可能参与了NO对草地早熟禾Cd胁迫的解毒过程。由于5-甲基四氢丙酰基谷氨酸-同型半胱氨酸甲基转移酶(EC:2.1.1.14)、S-腺苷甲硫氨酸合成酶(EC:2.5.1.6)、蛋氨酸-γ-裂合酶(EC:4.4.1.11)是半胱氨酸和甲硫氨酸合成的关键酶,因此被筛选为与Cd解毒相关候选基因。谷氨酰胺合成酶(EC:6.3.1.2)直接影响谷氨酰胺合成,从而影响木质部中重金属离子转运,对于中毒植物解毒具有重要意义[43],因此被筛选为与Cd解毒相关候选基因。
细胞壁对Cd封存防止其进入细胞,是植物防御Cd胁迫的策略之一[45]。Cd诱导细胞壁过氧化物酶活性增强细胞壁木质化[46-47],与此同时,Cd胁迫诱导氧化爆发产生ROS,其中信号分子过氧化氢再次触发编码过氧化物酶的基因表达,加重木质化,抑制植物生长[39]。木质素由单木脂醇(即正香醇、芥子醇和松木醇)组成,其生物合成需要一系列酶参与[48-49]。KEGG通路分析发现,镉处理下添加NO与单独镉处理相比,有139条差异基因富集在苯丙烷生物合成通路上,77条参与基因编码过氧化物酶(EC:1.11.1.7),诱导木质化,鉴于过氧化物酶(EC:1.11.1.7)的高表达及解毒功能,因此可以筛选为NO介导的与Cd解毒相关的候选基因。同时,苯丙氨酸氨裂解酶(EC:4.3.1.24)、咖啡酸3-O-甲基转移酶(EC:2.1.1.68)、莽草酸O-羟基肉桂酰转移酶(EC:2.3.1.133)和肉桂醇脱氢酶(EC:1.1.1.195)也参与愈创木质木质素、紫丁香木质素、对羟基苯基木质素等一系列产物合成,因此,NO诱导的早熟禾木质化可能是其抵御镉胁迫的重要机制。
4 结论
本研究基于转录组测序分析,初步揭示外源NO缓解草地早熟禾镉胁迫的分子机制。研究发现外源NO主要影响氨基酸生物合成、苯丙烷生物合成和信号转导相关的基因,如谷氨酰胺合成酶、谷氨酸-同型半胱氨酸甲基转移酶、蛋氨酸-γ-裂合酶、丝氨酸/苏氨酸蛋白激酶、S-腺苷甲硫氨酸合成酶和过氧化物酶等基因,抵御镉胁迫对草地早熟禾的毒害作用。同时,外源NO诱导的碳水化合物转运与代谢也参与了植物对镉的螯合,减轻镉胁迫对植物造成的不利影响。本文所鉴定的DEGs可用于分子标记或进一步研究外源NO对镉胁迫调节的功能分析。
