山楂不同炮制方法对5-羟甲基糠醛含量及抗氧化活性的影响
2019-12-20刘畅宫瑞泽张磊夏蕴实华梅孙印石
刘畅,宫瑞泽,张磊,夏蕴实,2,华梅,孙印石※
(1.中国农业科学院特产研究所,长春 130112;2.吉林农业大学,长春 130118)
大部分中药在加工和炮制过程中会产生5-羟甲基糠醛(5-HMF),其主要来源于加工过程中发生的美拉德反应(Maillard reaction)及焦糖化反应[1]。5-HMF 的产生与热加工程度密切相关,可用于指示中药的炮制程度,现已成为中药炮制原理研究的指标性成分,并且是近年来中药炮制研究的热点之一[2,3]。
山楂的炮制品有4 种,分别是生山楂、炒山楂、焦山楂和山楂炭,均是通过热加工炮制而成,热加工程度的不同造就了不同的外观形态和不同的药用功效。生山楂的酸味最强,药性较猛,其功效为活血散瘀、消化积食、降血脂;炒山楂颜色稍深,药性比生山楂温和,活血化瘀的能力较生山楂稍弱,用于积食停滞、脾虚食滞;焦山楂颜色更深,可消食导滞、治疗伴有积食的泻痢;山楂炭热加工程度最高,颜色最深,具有收敛作用,能治疗血积[4,5]。
不同山楂炮制品的不同功效与炮制加工过程中药材成分的变化密切相关。有研究发现,山楂的炮制随温度和加热时间的延长,总黄酮[5]、水溶性有机酸[6,7]、总磷脂含量下降[8],亚硝酸盐含量有所增加[8]。现代医学研究表明,热加工产生的5-HMF 具有抗氧化、改善血液微循环及流变性、改善心肌缺血、降血糖、影响甘草酸代谢等作用[1,5]。山楂中含有大量能够参与生成5-HMF 的前体类物质,因此,探讨山楂不同炮制品中5-HMF的产生和影响因素以及不同炮制品的抗氧化作用对研究山楂的加工炮制及药理药效具有重要意义。
1 材料、仪器与试剂
1.1 材料
原药材山楂于2018 年10 月购自山东临沂农贸市场,为蔷薇科植物山里红(Crataegus pinnatifida Bge uar. Major N.E.Br.)的成熟果实,参照《中国药典》中的山楂炮制方法[9]对样品进行炮制。生山楂:山楂切片后30℃烘干,放冷;炒山楂:取生山楂片置锅内用文火炒制颜色加深后取出,放冷;焦山楂:取生山楂片置锅内以武火炒至外表焦褐色,内部黄褐色后取出,放冷;山楂炭:取生山楂片,置锅内以武火炒至外表黑色,内部焦褐色后取出,放冷。实验前将4 种山楂炮制品分别进行粉碎过40 目筛后备用。
1.2 仪器与试剂
LC-16 型高效液相色谱仪〔岛津企业管理(中国)有限公司〕;Berghof Speed Wave MSW-4 型微波消解仪(德国 BERGHOF 分析集团有限公司);Hitachi L-8900 型全自动氨基酸分析仪〔日立(中国)有限公司〕;Perkin Elmer NexION 350X 型电感耦合等离子体质谱仪(美国珀金埃尔默股份有限公司);752N型紫外可见分光光度计(上海仪电科学仪器股份有限公司);5-HMF 标准品(纯度>99%,上海源叶生物科技有限公司);氨基酸混合标准液(H型,日本和光纯药株式会社);甲醇〔色谱纯,美国赛默飞世尔科技(中国)有限公司〕;其它试剂均为分析纯(北京化工厂)。
2 方法
2.1 5-HMF 含量测定
2.1.1 供试品溶液的制备 参考标准GB/T 18932.18-2003[10]及文献[11]的方法,准确称取山楂炮制品样品粉末2.0g,每个样品3 份,置于5mL离心管中,加10%甲醇30 mL,超声提取30 min,放冷,以10%甲醇补足减失的质量,4 000 min 离心5min,取上清,沉淀重复提取1 次,合并2 次上清液,用0.22m 滤膜滤过,作为供试品溶液。
2.1.2 对照品溶液的制备 精密称取对照品5-HMF,以10%甲醇配成230g/mL 的对照品储备液,4 ℃低温保存。
2.1.3 色谱条件[12]Hypersil ODS2 色谱柱(250 mm 4.6 mm,5m);流动相:水(A)-甲醇(B);梯度洗脱(0~5 min,5% A;5~15 min,5%~15% A;15~20 min,15%~0% A);流速:1.0 mL/min;检测波长:284 nm;柱温 30 ℃;进样量:20L。色谱图见图1。
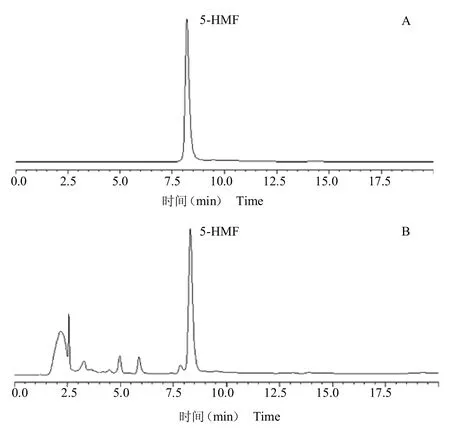
图1 5-HMF 对照品(A)和山楂样品(B)的色谱图Fig.1 HPLC of 5-hydroxymethylfurfural reference substances(A),C.pinnatifida sample(B)
2.1.4 线性关系考察 准确吸取5-HMF 对照品储备液适量,并进行梯度稀释成不同浓度的对照品溶液,按“2.1.3”项下色谱条件进行测定,以色谱峰峰面积为纵坐标(Y)、对照品浓度为横坐标(X),绘制标准曲线,得回归方程为Y =132 025 X-239 961,R2=0.999,结果表明,5-HMF 在2.3~230g/mL 线性关系良好。
2.1.5 精密度试验 准确吸取5-HMF对照品溶液20L,按“2.1.3”项下色谱条件进行分析,连续进样6 次,测定并计算5-HMF 峰面积的RSD 为2.05%,表明仪器精密度良好。
2.1.6 稳定性试验 准确吸取“2.1.1”项下焦山楂供试液20L,分别在 0、2、4、6、8、10 h 按“2.1.3”项下色谱条件进样测定,计算5-HMF 峰面积的RSD 为1.84%,表明该仪器在10 h 内稳定性良好。
2.1.7 重复性试验 准确称取焦山楂6 份,每份2.0 g,按“2.1.1”项下制得供试品溶液,精密吸取6 份供试品溶液各20L,按“2.1.3”项下色谱条件进样分析,测定峰面积RSD 为2.52%,表明本方法重复性良好。
2.1.8 回收率试验 精密称取6 份已知5-HMF 含量的焦山楂粉末1.5 g,加入适量的5-HMF对照品溶液,按“2.1.1”项下方法制备供试品溶液,按“2.1.3”项下色谱条件测定峰面积并计算含量及回收率。结果5-HMF的平均加样回收率为101.09%,RSD为1.82%,表明本方法加样回收率良好。
2.2 氨基酸含量测定
2.2.1 样品的前处理 参考标准GB/T5009.124-2016[13],精密称取山楂炮制样品500mg,加入6mol/LHCl20mL,110 ℃下水解22 h,冷却至室温。各取800L 于 70 ℃挥干溶剂。以0.02 mol/L HCl 溶解并定容2 mL,以0.22m 水系过滤器滤至样品瓶,上机备用。
2.2.2 氨基酸标准谱图的绘制 氨基酸混合标准液浓度2.5 mmol/L。以0.1 mol/L HCl 将混合标准液稀释1 000 倍,参考标准GB/T 5009.124-2016 对标准品进行上机测试。检测波长:570 nm 和440 nm。
2.3 总糖和还原糖含量的测定
2.3.1 供试品溶液的制备 准确称取山楂炮制品样品粉末0.50 g,加入30 mL 去离子水,于80 ℃水浴中提取30 min,放冷至室温后加入去离子水定容至50 mL,作为测定还原糖供试品溶液。准确称取山楂炮制品粉末0.5 g,加入10 mL 6 mol/L HCl 及15 mL 去离子水,沸水浴中提取30 min,滴1 滴酚酞指示剂,以6 mol/L NaOH 调至 pH 7.0,定容至 100 mL,以 I2-KI 判断是否水解完全,作为测定总糖供试品溶液。
2.3.2 对照品溶液的配制 105 ℃烘葡萄糖对照品至恒重,精密称取一定质量,以蒸馏水配制成0.1~1.0mg/mL的对照品溶液。
2.3.3 标准曲线的绘制 精密吸取1.0 g/L 的葡萄糖对照品溶液 0、0.1、0.2、0.3、0.4、0.5 mL 于 5 mL 离心管中,加蒸馏水至0.5 mL,加0.5 mL DNS 显色液,涡旋混匀后置沸水浴保持5 min,迅速冷却,各加入4 mL去离子水,摇匀后以空白管为对照,测定540 nm 波长处的吸光度(A)。以葡萄糖质量浓度为横坐标(X)、A 值为纵坐标,绘制标准曲线,计算线性回归方程为Y=0.812 7 X+0.012 1,R2=0.999 1,线性范围为0.2~1.0 mg/mL。
2.4 总有机酸测定
采用中和滴定方法,参照文献[5],以酚酞指示剂确定滴定终点。准确称取各山楂炮制品粉末1.0 g,加入去离子水100 mL,浸泡4 h,期间不时摇晃。过滤后各取25 mL,加入50 mL 去离子水,加入2 滴酚酞,以0.1 mol/L NaOH 滴定。总有机酸以NaOH 相当于枸橼酸的量表示[14]。
2.5 总黄酮的测定
2.5.1 供试品溶液的制备 精密称取各山楂炮制品粉末1.0 g,加入35 mL 乙醇-水溶液(乙醇与水的体积比为 75∶100),80 ℃回流提取 1.5 h,提取 3 次,合并提取液,于蒸发皿蒸干。各蒸干样品加入40 mL 水溶解,过0.45m 滤膜待用。
2.5.2 标准溶液的制备 配置芦丁标准溶液2 mg/mL待用。
2.5.3 标准曲线的绘制 采用NaNO2-Al(NO3)3-NaOH 法。参照2015 版药典方法[9](稍有改动),精密吸取 2.0mg/mL芦丁对照品溶液0、0.6、1.2、1.8、2.4、3.0、3.6 mL 于25 mL 容量瓶中,加入去离子水至6 mL,分别加入5%NaNO2溶液1mL摇匀,放置6 min,分解加入1% Al(NO3)3 溶液1 mL,摇匀,放置6 min,分别加入4%NaOH溶液10 mL,再加水至刻度,放置15 min,在波长500 nm 下测定吸光度,绘制标准曲线。
2.5.4 供试样品的测定 精密吸取待测样5 mL,按“2.5.3”项下的方法测定供试样品的吸光度。总黄酮含量按芦丁计算。
2.6 1,1 一二苯基-2-三硝基苯肼(DPPH)测定[15]
将19.7 mg DPPH溶解于无水乙醇中,定容至100 mL容量瓶中,避光。临用前用乙醇稀释,在525 nm 处测定其吸光度满足0.70 ± 0.05 为工作液。取各浓度供试溶液(0~20 mg/mL)0.2mL,加入DPPH 溶液3.8mL,摇匀,避光反应30 min后,以80%乙醇为空白调零,在525 nm 处测定其吸光度。按照清除率=(A0 A1)/A0 100%计算DPPH 自由基清除率。
3 结果与分析
3.1 山楂炮制品中5-HMF的含量
不同山楂炮制品中的5-HMF 含量见表1,由表1可知,生山楂中5-HMF含量未检测出,炒山楂、焦山楂、山楂炭中5-HMF 的含量分别为1.10、1.59、4.41g/kg。通过比较发现,不同山楂炮制品中5-HMF含量存在一定规律,即随着热加工程度的提高,5-HMF 的含量也随之提高。生山楂中5-HMF 含量未检测出,而热加工程度较高的山楂炭中5-HMF含量最高,这说明炮制过程中的高温处理是5-HMF 产生的主要原因。高温不仅加快了糖类物质的脱水缩合,也加剧了山楂中糖类与氨基酸发生美拉德反应的程度。
3.2 不同山楂炮制品的氨基酸含量
山楂不同炮制品的氨基酸含量见表2,由表2 可知,生山楂、炒山楂、焦山楂、山楂炭中总氨基酸含量为1 022.57、1 149.04、689.47、146.35 mg/100g,含量较高的有天冬氨酸、谷氨酸、亮氨酸、赖氨酸,含量下降较明显的有天冬氨酸、丝氨酸、甘氨酸、精氨酸、赖氨酸、组氨酸。4 种山楂炮制品随热加工程度的提高,氨基酸总量呈现锐减的趋势,推测热加工过程中发生美拉德反应并生成了5-HMF 等产物是造成氨基酸含量降低的主要原因。其中,组氨酸、赖氨酸、精氨酸为碱性氨基酸,在美拉德反应中反应速度比其它氨基酸快,因此其含量下降最为明显,对山楂炮制品中5-HMF的生成贡献较大。

表1 不同山楂炮制品中5-HMF 含量Table 1 5-hydroxymethylfurfural content of C.pinnatifida with different processing method
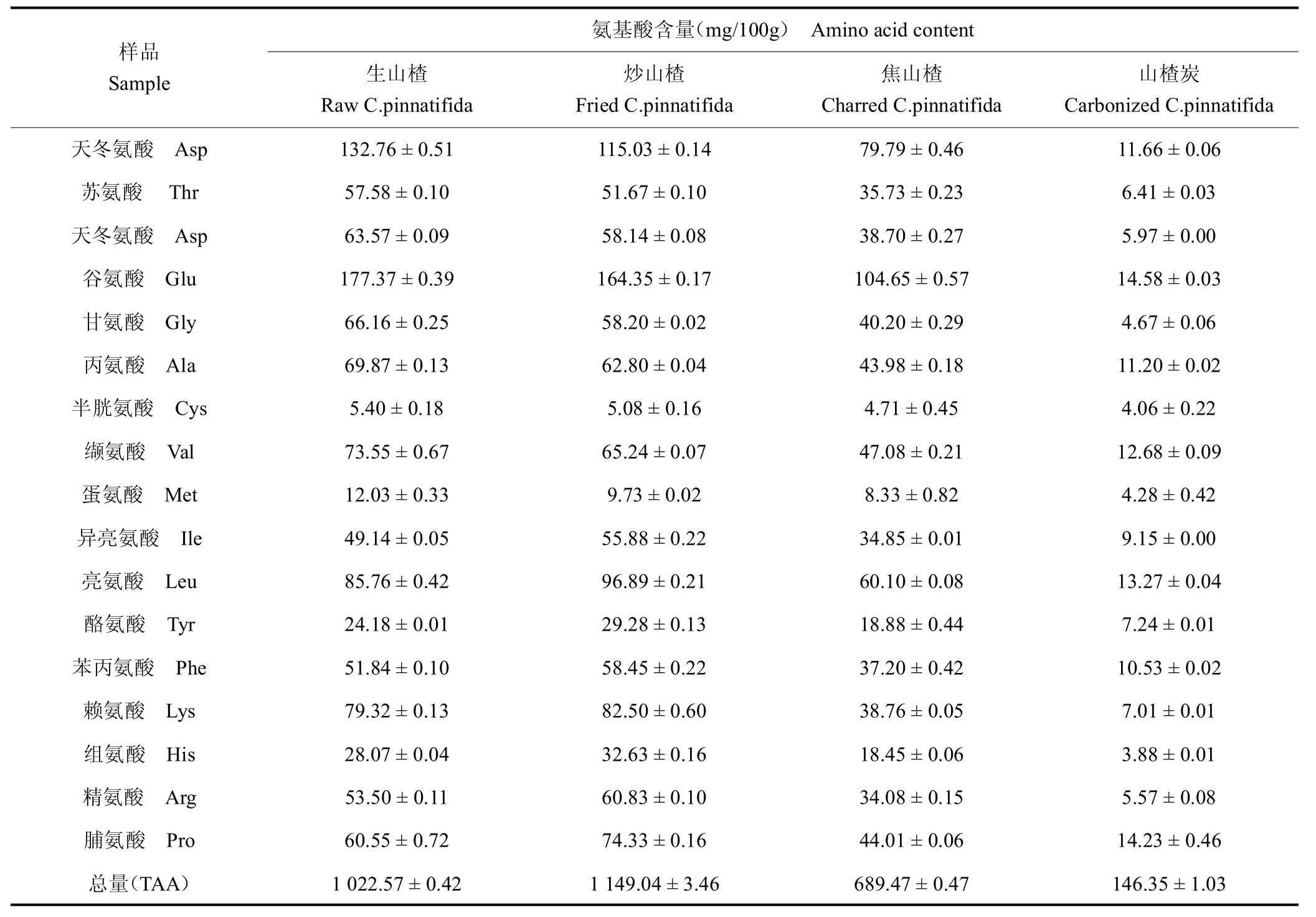
表2 不同山楂炮制品中氨基酸含量Table 2 Amino acids content of C.pinnatifida with different processing method
3.3 不同山楂炮制品的总糖和还原糖含量
不同山楂炮制品的总糖和还原糖含量见表3,由表3 可知,生山楂、炒山楂、焦山楂、山楂炭的总糖含量分别为 7.94、7.93、7.18、6.48 mg/kg,还原糖含量分别为6.05、5.66、4.84、4.00 mg/kg。5-HMF 的形成与糖含量丰富食品的热加工过程密切相关,主要由以下2 种途径产生:一是糖类成分在酸性环境中受热分解产生,且含量随着温度的升高而增加[16];二是羰基化合物(还原糖类)与氨基化合物(蛋白质和氨基酸)发生美拉德反应而产生[17]。通过对山楂炮制品中总糖和还原糖的检测发现,随着热加工程度的提高,山楂炮制品中总糖与还原糖的含量均出现显著降低(P <0.05),这与各山楂炮制品中5-HMF 的变化规律相吻合,且还原糖降幅更大,这是因为参与美拉德反应的糖主要是还原糖。
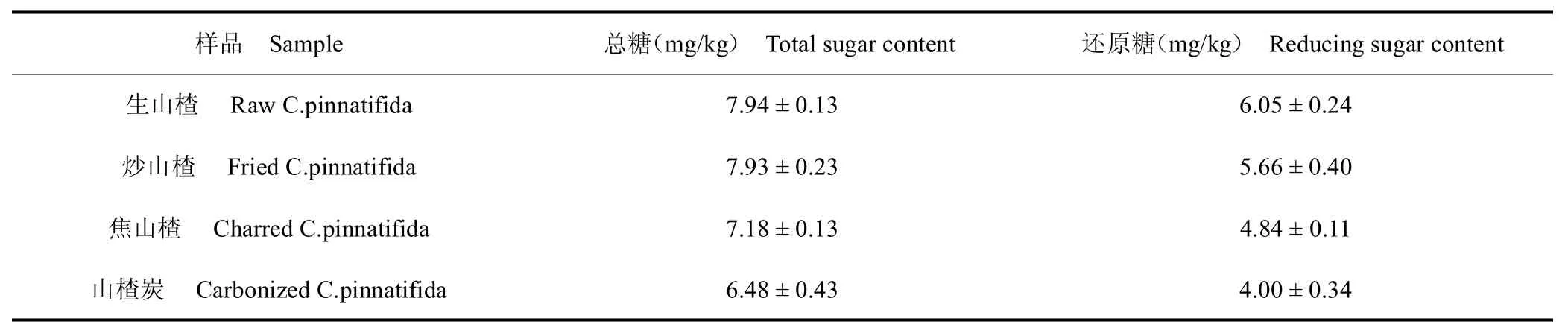
表3 不同山楂炮制品的总糖和还原糖含量Table 3 Total sugar and reducing sugar content of C.pinnatifida with different processing method
3.4 不同山楂炮制品中有机酸含量
不同山楂炮制品中有机酸含量见表4,由表4 可知,生山楂、炒山楂、焦山楂、山楂炭中有机酸含量分别为相当于枸橼酸含量87.08、79.40、71.72、58.92 mg/g。中药炮制过程中有机酸对5-HMF生成影响较复杂,有研究者发现,在高温液态水中部分有机酸的存在能促进果酸→5-HMF→乙酰丙酸的反应速度,有些种类的酸(例如:乙酸)主要促进中间产物5-HMF 的生成,有些种类的酸(例如:甲酸)既能促进5-HMF 的生成,又能促进其分解[18]。山楂中有机酸的种类较多,主要是柠檬酸[19],柠檬酸是一种三羧酸化合物,受热易分解。有研究表明,柠檬酸对于美拉德反应体系中5-HMF的产生具有催化作用[20],但也有研究表明,在富含有机酸的中药(如:五味子)的炮制中,有机酸的含量对于5-HMF 的产生并无明显影响[21,22]。
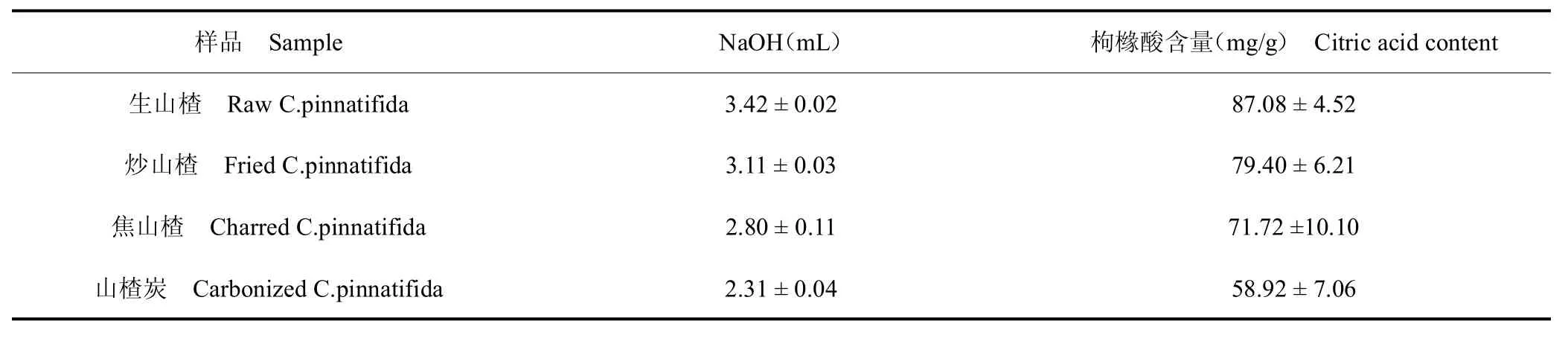
表4 不同山楂炮制品中总有机酸含量Table 4 The total organic acids content of C.pinnatifida with different processing method
3.5 不同山楂炮制品中总黄酮的含量
不同山楂炮制品中总黄酮含量见表5,由表5 可知,生山楂、炒山楂、焦山楂、山楂炭中总黄酮含量分别为 166.75、160.17、55.85、49.45 mg/g。随加热程度的提高,总黄酮含量呈现明显的下降趋势。这是因为,以芦丁为代表的黄酮类化合物,在高温加热时会发生分解,尤其是焦山楂和山楂炭,加热温度均可达到200 ℃以上,在此温度下,黄酮类化合物的分解加速[23],因此测得相应样品的总黄酮含量降低。刘黄友等[24]的研究表明,几种最常见的天然黄酮在一定温度和时间范围对5-HMF的产生具有抑制作用,推测可能高温导致黄酮类的降解,使其浓度低于美拉德反应生成5-HMF的最佳抑制浓度,因此,有利于5-HMF 含量的积累。但山楂总黄酮对5-HMF的抑制作用作用未见报道,尚需进一步研究。总黄酮中的黄酮苷水解产生的糖类化合物则可能为5-HMF的产生提供反应原料,尽管其含量不高,但这部分糖类化合物对于5-HMF的产生可能发挥的促进作用不应被忽视。
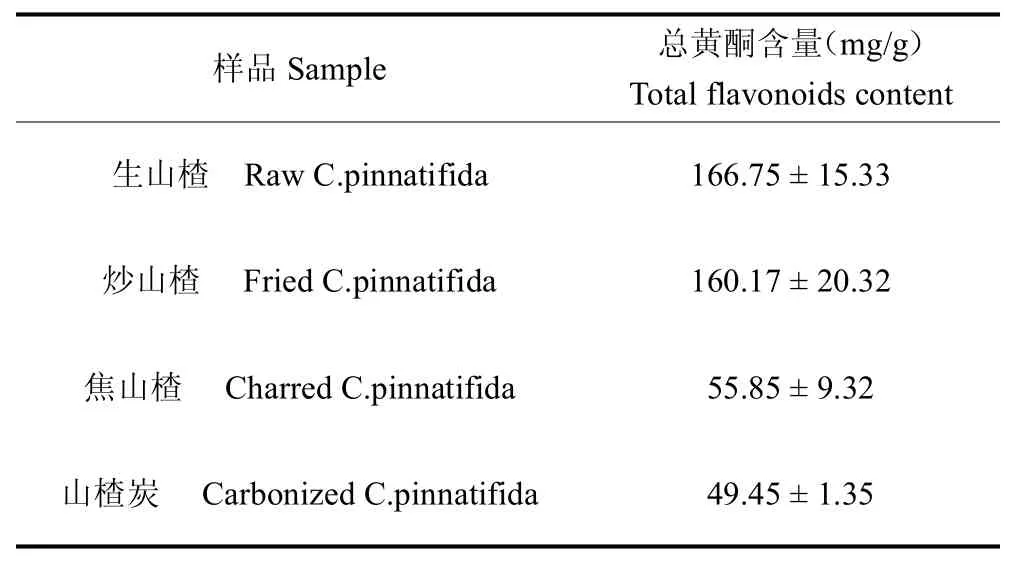
表5 不同山楂炮制品中总黄酮含量Table 5 The total flavones content of C.pinnatifida With different processing method
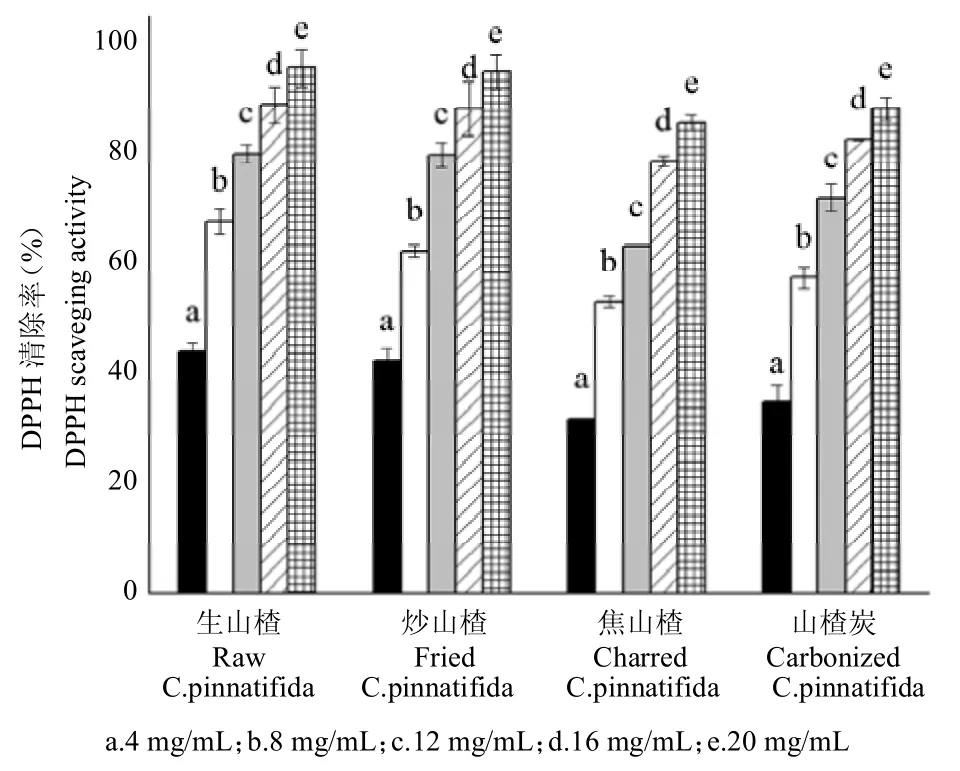
图2 不同山楂炮制品提取液DPPH 自由基清除率Fig.2 DPPH free radical scavenging rate of C.pinnatifida with different processing method
3.6 4种山楂炮制品提取液的DPPH抗氧化活性
不同浓度提取液的DPPH自由基清除率结果见图2。随着山楂各炮制品提取液浓度的提高,DPPH 自由基清除率呈现上升的趋势。生山楂20.0 mg/mL 提取液的DPPH自由基清除率为95.60%,随着热加工程度的提高,DPPH自由基清除活性出现下降;相同提取液浓度下炒山楂的DPPH自由基清除率为94.90%、焦山楂为85.65%;山楂炭虽然热加工程度进一步提升,但其相同浓度提取液的DPPH 自由基清除率(88.16%)反而略有提升。4 种山楂炮制品的IC50 分别为5.20、5.69、7.70 mg/mL 和6.77 mg/mL。IC50 的数值反应了山楂炮制品提取物的抗氧化活性,生山楂的抗氧化能力最强,炒山楂和焦山楂依次下降,山楂炭抗氧化能力较焦山楂略有提升。
随着热加工程度的提高,生山楂、炒山楂、焦山楂和山楂炭DPPH 自由基的清除活性存在一定规律,即先下降后上升。黄酮及多酚等对于植物样品的抗氧化作用起着主要作用,许多研究者证实,样品中黄酮含量与抗氧化能力正相关[25,26],且差异显著。鲁青松等[27]的研究结果也证实了有机酸具有较强的抗氧化活性。在本研究中,随着热加工程度的提高,总黄酮和有机酸破坏程度提高,其含量出现大幅下降,这可能与生山楂、炒山楂、焦山楂的抗氧化活性依次下降有关,而热加工程度最高的山楂炭的 DPPH 自由基清除活性却相对焦山楂略有提高。尽管许多研究者证实了美拉德反应产物的抗氧化活性[28-29],王淳等[29]的研究表明,在中药黄精炮制过程中美拉德反应产物对DPPH自由基的清除率虽然随炮制时间延长呈增加趋势,但因山楂中的成分复杂,仍然不能确认山楂炭提取物的抗氧化能力的提升是由美拉德反应产物所引起的,因此,山楂炮制品抗氧化能力变化的物质基础仍然需要进一步研究验证。
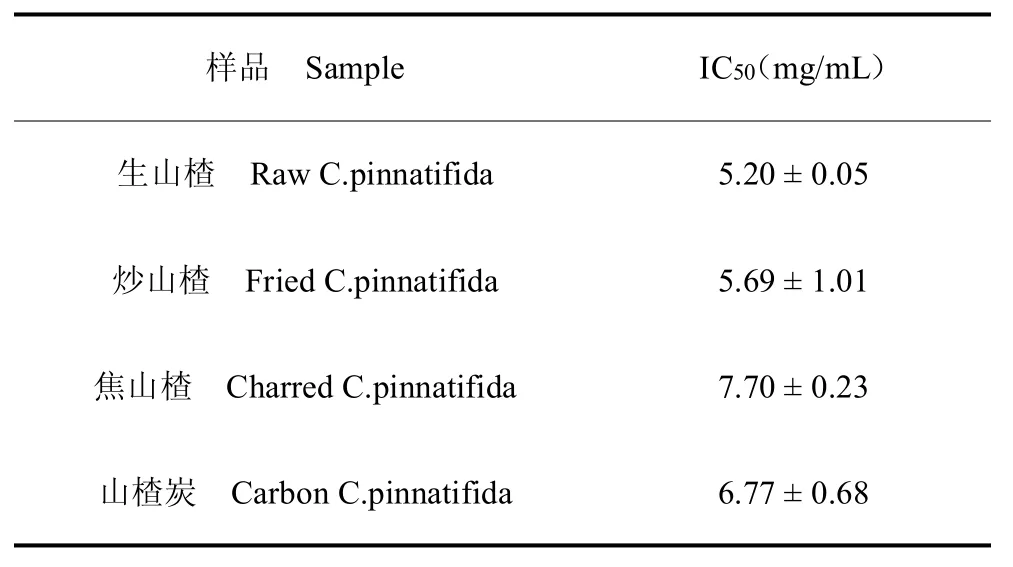
表6 不同山楂炮制品提取液的IC50Table 6 IC50 of C.pinnatifida with different processing method
4 结论
5-HMF 广泛存在于中药材的加工炮制品中。本研究首次报道了不同山楂炮制品5-HMF的含量,对研究各山楂炮制品成分和药理药效的关系具有重要意义。随着热加工程度的提高,山楂炮制品中5-HMF 含量显著增加,山楂炭中5-HMF 的含量达到最高。
通过检测山楂炮制加工过程中一些化学成分的变化,探讨山楂炮制过程中影响5-HMF 产生的因素。炮制品中的氨基酸、总糖、还原糖、有机酸、黄酮类物质随着热加工程度的提高均呈现出有规律的变化,本试验得到的变化规律同已有研究结果[8]相吻合。其中,5-HMF 的生成消耗了氨基酸、总糖及还原糖,使其含量下降,尤其是碱性氨基酸和还原糖。在山楂的炮制中,热加工导致有机酸和黄酮类物质破坏程度加大,其与5-HMF 的生成关系,有待进一步研究。
加工炮制使得多种成分发生变化,其抗氧化活性也具有规律性的变化。山楂中本身含有许多抗氧化物质,如黄酮类成分和有机酸等。热加工程度的提高对这些物质的破坏逐渐增加,导致抗氧化能力的下降。山楂炭的热加工程度最高,而抗氧化能力较焦山楂略有提高,可能由于热加工产生了新的物质,如美拉德反应产物,但其物质基础仍然需要进一步实验验证。
